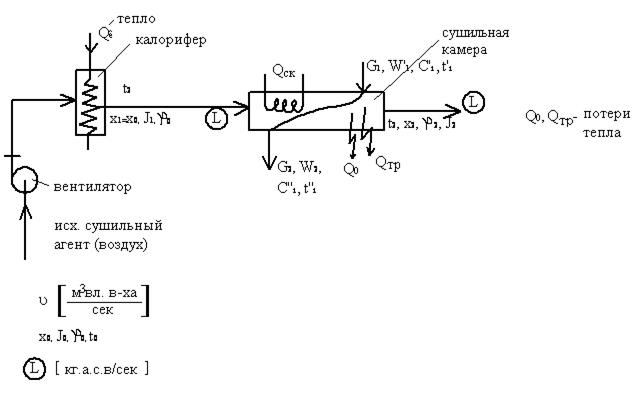
Тепловой баланс





 - потери тепла с уходящим материалом
- потери тепла с уходящим материалом
 - удельный расход а.с.в.
- удельный расход а.с.в. 
Удельные потери тепла:
 ;
;  ;
; 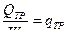 ;
; 

 - суммарные удельные потери тепла
- суммарные удельные потери тепла
 - уравнение реального процесса сушки
- уравнение реального процесса сушки
 характеризует отклонение реального процесса сушки от идеального
характеризует отклонение реального процесса сушки от идеального

| - уравнение идеального процесса сушки
|
в идеале  ;
; 
Расчет простой сушилки
Дано: G1, W1, W2
t0,φ0 t1 t2

|
| А
| B
| Cтеор
| Cдейств
|
x, 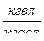
| x0
| x1= x0
| (x2)T
| (x2)g
|
| t,0C
| t0
| t1
| t2
| t2
|
| φ,%
| φ0
| φ1
| (φ2)T
| (φ2)g
|
J, 
| J0
| J1
| J2= J1
| (J2)g
|

АВ – процесс нагрева воздуха в калорифере
ВСТ – теоретический процесс сушки
ВСg – действительный процесс сушки
Δ=qCK+CH  Ot
Ot 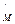 -
-  ; пусть Δ>0, тогда J2-J1=
; пусть Δ>0, тогда J2-J1=  и J2>J1
и J2>J1
Расчет:
1. W=G1 
2. lg=  ;
; 
3. Lg  =lg·W
=lg·W
4.  , Vy=f(x0,t0)
, Vy=f(x0,t0) 
5. Расход тепла в калорифере Qкал= Lg(J1- J0)[квт]
Основы теории массообмена
В технологии водоподготовки и очистки сточных вод важное условие имеют процессы массообмена, которые характеризуются переходом одного или нескольких веществ из одной фазы в другую. Путем переноса одного или более компонентов из фазы в фазу можно разделять как гомогенные так и гетерогенные системы.
Виды процессов массопередачи:
- Абсорбция – поглощение газа жидкостью, обратный процесс- десорбция.
- Экстракция (в системе жидкость-жидкость)- извлечение вещества, растворенного в жидкости, другой жидкостью, практически не смешивающейся с первой. Обратный процесс- реэкстракция.
- Перегонка – разделение гомогенных жидких смесей путем взаимного обмена компонентами между жидкостью и паром, полученным испарением разделяемой смеси.
- Адсорбция – поглощение компонента газа, пара или раствора твердым пористым поглотителем. Обратный процесс – десорбция.
- Разновидностью адсорбции является ионный обмен – хемосорбция.
- Сушка-удаление влаги из твердых материалов путем испарения.
- Кристаллизация – выделение твердой фазы в виде кристаллов из растворов или расплавов.
- Выщелачивание – переход твердой фазы в жидкую за счет избирательного растворения.
Массопередача включает в себя перенос вещества внутри одной фазы, перенос через поверхность раздела фаз и перенос в пределах другой фазы.
Массоперенос между фазами осуществляется до достижения равновесия, которое характеризуется равенством скоростей прямого и обратного процессов.
Фазовое равновесие на примере жидкостной экстракции
↓ ↓
Фазовое равновесие в жидкостной экстракции
1. Системы с взаимной нерастворимостью фаз
Равновесные кривые для системы вода-бензойная кислота-керосин

ур=mpх
mp- отношение равновесных концентраций переходного компонента (ПК) в экстракте и рафинате
2. Системы с частично взаимной разностью фаз.
Фазовое равновесие таких систем изображено в треугольной диаграмме

Вершины характеризуют индивидуальные компоненты
Стороны – бинарные смеси
М - тройная система, где хн+хр+хэ=1
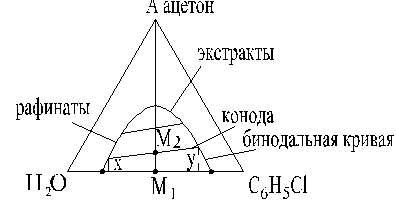
АМ1-смешение,
конода-линия равновесных концентраций, mp=у/х;
бинода- линия расслаивания, делит треугольник на 2 области – гомогенных растворов I и гетерогенной области – область расслаивания

Внешнее давление не влияет на фазовое равновесие при жидкостной экстракции (ЖЭ).

С ростом температуры уменьшается гетерогенная область, т.к. увеличивается взаимная разность фаз, t3>t2> t1,
Непрерывная противоточная экстракция при взаимной нерастворимости фаз.

Материальный баланс по потокам:
WхH+DУ=Wх+DуК
Линия, характеризующая изменение концентраций в процессе массообмена называется рабочей линией и описывается уравнением:
у=  (х-хн)+ук – рабочая линия
(х-хн)+ук – рабочая линия
Процесс массообмена характеризуется равновесной и рабочей линиями, которые изображены на графике:

Адсорбция
Селективное поглощение твердых или жидких компонентов из жидкой и газовой среды с помощью твердых сорбентов называется адсорбцией. Адсорбция применяется при малых концентрациях извлекаемых веществ.
Требования к сорбентам:
1. Селективность.
2. Высокая емкость по поглощаемому компоненту
3. Легкость регенерации.
4. Прочность гранул сорбента.
Сорбенты – высокопористые вещества, активная поверхность пор достигает 100÷5000  , размер пор 20 А0.
, размер пор 20 А0.
По характеру взаимодействия поглощающего компонента и сорбента различают физическую, химическую (хемосорбция) адсорбцию и капиллярную конденсацию.
При физической адсорбции возникает разность во взаимном притяжении молекул в объеме и на границе раздела фаз, проявляется за счет изменения сил Вандер-Ваальса.
Капиллярная конденсация – адсорбция из газовых, паровых сред
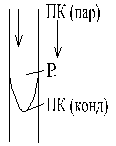
Промышленные сорбенты:
Активированные угли (АУ), активная поверхность пор Sакт=600÷2000 м2/г
Селикагели (Si2O·nH2O)
Алюмогели [Al(OO)3+Al2O3] активная поверхность пор Sакт = 600 м2/г
Цеолиты – молекулярные сита, поглощают молекулы, размеры которых соответствуют размерам пор, характеризуются наибольшей селективностью.
Иониты – ионообменные смолы (хемосорбция)
Фазовое равновесие при физической адсорбции

 - равновесная концентрация в растворе;
- равновесная концентрация в растворе;
х=[  ] - равновесная концентрация на сорбенте;
] - равновесная концентрация на сорбенте;
С ростом температуры поглощающая способность уменьшается.

В области низких концентраций равновесные состояния описывает уравнение Фрейндлиха:
У=кХn,
к и n – константы, которые могут быть определены экспериментально.
Изотермы сорбции приведены на рисунке:
При хемосорбции При капиллярной конденсации


Рабочие диаграммы процессов
Прямоток Противоток


W, D – потоки инертов х, у – концентрации.

Матбаланс по переходному компоненту




Уравнение рабочей линии – геометрическое место сопряженных концентраций.
Сопряженные концентрации – концентрации переходного компонента в потоках, встречающихся в одном сечении аппарата

| W=const
D= const
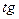 α= α= 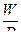
| 
| D=const
W= const
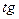 α= α= 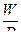
|
Совмещение линии равновесия и рабочей линии
Эффективность массообменных процессов оценивается числом теоретических тарелок (ступеней)
Теоретическая тарелка – гипотетическое устройство, где  или
или 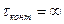 , что приводит к достижению равновесия
, что приводит к достижению равновесия

| xn и yn – равновесие концентрации→линия равновесия.
 концентрации потоков, встречающихся в одном сечении концентрации потоков, встречающихся в одном сечении  колонны, - (сопряженные концентрации) рабочая линия колонны, - (сопряженные концентрации) рабочая линия
|
 противоток
противоток


Для прямотока О<Nтеор  О<Nтеор
О<Nтеор 
Число действ. тарелок Ng= 

Число действительных тарелок определяется графическим методом, базируясь на реальную рабочую линию – построенную по реальному профилю концентраций.










 - потери тепла с уходящим материалом
- потери тепла с уходящим материалом - удельный расход а.с.в.
- удельный расход а.с.в. 
 ;
;  ;
; 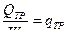 ;
; 

 - суммарные удельные потери тепла
- суммарные удельные потери тепла - уравнение реального процесса сушки
- уравнение реального процесса сушки характеризует отклонение реального процесса сушки от идеального
характеризует отклонение реального процесса сушки от идеального
 ;
; 

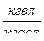


 Ot
Ot 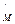 -
-  ; пусть Δ>0, тогда J2-J1=
; пусть Δ>0, тогда J2-J1=  и J2>J1
и J2>J1
 ;
; 
 =lg·W
=lg·W , Vy=f(x0,t0)
, Vy=f(x0,t0) 






 (х-хн)+ук – рабочая линия
(х-хн)+ук – рабочая линия
 , размер пор 20 А0.
, размер пор 20 А0.

 - равновесная концентрация в растворе;
- равновесная концентрация в растворе; ] - равновесная концентрация на сорбенте;
] - равновесная концентрация на сорбенте;










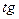 α=
α= 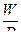

 или
или 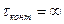 , что приводит к достижению равновесия
, что приводит к достижению равновесия
 концентрации потоков, встречающихся в одном сечении
концентрации потоков, встречающихся в одном сечении  противоток
противоток

 О<Nтеор
О<Nтеор 





