ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ
Витамины – группа необходимых для жизнедеятельности организма органических низкомолекулярных веществ, синтез которых в организме ограничен или отсутствует.
Функции витаминов:
· кофакторы ферментов (В1,В2,В6, РР,В12,ФК),
· антиоксиданты (С,Е, каротиноиды),
· предшественники гормонов (Д)
Классификация витаминов:
· водорастворимые (В1,В2,РР,С,В6) – не депонируются в тканях,
· жирорастворимые (А,Д,Е,К) – депонируются в организме, вит. А и Д при передозировке токсичны.
Химическая классификация витаминов:
· Алифатические, терпеноиды – ретинола ацетат
· Алифатические, стероиды – холекальциферол, эргокальциферол
· Ароматические, произв.нафтохинона – менадион, менадиона натрия бисульфит
| Витамин
| ФС
| Хим структура
|
| A
| Ретинола ацетат и другие эфиры
| Алифатические (алициклическая), терпеноиды
|
| D
| Эргокальциферол (D2), Холекальциферол(D3)
| Алифатические (алициклическая), стероиды
|
| K
| Менадион (К3), менадиона натрия бисульфит (пролекарство)
| Ароматтическая, пр:нафтохинона
|
| C
| аскорбиновая кислота
| ГЦ, произв.фурана
|
| E
| альфа-токоферилацетат
| ГЦ, произв.хромана
|
| P
| рутозид тригидрат
| ГЦ, произв.флавона
|
| B12
| цианокобаламин, кобамид
| ГЦ, тетрапирролы
|
| В6
| пиридоксина гидрохлорид
| ГЦ, произв.пиридинметанола
|
| РР (В3)
| никотиновая кислота, никотинамид
| ГЦ, произв. Пиридин-3-карбоновой кислоты
|
| В1
| тиамина гидрохлорид
| ГЦ, произв. Пиримидинтиазола
|
| В9
| фолиевая кислота
| ГЦ, произв.птеридина
|
| В2
| Рибофлавин
| ГЦ, произв.бензоптеридина
|
АТХ классификация витаминов
· А11А мультивитамины, комбинации
· А11В мультивитамины, индивидуальные
· А11С витамины А и Д, включая комбинации этих витаминов
· А11Д витамин В1, индивидуальный и в комбинации с В6 и В12
· А11Е комплексы витаминов В, включая комбинации
· А11G Аскорбиновая кислота, включая комбинации
· А11Н другие индивидуальные витамины
· А11J другие витаминные продукты, комбинации
Аскорбиновая кислота – y-лактон 2-оксогулоновой кислоты (2,3-дегидро-L-гулоновой кислоты) либо ГЦ соединение – произв.фурана
| 5-(1,2-дигидроксиэтил)-3,4-дигидроксифуран-2(5Н)-ОН
| |
| Енольная форма гамма-лактона 2-оксо-L-гулоновая к-та
| |

В молекуле аскорбиновой кислоты присутствует 2 центра хиральности, поэтому она существует в виде 4 стереоизомеров. Витаминной активностью обладает только L-АК. ИАК в природе не встречается.
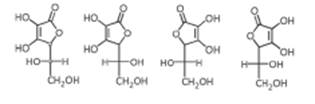
L-АК Д-АК L-ИАК Д-ИАК
Аскорбиновая кислота является двухосновной. При рН 7,4 она находится в растворе в виде моноаниона.

Аскорбиновая кислота может обратимо окисляться до дегидроаскорбиновой кислоты
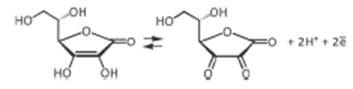
При гидролизе дегидроаскорбиновой кислоты образуется 2,3-диоксо-L-гулоновая кислота, которая далее необратимо окисляется до L-треоновой и щавелевой кислот.
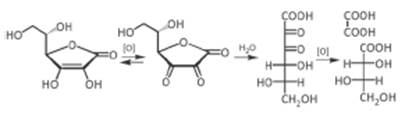
В водных р-рах АК неустойчива. В кристаллическом состоянии она устойчива к окислению.
Некоторые биологические функции АК:
· создание ОВ потенциала в клетке, влияющего на активность ферментов;
· реакции гидроксилирования (триптофана при синтезе серотонина);
· участие в ОВР (образование ТГФК)
Флавоноиды – группа природных полифенольных соединений, в молекулах которых содержится 2 бензольных кольца, связанных трехуглеродной связью.
Бифлавоноиды – группа флавоноидов, способных уменьшать проницаемость капилляров.
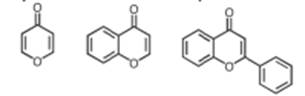
Одним из бифлавоноидов является рутозид, относящийся к производным флавона. Кетон, содержащий оксогруппу в 4 положении пиранового цикла, носит название у-пирон. Бициклическая система, образующаяся при конденсации молекул у-пирона и бензола, называется хромоном. 2-фенилхромон имеет название флавон.
рутиноза
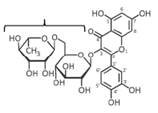
Альфа-L-рамнопираноза
Бета-Д-глюкопираноза
Кверцетин
1-6-гликозидная связь
Рутозид обычно применяется совместно с АК в качестве капилляроукрепляющего ЛС при комплексном лечении избыточной проницаемости капилляров.

Троксерутин
Гидроксиэтильное производное рутозида (простой эфир рутозида и этиленгликоля). Избирательно накапливается в эндотелиальном слое венул, обладает антиоксидантным действием. Уменьшает повышенную проницаемость капилляров и оказывает венотоническое действие.
Кобаламины – группа природных соединений, в основе которых лежит корриновый комплекс кобальта (3). В состав корриновой системы входят три пирролиновых и один пирролидиновый циклы, связанные друг с другом тремя метиновыми мостиками. Молекула коррина не является ароматической.
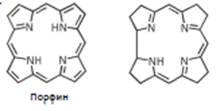 коррин
коррин
Кобальт: КЧ =6, СО=+3. Четыре ковалентные связи образуются при взаимодействии Со3+ с атомами азота циклической системы, одна связь – с атомом азота диметилбензимидазольного остатка. С шестой связью могут быть связаны различные группы. Цианокобаламин – артефакт, образующийся при выделении витамина.
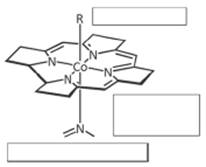 R-разные группы, корриновая система(плоская), бензимидазольное ядро.
R-разные группы, корриновая система(плоская), бензимидазольное ядро.
Кобамид – рибонуклеотид 5,6-диметилбензимидазола.
· Восемь метильных групп(1а,2а,5,7а,12,12а,15, 17в);
· семь амидных групп, среди которых четыре пропионамидные (3,8,13,17 – все а) и три ацетамидные (2,7,18 – все в).
· пропионамидная группа в 17 положении связана через остаток 1-аминопропанола-2 с нуклеотидом.
Лиганды:
· CN- (цианокобаламин, В12),
· ОН-(гидроксикобаламин, В12а),
· Н2О(аквакобаламин, В12в),
· NO2-(нитритокобаламин, В12с),
· СН3-(метилкобаламин, В12),

Ферменты, в состав которых входит В12:
· метилмалонил-КоА-мутаза (метилкобаламин),
· 5-метилтетрагидрофолат гомоцистеин метилтрансфераза (кобамамид)
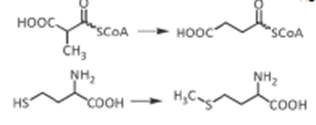
Пернициозная анемия (В12-дефицитная) – заболевание, вызванное нарушением кроветворения из-за дефицита витамина В12 в организме.
· Недостаточное поступление В12 с пищей,
· недостаточная выработка ВФК в париетальных клетках желудка,
· патологические процессы в подвздошной кишке,
· конкуренция за В12 со стороны ленточных червей и бактерий.
Производные пиридинметанола
Структура 5-гидроксиметилпиридина (пиридинметанола) лежит в основе В6, к которому относятся три соединения, имеющие разные заместители в четвертом положении пиридинового цикла.

Пиридоксин Пиридоксаль Пиридоксамин
Активные формы В6

Пиридоксальфосфат Пиридоксаминфосфат
· Ферменты, участвующие в переаминировании АК
· Ферменты, участвующие в декарбоксилировании АК
· Фосфорилаза гликогена
Применяют при заболеваниях нервной системы (паркинсонизм, радикулиты, невриты), при атеросклерозе, СД, кожных заболеваниях, а также при токсикозе беременных, гиповитаминозе В6.
Рибофлавин
В основе молекулы рибофлавина лежит структура изоаллоксазина, являющегося производным бензоптерина.
 бензоптеридин, аллоксазин, изоаллоксазин
бензоптеридин, аллоксазин, изоаллоксазин

В 7 и 8 положениях метильные группы, в 10 – четырехатомный спирт Д-рибитол. В последнем три центра хиральности – 2 и 3 атомы имеют S, а 4 – R-конфигурацию. Рибофлавин оптически активен и вращает плоскость поляризации влево.
Биологическое действие рибофлавина основано на его ОВ свойствах:

Активные формы рибофлавина: ФМН,ФАД
 Рибофлавин натрия фосфат
Рибофлавин натрия фосфат
Флавиновые ферменты:
· сукцинат ДГ,
· оксидазы аминокислот,
· моноаминооксидаза,
· глутатионредуктаза.
При недостатке рибофлавина появляются трещины в углах рта, возникают заболевания кожи, поражается слизистая полости рта, сетчатка и роговица, нарушается работа ССС и ЖКТ. Как ЛС рибофлавин применяется при гиповитаминозах и авитаминозах, заболеваниях глаз, длительно незаживающих ранах и язвах, заболеваниях ЖКТ.
Синтез аскорбиновой кислоты



Синтез рутозида

Синтез пиридоксина

Синтез никотиновой килоты

Синтез никотинамида

Синтез тиамина гидрохлорида можно получить при взаимодействии 4- амино-5-бромметил-2-метилпиримидина и 5-(2-гидроксиэтил)-4-метил- тиазола:

Схемы синтеза производных пиримидина и тиазола из, соответ  ственно, 3-этоксипропионитрила и 3-бром-4-оксопентилового эфира уксусной кислоты могут быть такими:
ственно, 3-этоксипропионитрила и 3-бром-4-оксопентилового эфира уксусной кислоты могут быть такими:

Синтез фолиевой кислоты

Синтез рибофлавина


При взаимодействии аскорбиновой кислоты с раствором серебра нитрата в присутствии азотной кислоты образуется серый осадок.

Для идентификации рутозида тригидрата используют реакцию образования окрашенной пирилиевой соли (цианидиновая проба). Появляется красное окрашивание.

Подлинность никотиновой кислоты и никотинамида можно определить с помощью раствора анилина и цианобромида. Образуется полиметиновый краситель желтого цвета

Для идентификации пиридоксина гидрохлорида может быть ис- пользована реакция с 2,6-дихлорхинонхлоримидом. Образуется продукт синего цвета. Данная реакция лежит в основе проявления хроматограмм при идентификации пиридоксина гидрохлорида методом ТСХ

 Специфической для солей тиамина является реакция образования тиохрома. Последнее вещество образуется при окислении тиамина гексацианоферратом (III) калия в щелочной среде. Слой органического растворителя имеет интенсивную голубую флуоресценцию
Специфической для солей тиамина является реакция образования тиохрома. Последнее вещество образуется при окислении тиамина гексацианоферратом (III) калия в щелочной среде. Слой органического растворителя имеет интенсивную голубую флуоресценцию

Примесь к аскорбиновой кислоте

Примесь к фолиевой кислоте
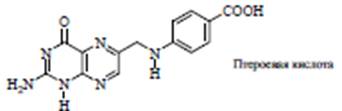
Примесь к рибофлавину, образующаяся на свету в щелочной среде

Количественное определение тиамина гидрохлорида проводят в среде безводной муравьиной кислоты и уксусного ан- гидрида. Тиамина гидрохлорид взаимодействует с титрантом (0,1 M HClO4) в молярном отношении 1:2

Для количественного определения аскорбиновой кислоты используют йодометрическое титрование.

Никотиновая кислота образует соль с ионами меди. Избыток меди (II) в растворе определяют йодометрически.

 Для определения тиамина гидрохлорида может быть использовано аргентометрическое и алкалиметрическое титрование:
Для определения тиамина гидрохлорида может быть использовано аргентометрическое и алкалиметрическое титрование:

При взаимодействии рибофлавина с серебра нитратом выделяется азотная кислота, которую определяют алкалиметрически.

ВИТАМИН А
Витамин А – группа природных соединений(ретиноидов), относящихся к терпеноидам, найденных в животных тканях, облад. сходной биолог активностью.
Основным и наиболее активным представителем ретиноидов является all-(E)-ретинол. К терпеноидам также относятся ретиналь, ретиноевая кислота и др. В растениях содержатся каротиноиды–провитамины А.
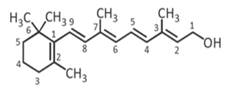 3,7 диметил-9-(2,6,6-триметилциклогекс-1-енил) нона-2,4,6,8-тетраен-1-ол.
3,7 диметил-9-(2,6,6-триметилциклогекс-1-енил) нона-2,4,6,8-тетраен-1-ол.

Ретинола ацетат
Термин «Витамин А» обычно относится к ретинолу и его эфирам природного происхождения, синтетический ретинол и его эфиры наз «Ретинол»
Функции витамина А:
· дифференциация клеток и развитие эмбриона;
· образование родопсина (сумеречное зрение);
· норм функционир иммунной с-мы;
· норм функционир эпителиальных тканей;
· гемопоэз;
· синтез гликопротеинов;
· синтез СТГ;
· участие в ОВР, антиоксидант и др.
Вит А облад тератогенным действием и в больших дозах токсичен.
Активность ретинола и его эфиров выраж в МЕ. 1МЕ=0,300 мкг all-(E)-ретинола (1мкг ретинола=333МЕ). Активность опредспектрофотометрически.
| Эфир
| Описание
| 1МЕвитемина А=
|
| Ацетат
| Бледно-желтые кристаллы (tпл=600С)
| 0,344мкг
|
| Пропионат
| Красновато-коричневая масл жидкость
| 0,359 мкг
|
| Пальмитат
| Светло-желтое жироподобное твердое в-во или желтая масл. Жидк(tпл=260С)
| 0,550 мкг
|
Все эфиры практически нерастворимы в воде, растворимы в этаноле, смешив с орг. р-лями. Ретинол и эфиры очень чувствительны к действию О2, окислителей, кислот, света и нагревания.
КАЛЬЦИФЕРОЛЫ
Кальциферолы (витамин D) – гр. Прир.соединенийоблад антирахитическим действием.
Наибольше значение имеют:
· Эргокальциферол(D2)
· Холекальциферол (D3)
Кальциферол можно рассматривать как 9,10-секопроизводные стеринов и как в-ва, в молекулах которых содерж остатки циклогексанола и гидрининдана.
 эргокальциферол
эргокальциферол
(9,10-секопроизводное эргостерина)

Холекальциферол (9,10-секопроизводное 7-дегидрохолестерина)
Общая формула

Особенности химического строения
· В кристаллическом состоянии кальциферолы находятся в виде формы с транс-расположением =связей относительно π-связи между 6 и 7 атомами С. В р-рахцис и транс формы находятся в равновесии друг с другом.
· В молекуле эргокальциферола содержатся 3, а в молекулах холекальциферола 2 = связи. =связь в 5 положении имеет Z-конфигурацию, остальные Е. У биологически неактивных транс-кальциферолов все =связи Z-конфигурации.
· В 3 положении молекул кальциферолов наход ОН-гр, располаг перед плоскостью цикла (β-конфигурация)
Биологическая активность
· В организме витамины Д подверг гидроксилированию с ораз акт метаболитов.
· В печени образ 25-гидроксипроизводные(кальцидиолы) кот явл основной транспортной формой витамина Д.
· В почках кальцидиолыпревращ в кальцитриолы 24,25 и1,25- дигодроксипроизводные вит Д.
· Наиболее активной формой вит Д явл 1,25-дигидроксипроизводные
· Степень превращения кальциферолов в акт метаболиты зависит от концентрации ионов Ca2+ в крови.

1 стрелка – 25 гидроксилаза 2- в-во- 25 OH-D3
2- 24 гидроксилаза 3 – 24,25 –(OH)2-D3
3- 1α-гидроксилаза 4 - 1,25 –(OH)2-D3
Синтез кальциферолов


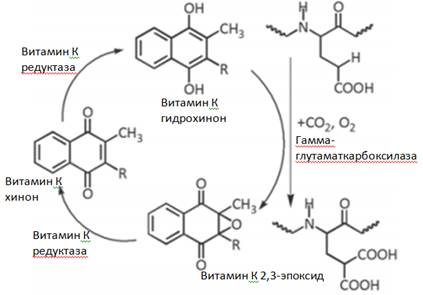
Витамины К – группа жирорастворимых витаминов, необходимых для синтеза белков, обеспечивающих необходимый уровень коагуляции.
Природные соединения:
· Филлохинон (люцерна, К1)
· Менахинон (гниющая рыбная мука, К2)
Синтетические производные:
· Менадион (К3)
· Растворимые пролекарства – например, менадиона натрия бисульфат.
Химическое строение (произв нафтохинона)
 менадион натрия бисульфат
менадион натрия бисульфат
Биологическая активность вит.К. Участвует в карбоксилировании остатков глутаминовой кислоты в ППЦ некоторых белков. В результате происходит превращение остатков Глу в остатки гамма-карбоксилглутаминовой кислоты (Гла-радикалы). Гла-радикалы благодаря двум свободным карбоксильным группам, участвуют в связывании кальция. К Гла белкам в крови относятся факторы свертывания крови 2 (протромбин), 7,9 и 10, а также протеин С, протеинS и протеинZ
Витамин Е – группа соединений, в которую входят производные токола («токоферолы») и токотриенолы. Все данные в-ва содержат в своей структуре остаток хромана и длинный углеводный радикал изопреноидной структуры. Токоферолы и токотриенолы можно рассматривать как дитепреноидные производные гидрохинона.
Источники: масло зародышей семян пшеницы, подсолнечное масло, оливковое масло, морковь.
Токоферолы – моно-, ди- и триметилпроизводные.
| В-во
| Р1
| Р2
| Р3
| Хим.название
|
| Альфа-токоферол
| CH3
| CH3
| CH3
| 5,7,8-триметилтокол
|
| Бэта-токоферол
| CH3
| H
| CH3
| 5,8-диметилтокол
|
| Гамма-токоферол
| H
| CH3
| CH3
| 7,8-диметилтокол
|
| Дельта-токоферол
| H
| H
| CH3
| 8-метилтокол
|
Токотриенолы – метильные производные токотриена (транс-конфигурация двойных связей).

Витамин Е (токоферол): природный и синтетический.
| изомеры
| Название
|
| 2S,4’R, 8’R
| 2-эпи-альфа токоферол
|
| Смесь RRR- и 2-эпи-
| 2-амбо-альфа-токоферол
|
| Смесь всех стереоизомеров
| All-rac-альфа-токоферол
|
Биологическая активность: жирорастворимый антиоксидант, способен образовывать свободные радикалы, липофильность (антирадикальное действие).

Простагландины – биологически активные липиды, являющиеся производными гипотетической простановой кислоты.

Химическое строение
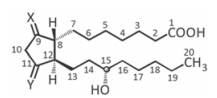
· Содержат 20 атомов С и состоят из циклопентанового кольца, с которым соединены гидроксильные или оксогруппы, и двух углеродных цепочек.
· Одна цепочка включает 7 атомов С и содержит СООН-группу, вторая состоит из 8С и в 15-ом положении содержит ОН-группу. В боковых цепочках могут присутствовать одна или несколько двойных связей.
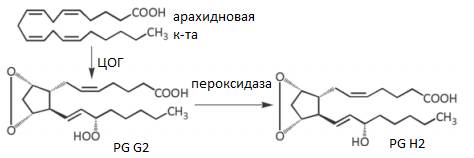
Существует 10 типов простагландинов. Простагландины Gи H имеют одинаковые заместители в циклогексановом цикле. Отличаются характером заместителей в 15 положении уPGH – это ОН-группа, уPGG – ООН-группа.

Каждый тип PG разделяется на серии в зависимости от числа двойных связей, содержащихся в БЦ. Число двойных связей обозначается цифрой, находящейся в нижнем индексе буквы, обозначающей тип. У PG F в нижн индексе может также присутствовать буква альфа или бэта, указ-я на ориентацию ОН-гр, нах-ся в 9п, относительно плоскости цикла.

PG альфа1 PG F бета2
Биосинтез
Простагландины образуются в результате циклооксигеназного пути метаболизма арахидоновой кислоты:

Биологическая активность
Д2-слабый ингибитор агрегации тромбоцитов, влияние на тучные клетки.
Е1- расширение сосудов, ингибирование липолиза, ингибирование агрегации тромбоцитов, расширение бронхов, сокращение гладкой мускулатуры ЖКТ.
Е2-повышение болевой чувствительности, расширение почечных сосудов, сокращение миометрия, защита слизистой желудка от действия кислоты, уменьшение секреции соляной к в желудке.
F2 -влияние на терморегуляцию, стимулирование лютеолиза у животных, сокращение миометрия.
I2-потенциальный ингибитор агрегации тромбоцитов, потенциальный вазодилятатор, уменьшает содержание цАМФ в тромбоцитах.
J2-стимулирование остеогенеза, ингибирование пролиферации клеток.
Основные направления применения в медицине:
-влияние на сосуды
-антиагрегантное действие
-влияние на миометрий
-антисекреторное и цитопротекторное действие
-снижение внутриглазного давления
Алпростадил PG E1- сосудорасш и антиагрег ЛС. Использ при облитерирующих заболеваниях сосудов и эректильной дисфуекции(интракавернозно)

 PG E1 производное.
PG E1 производное.
Мизопростол – смесь 4 стереоизомеров(приблиз в равных соотнош). Отличается от PG E1 сложноэфирной гр и СН3 в 15п. 1)стимулирует миометрий и расшир шейку матки-прерывание беременности на ранних сроках(Миромот), прим вместе с мифепристоном- антигестагенное лс. 2)антисекреторное и цитопротекторное д-е(Сайтотек, вместе с диклофенаком натрия-Артротек).

Динопрост- лс стимулир родовую деятельность. Оказывает выраженное стимулир д-е на сократительную функцию миометрия на любых сроках беременности и при любой степени раскрытия шейки матки. Применяется для прерывания берем по медицинским показаниям в 1 и 2 триместре; индукции изгнания плода в случае его внутриутробной гибели; индукции родов(в срок).
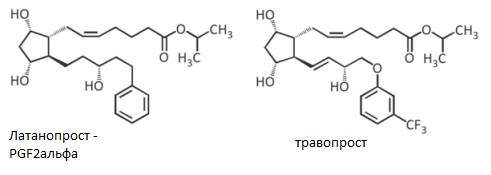
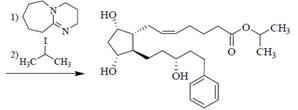
Латанопрост- изопропиловый эфир производного F2альфа, у которого 18,19 и 20 С замещены на фенильный радикал.
Травопрост - две двойных связи, О вместо С17 и –СF3-. Снижает ВГД за счет увеличения оттока жидкости глаза.
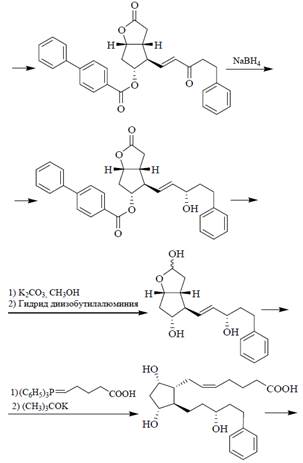
Синтез простогландинов
Ключевым промежуточным продуктом при получении данных веществ является 4-фенилбензоат лактона Кори.
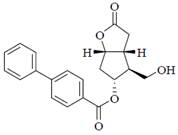
Полечение ЛАТАНОПРОСТА

ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ
Витамины – группа необходимых для жизнедеятельности организма органических низкомолекулярных веществ, синтез которых в организме ограничен или отсутствует.
Функции витаминов:
· кофакторы ферментов (В1,В2,В6, РР,В12,ФК),
· антиоксиданты (С,Е, каротиноиды),
· предшественники гормонов (Д)
Классификация витаминов:
· водорастворимые (В1,В2,РР,С,В6) – не депонируются в тканях,
· жирорастворимые (А,Д,Е,К) – депонируются в организме, вит. А и Д при передозировке токсичны.
Химическая классификация витаминов:
· Алифатические, терпеноиды – ретинола ацетат
· Алифатические, стероиды – холекальциферол, эргокальциферол
· Ароматические, произв.нафтохинона – менадион, менадиона натрия бисульфит
| Витамин
| ФС
| Хим структура
|
| A
| Ретинола ацетат и другие эфиры
| Алифатические (алициклическая), терпеноиды
|
| D
| Эргокальциферол (D2), Холекальциферол(D3)
| Алифатические (алициклическая), стероиды
|
| K
| Менадион (К3), менадиона натрия бисульфит (пролекарство)
| Ароматтическая, пр:нафтохинона
|
| C
| аскорбиновая кислота
| ГЦ, произв.фурана
|
| E
| альфа-токоферилацетат
| ГЦ, произв.хромана
|
| P
| рутозид тригидрат
| ГЦ, произв.флавона
|
| B12
| цианокобаламин, кобамид
| ГЦ, тетрапирролы
|
| В6
| пиридоксина гидрохлорид
| ГЦ, произв.пиридинметанола
|
| РР (В3)
| никотиновая кислота, никотинамид
| ГЦ, произв. Пиридин-3-карбоновой кислоты
|
| В1
| тиамина гидрохлорид
| ГЦ, произв. Пиримидинтиазола
|
| В9
| фолиевая кислота
| ГЦ, произв.птеридина
|
| В2
| Рибофлавин
| ГЦ, произв.бензоптеридина
|
АТХ классификация витаминов
· А11А мультивитамины, комбинации
· А11В мультивитамины, индивидуальные
· А11С витамины А и Д, включая комбинации этих витаминов
· А11Д витамин В1, индивидуальный и в комбинации с В6 и В12
· А11Е комплексы витаминов В, включая комбинации
· А11G Аскорбиновая кислота, включая комбинации
· А11Н другие индивидуальные витамины
· А11J другие витаминные продукты, комбинации
Аскорбиновая кислота – y-лактон 2-оксогулоновой кислоты (2,3-дегидро-L-гулоновой кислоты) либо ГЦ соединение – произв.фурана
| 5-(1,2-дигидроксиэтил)-3,4-дигидроксифуран-2(5Н)-ОН
| |
| Енольная форма гамма-лактона 2-оксо-L-гулоновая к-та
| |

В молекуле аскорбиновой кислоты присутствует 2 центра хиральности, поэтому она существует в виде 4 стереоизомеров. Витаминной активностью обладает только L-АК. ИАК в природе не встречается.

L-АК Д-АК L-ИАК Д-ИАК
Аскорбиновая кислота является двухосновной. При рН 7,4 она находится в растворе в виде моноаниона.

Аскорбиновая кислота может обратимо окисляться до дегидроаскорбиновой кислоты

При гидролизе дегидроаскорбиновой кислоты образуется 2,3-диоксо-L-гулоновая кислота, которая далее необратимо окисляется до L-треоновой и щавелевой кислот.

В водных р-рах АК неустойчива. В кристаллическом состоянии она устойчива к окислению.
Некоторые биологические функции АК:
· создание ОВ потенциала в клетке, влияющего на активность ферментов;
· реакции гидроксилирования (триптофана при синтезе серотонина);
· участие в ОВР (образование ТГФК)
Флавоноиды – группа природных полифенольных соединений, в молекулах которых содержится 2 бензольных кольца, связанных трехуглеродной связью.

Бифлавоноиды – группа флавоноидов, способных уменьшать проницаемость капилляров.
Одним из бифлавоноидов является рутозид, относящийся к производным флавона. Кетон, содержащий оксогруппу в 4 положении пиранового цикла, носит название у-пирон. Бициклическая система, образующаяся при конденсации молекул у-пирона и бензола, называется хромоном. 2-фенилхромон имеет название флавон.

рутиноза

Альфа-L-рамнопираноза
Бета-Д-глюкопираноза
Кверцетин
1-6-гликозидная связь
Рутозид обычно применяется совместно с АК в качестве капилляроукрепляющего ЛС при комплексном лечении избыточной проницаемости капилляров.

Троксерутин
Гидроксиэтильное производное рутозида (простой эфир рутозида и этиленгликоля). Избирательно накапливается в эндотелиальном слое венул, обладает антиоксидантным действием. Уменьшает повышенную проницаемость капилляров и оказывает венотоническое действие.
Кобаламины – группа природных соединений, в основе которых лежит корриновый комплекс кобальта (3). В состав корриновой системы входят три пирролиновых и один пирролидиновый циклы, связанные друг с другом тремя метиновыми мостиками. Молекула коррина не является ароматической.
 коррин
коррин
Кобальт: КЧ =6, СО=+3. Четыре ковалентные связи образуются при взаимодействии Со3+ с атомами азота циклической системы, одна связь – с атомом азота диметилбензимидазольного остатка. С шестой связью могут быть связаны различные группы. Цианокобаламин – артефакт, образующийся при выделении витамина.
 R-разные группы, корриновая система(плоская), бензимидазольное ядро.
R-разные группы, корриновая система(плоская), бензимидазольное ядро.
Кобамид – рибонуклеотид 5,6-диметилбензимидазола.
· Восемь метильных групп(1а,2а,5,7а,12,12а,15, 17в);
· семь амидных групп, среди которых четыре пропионамидные (3,8,13,17 – все а) и три ацетамидные (2,7,18 – все в).
· пропионамидная группа в 17 положении связана через остаток 1-аминопропанола-2 с нуклеотидом.
Лиганды:
· CN- (цианокобаламин, В12),
· ОН-(гидроксикобаламин, В12а),
· Н2О(аквакобаламин, В12в),
· NO2-(нитритокобаламин, В12с),
· СН3-(метилкобаламин, В12),

Ферменты, в состав которых входит В12:
· метилмалонил-КоА-мутаза (метилкобаламин),
· 5-метилтетрагидрофолат гомоцистеин метилтрансфераза (кобамамид)

Пернициозная анемия (В12-дефицитная) – заболевание, вызванное нарушением кроветворения из-за дефицита витамина В12 в организме.
· Недостаточное поступление В12 с пищей,
· недостаточная выработка ВФК в париетальных клетках желудка,
· патологические процессы в подвздошной кишке,
· конкуренция за В12 со стороны ленточных червей и бактерий.
Производные пиридинметанола
Структура 5-гидроксиметилпиридина (пиридинметанола) лежит в основе В6, к которому относятся три соединения, имеющие разные заместители в четвертом положении пиридинового цикла.

Пиридоксин Пиридоксаль Пиридоксамин
Активные формы В6

Пиридоксальфосфат Пиридоксаминфосфат
· Ферменты, участвующие в переаминировании АК
· Ферменты, участвующие в декарбоксилировании АК
· Фосфорилаза гликогена
Применяют при заболеваниях нервной системы (паркинсонизм, радикулиты, невриты), при атеросклерозе, СД, кожных заболеваниях, а также при токсикозе беременных, гиповитаминозе В6.
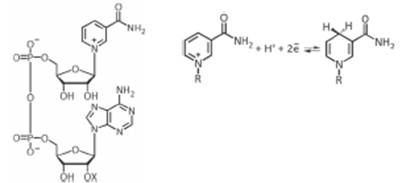
Никотиновая кислота и никотинамид
Пиридин-3-карбоновая кислота и ее амид (никотинамид) известны под собирательным названием «ниацин» (Вит РР, В3)

· НАД – ферменты, участвующие в метаболических процессах (дых.цепь, гликолиз),
· НАДФ-ферменты, участвующие в анаболических процессах (синтез ВЖК, холестерина)
Применение:
· малые дозы – лечение соответствующего авитаминоза (пеллагра) и при болезни Хартнупа (нарушение всасывание триптофана),
· большие дозы – антиагрегантное, сосудорасширяющее, гиполипидимическое действие, лечение атеросклероза, облитирующих заболеваний периферических сосудов.












 коррин
коррин R-разные группы, корриновая система(плоская), бензимидазольное ядро.
R-разные группы, корриновая система(плоская), бензимидазольное ядро.



 бензоптеридин, аллоксазин, изоаллоксазин
бензоптеридин, аллоксазин, изоаллоксазин

 Рибофлавин натрия фосфат
Рибофлавин натрия фосфат








 ственно, 3-этоксипропионитрила и 3-бром-4-оксопентилового эфира уксусной кислоты могут быть такими:
ственно, 3-этоксипропионитрила и 3-бром-4-оксопентилового эфира уксусной кислоты могут быть такими:







 Специфической для солей тиамина является реакция образования тиохрома. Последнее вещество образуется при окислении тиамина гексацианоферратом (III) калия в щелочной среде. Слой органического растворителя имеет интенсивную голубую флуоресценцию
Специфической для солей тиамина является реакция образования тиохрома. Последнее вещество образуется при окислении тиамина гексацианоферратом (III) калия в щелочной среде. Слой органического растворителя имеет интенсивную голубую флуоресценцию






 Для определения тиамина гидрохлорида может быть использовано аргентометрическое и алкалиметрическое титрование:
Для определения тиамина гидрохлорида может быть использовано аргентометрическое и алкалиметрическое титрование:

 3,7 диметил-9-(2,6,6-триметилциклогекс-1-енил) нона-2,4,6,8-тетраен-1-ол.
3,7 диметил-9-(2,6,6-триметилциклогекс-1-енил) нона-2,4,6,8-тетраен-1-ол.
 эргокальциферол
эргокальциферол




 менадион натрия бисульфат
менадион натрия бисульфат









 PG E1 производное.
PG E1 производное.








