Диффузия – это самопроизвольный процесс выравнивания концентрации растворённого вещества в объёме.
Она обусловлена 2 факторами: 1) наличием рыхлой структуры и пустот в растворителе (например, в 1 л воды её молекулами занято только примерно 370 мл), 2) тепловым движением частиц раствора.
Диффузия прекращается, если концентрация во всех частях раствора становится одинаковой. Скорость диффузии зависит от:
1) абсолютной температуры;
2) градиента концентрации;
3) вязкости растворителя;
4) размера диффундирующих частиц.
Скорость диффузии возрастает при повышении температуры и градиента концентрации и уменьшается при увеличении вязкости растворителя, размера и массы диффундирующих частиц. Поэтому растворы высокомолекулярных соединений (ВМС - белков, полисахаридов и др.) имеют очень низкий коэффициент диффузии.
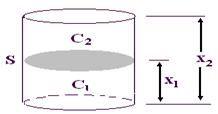
Диффузия может быть выражена количественно. Её описывает закон Фика: количество растворенного вещества m, проходящее за время t через площадь поперечного сечения сосуда S, которая разделяет растворы с разными концентрациями C1 и C2 определяется уравнением:
m / t = - DS ×(C2 –C1) / x2 – x1,
где: m/t – скорость диффузии, D – коэффициент диффузии, равный количеству вещества, диффундирующего через 1 см
2 поверхности раздела за время t при градиенте концентраций, равном 1; S – площадь поперечного сечения сосуда; (C
2–C
1) – градиент концентраций; (x
2–x
1) – расстояние, пройденное диффундирующей частицей от дна сосуда из раствора с концентрацией C
1 в раствор с концентрацией C
2 (рис. 6).
Рис. 6.Закон Фика
Для биологических мембран это уравнение имеет следующий вид:
m / t = - рS (C2 –C1),
где: р – коэффициент проницаемости мембраны, C1 и C2 – концентрации по обе стороны мембраны.
Диффузия играет важную роль в биологических системах. Благодаря диффузии осуществляется транспорт метаболитов внутри клеток и через мембрану. Так, например, в организме человека ежеминутно путём диффузии через стенки капилляров перемещается 1500 л жидкости.
Осмос – это односторонняя диффузия растворителя через полупроницаемую мембрану в сторону раствора с большей концентрацией растворённого вещества.
Осмос вызывается осмотическим давлением – силой, отнесённой к единице поверхности мембраны. Осмотическое давление имеется у любого раствора. Оно обусловлено стремлением частиц растворителя путём диффузии распределиться в максимально большем объёме.
Осмотическое давление растворов неэлектролитов пропорционально молярной концентрации (при постоянной температуре) и абсолютной температуре (при постоянной концентрации) раствора:
Росм = RCT,
где: R – универсальная газовая постоянная равная 8,31 Дж/(моль•К), C – молярная концентрация раствора, T – его абсолютная температура.
З акон Вант-Гоффа: учитывая, что С = n/V, получаем: РосмV = nRT. Для растворов электролитов вводится поправочный коэффициент i, показывающий во сколько раз истинная концентрация растворённых частиц, осмотическое давление, понижение температуры замерзания, повышение температуры кипения, понижение давления насыщенного пара растворителя больше, чем в эквивалентном растворе неэлектролита:
i = Cэл/Cнеэл= Pосмэл/Pосмнеэл = Δt°з эл/Δt°знеэл = Δt°кэл/Δt°кнеэл
Математичекое выражение закона Вант-Гоффа для водных растворов электролитов имеет вид:
РосмV = inRT
Осмолярность и осмоляльность представляют собой общую концентрацию растворенных частиц в 1 л раствора (осмолярность) или в 1 кг воды (осмоляльность). Осмоляльность крови в значительной степени зависит от концентрации ионов натрия и хлора, в меньшей степени глюкозы и мочевины. В норме осмоляльность сыворотки крови 275-296 мосмоль/кг Н20, осмоляльность мочи обусловлена мочевиной, ионами натрия, калия, аммония. Осмоляльность мочи колеблется значительно: от 50 до 1400 мосмоль/кг Н20. При суточном диурезе около 1,5 л осмоляльность мочи здорового человека составляет 600-800 мосмоль/кг Н20.
При патологических состояниях осмоляльность крови может как снижаться, так и повышаться. Гипоосмоляльность характеризует снижение концентрации натрия в крови при передозировке диуретиков, избыточной продукции антидиуретического гормона, при хронической сердечной недостаточности, циррозе печени с асцитом, глюкокортикоидной недостаточности. Гиперосмоляльность связана с гипернатриемией и наблюдается при сахарном диабете, недостаточности калия, гиперкальциемии, при декомпенсированном сахарном диабете (гипергликемической коме), при гиперальдостеронизме, избыточном введении кортикостероидов, при хронической почечной недостаточности наблюдается увеличение концентрации мочевины (каждые 5 ммоль/л мочевины увеличивают осмоляльность крови на 5 мосмоль/кг Н20), параллельно происходит снижение концентрации натрия в крови, поэтому осмоляльность крови значительно не меняется.
Ранним признаком снижения функции почек является нарушение функции разведения и концентрирования мочи. При максимальном водном диурезе ренальная дисфункция проявляется в неспособности почек снижать осмолярность мочи ниже 90 мосмоль/кг Н20 при норме снижения до 20-30 мосмоль/кг Н20. При 18-24-часовом ограничении приема жидкости нарушается способность максимально концентрировать мочу - осмоляльность мочи менее 800 мосмоль/кг Н20.
Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. При помещении этих клеток в растворы с различной концентрацией наблюдается осмос.
Все биологические жидкости (лимфа, сыворотка и плазма крови) – растворы, поэтому они обладают коллигативными свойствами. Осмотическое давление в биологических жидкостях зависит как от растворённых в них минеральных веществ, так и от ВМС (белков, нуклеиновых кислот, полисахаридов). Осмотическое давление крови человека постоянно и при 37°С составляет 7,4-7,8 атм. (0,74-0,78 МПа). Учитывая это, в медицинской практике во избежание осмотических конфликтов широко используют различные изотонические растворы.
Изотонический раствор –раствор какого-либо вещества в воде, осмотическое давление которого равно осмотическому давлению крови. Например, 0,85% раствор NaCl, 5% раствор глюкозы. В изотонических растворах эритроциты не изменяют свою форму, т.к. Росм изотонического раствора равно Росм эритроцита, поэтому потоки Н2О в эритроцит и из него уравновешены. Изотонические растворы используют в качестве кровезаменителей при небольших потерях крови или для внутривенного введения растворённых в них лекарственных веществ.
Существуют и неизотонические растворы: гипотонические и гипертонические. Раствор, осмотическое давление которого ниже изотонического, называется гипотоническим. Раствор, осмотическое давление которого выше изотонического, называется гипертоническим.
Введение в организм значительных объёмов неизотонических растворов может привести к осмотическим конфликтам. Росм гипертонического раствора больше Росм эритроцитов. В результате ток воды направлен из эритроцитов в окружающую среду (в сторону раствора с большей концентрацией). Наступает обезвоживание эритроцитов и, как следствие, их сморщивание (плазмолиз).
Росм гипотонического раствора меньше Росм эритроцита. В результате ток воды направлен в эритроцит из окружающей среды (в сторону раствора с большей концентрацией). Наступает набухание эритроцита и, как следствие, его разрыв (гемолиз). Тем не менее, неизотонические растворы применяют в медицине.
Например:
1) при повышении внутриглазного давления (глаукоме) небольшое количество гипертонического раствора вводят внутривенно, чтобы «оттянуть» избыточное количество воды из передней камеры глаза и, тем самым, снизить внутриглазное давление;
2) повязки с гипертоническим раствором NaCl (10% водный раствор) используют для лечения гнойных ран – ток раневой жидкости направляется по марле наружу, что способствует постоянному очищению раны от гноя, микроорганизмов и продуктов распада;
3) гипертонические растворы MgSO4 и Na2SO4 используют в качестве слабительных средств, эти соли плохо всасываются в ЖКТ, что вызывает переход Н2О из слизистой в просвет кишечника; в результате, увеличивается объём кишечного содержимого, раздражаются рецепторы слизистой, усиливается перистальтика, и ускоряется эвакуация кишечного содержимого;
4) введение гипотонических растворов входят в программу лечения гиперосмолярной комы – тяжёлого осложнения сахарного диабета.
Часть осмотического давления, которое обусловлено только растворёнными белками, называется онкотическим давлением. Оно составляет примерно 0,5% от общего осмотического давления и равно 0,04 атм или 30-40 см водного столба.
Биологическое значение онкотического давления состоит в том, что оно поддерживает равновесие между кровью и внеклеточной жидкостью для постоянного обмена питательными веществами и конечными продуктами обмена.
Согласно гипотезе Старлинга, в крови, в артериальной и венозной частях капилляров, соотношение между гидростатическим давлением, обусловленным работой сердца (45 и 15 см водного столба соответственно), и онкотическим давлением (30 см водного столба) различно. Разница давлений одинакова и составляет 15 см водн. ст., но в артериальной области преобладает Ргидр, а в венозной области – Ронк.