Под внутренней энергией будем понимать энергию хаотического движе-ния молекул и атомов, включающую энергию поступательного, вращательного
и колебательного движений как молекулярного, так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами.
Кинетическая энергия молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т.е. является функцией V. Поэтому внутренняя энергия U есть функция состояния тела. Величина u = U / М, называемая удельной внутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества. Она может быть представлена в виде функции двух любых независимых параметров, определяющих ее состояние:



U = 1 (p,V); u = 2 (p,T); u = 3 (v,T).
Ее изменение в термодинамическом процессе не зависит от характера процесса и определяется только начальным и конечным состояниями тела.

u 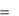 du u 2 u 1 где u1 – значение внутренней энергии в начальном состо-
du u 2 u 1 где u1 – значение внутренней энергии в начальном состо-


янии, а u2 – в конечном.
Тепловое движение – это хаотическое движение микрочастиц(молекул,атомов и др.), из которых состоят все тела.
Передача энергии (формы обмена энергией) происходит двумя способами– работой L и теплотой Q.
Передача энергии в результате макроскопического упорядоченного дви-жения микрочастиц называется работой.
Передача энергии в результате обмена хаотическим, ненаправленным движением микрочастиц называется теплообменом, а количество передаваемой при этом энергии - количеством теплоты или теплотой.
Рабочее тело –это газообразное,жидкое или плазменное вещество,с по-мощью которого осуществляется преобразование какой-либо энергии при по-лучении механической работы, теплоты, холода.
Работа расширения
Работа в термодинамике, так же как и в механике, определяется произве-дением действующей на рабочее тело силы на путь ее действия.
Рассмотрим газ массой М и объемом V, заключенный в эластичную обо-лочку с поверхностью F (рисунок 2.1).

Рисунок 2.1. К определению работы расширения
Если газу сообщить некоторое количество теплоты, то он будет расши-ряться, совершая при этом работу против внешнего давления Р. Газ действует на каждый элемент оболочки dF с силой, равной pdF, и перемещая ее по норма-ли к поверхности на расстояние dn. Общую работу получим, интегрируя данное выражение по всей поверхности F оболочки:

Из рисунка 2.1 видно, что изменение объема, dV, выражается в виде ин-

теграла по поверхности: dV  dFdn,следовательно,
dFdn,следовательно,
| F
|
|
|
| dL
| pdV.
| (2.3)
|
| При конечном изменении объема работа против сил внешнего давления,
|
| называемая работой расширения, равна
|
|
|
|
| V 2
|
|
| L
| pdV.
| (2.4)
|


V 1
dL и dV всегда имеют одинаковые знаки:
если dV > 0, то и dL > 0, т.е. при расширении работа тела положительна, при этом тело само совершает работу;
если dV < 0, то и dL < 0, т.е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие была затрачена работа извне.
В термодинамике для исследования равновесных процессов широко используют Р, V-диаграмму, в которой осью абсцисс служит удельный объем, а осью ординат - давление. Поскольку состояние термодинамической системы определяется двумя параметрами, то на Р, V-диаграмме оно обозначается точкой (рисунок 2.2).

Рисунок 2.2. Графическое изображение работы в р, -координатах
На рисунке 2.2 точка 1 соответствует начальному состоянию системы, точка 2 - конечному, а линия 12 - процессу расширения рабочего тела от v1 до v2. Работа процесса 12 изображается площадью, ограниченной кривой процесса, осью абсцисс и крайними ординатами. Таким образом, работа изменения объема эквивалентна площади под кривой процесса в диаграмме P, V.
Теплоемкость газов
Отношение количества теплоты dQ, полученной телом при бесконечно малом изменении его состояния, к связанной с этим изменением температуре тела dT называется теплоемкостью тела [1]:
С=dQ/dT. (2.5)
Коэффициент пропорциональности между количеством подведенной (от-веденной) к телу теплоты и соответствующим изменением его температуры Т называется теплоемкостью Q=CT[3].


Обычно теплоемкость относят к единице количества вещества и в зави-симости от выбранной единицы различают:
удельную массовую теплоемкость с,отнесенную к1кг газа,Дж(кг К);
теплоемкость при постоянном давлении
| Ср=dqp / dT;
| (2.6)
|
| т еплоемкость при постоянном объеме
|
|
| С =dq / dT.
| (2.7)
|


В курсе «Общей энергетики» мы коснемся науки термодинамики лишь в той части, чтобы сравнивать эффективность различных методов преобразования энергии. Простейшим критерием такого сравнения является коэффициент полезного действия (КПД) любого теплового двигателя, который определяется отношением полезно полученной работы к теплу, которое на получение этой работы затрачено.

где L-полученная работа, Дж, Q1-теплота, затраченная на получение работы, Дж. Отнеся работу к 1 кг массы рабочего тела, получим удельную работу

где М – масса рабочего тела, кг.
Величина l представляет собой удельную работу, совершаемую системой, содержащей 1 кг рабочего тела.
Аналогично определяется удельная теплота q1, Дж/кг,

и представляет собой теплоту, затраченную на совершение работы системой, содержащей 1 кг рабочего тела.
Коэффициент полезного действия можно определить через удельные ве-личины теплоты и работы

Коэффициент полезного действия ТЭС, работающих на органическом топливе с паровыми турбинами, составляет около 40%, а КПД АЭС - около 30%, это объ-ясняется не столько недостатками имеющихся технологий, но и тем, что суще-ствуют объективные ограничения, связанные с законами термодинамики.
Первый закон термодинамики






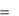 du u 2 u 1 где u1 – значение внутренней энергии в начальном состо-
du u 2 u 1 где u1 – значение внутренней энергии в начальном состо-




 dFdn,следовательно,
dFdn,следовательно,