

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
Топ:
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Интересное:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Восстановление оксидов металлов оксидом углерода принято описывать уравнением реакции (6.6), согласно которому для восстановления 1 моля оксида необходим 1 моль СО. Однако такая запись уравнения реакции не совсем корректна, так как после полного восстановления оксида газовая фаза содержит 100% СО2 и является окислительной по отношению к любому металлу.
Окисления восстановленного металла можно избежать, если образовавшаяся в результате реакции газовая фаза по отношению к металлу будет восстановительной. Для этого СО потребуется в большем количестве, а процесс восстановления будет описываться уравнением реакции
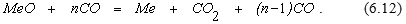
Расход восстановителя будет минимальным, если газовая фаза из 1 моля СО2 и (n-1) моля СО будет равновесной для реакции (6.6), то есть

Из уравнения (6.13) получим

Для легковосстановимых оксидов константы равновесия реакции (6.6) имеют большие значения, поэтому минимальный расход восстановителя близок к стехиометрическому.
Для оксидов второй группы константы равновесия реакции (6.6) близки к единице. При этом минимальный расход газообразного восстановителя существенно отличается от стехиометрического. Например, константа равновесия реакции восстановления FeO при 1000К равна 0,624. Согласно уравнению (6.14) для восстановления 1 моля оксида потребуется 2,6 моля СО.
Для трудно восстановимых оксидов константы равновесия реакции (6.6) очень малы. Поэтому минимальный расход восстановителя является очень высоким.
Например, для полного восстановления 1 моля MnO при 1000К потребуется 1,4•106 молей СО. Такой большой расход восстановителя обычно обеспечить не удается, поэтому на практике процесс восстановления с использованием газообразных восстановителей может быть реализован только для оксидов первой и второй групп.
|
|
Полученные выше выводы справедливы также при восстановлении оксидов металлов водородом и другими газами.
ВОССТАНОВЛЕНИЕ ОКСИДОВ МЕТАЛЛОВ УГЛЕРОДОМ.
Общая характеристика реакций восстановления оксидов углеродом. В научно-технической литературе восстановление оксидов углеродом принято называть прямым восстановлением, а восстановление оксидом углерода – косвенным или не прямым восстановлением.
В связи с несовершенством контакта между кусковыми материалами возможность непосредственного взаимодействия между углеродом и твердыми оксидами ограничена. Поэтому реакции прямого восстановления протекают преимущественно с участием газовой фазы и представляют собой результат последовательного протекания реакций косвенного восстановления
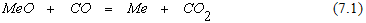
и взаимодействия углекислого газа с углеродом

Результат последовательного протекания реакций (7.1) и (7.2) можно описать уравнением
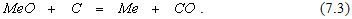
Согласно закону Гесса
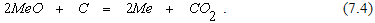
Изменение энтальпии реакции (7.1) может быть как отрицательной, так и положительной величиной. В первом случае оно обычно не велико и не превышает 172130 Дж/моль. Поэтому реакции прямого восстановления обычно являются эндотермическими.
При низких температурах восстановление оксидов углеродом может также протекать по реакции
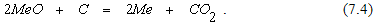
Однако при температурах более 950 – 1000оС углекислый газ взаимодействует с углеродом по реакции (7.2) и практически полностью превращается в СО.
Температура начала восстановления оксида. Система, в которой протекают реакции (7.1) и (7.2) состоит из пяти веществ, связанных между собой двумя уравнениями реакций. Следовательно, количество независимых компонентов системы k = 3. При отсутствии растворов количество находящихся в равновесии фаз f = 4, а число степеней свободы системы
C = k + n – f = 3 + 2 – 4 = 1.
Это означает, что однозначно охарактеризовать систему можно, указав температуру или давление.
|
|
При постоянном давлении количество степеней свободы системы становится равным нулю. Это означает, что система из чистых металла, оксида, углерода, СО и СО2 может находиться в состоянии равновесия только при одной температуре, которая определяется составом газовой фазы.
Сказанное выше показано на рисунке 7.1. Из рисунка видно, что при постоянном давлении реакции (7.1) и (7.2) могут одновременно находиться в равновесном состоянии только при одной температуре Тр.
Рассмотрим процессы, которые протекают в системе при температурах отличных от Тр.
Из рисунка 7.1 видно, что при Т >Тр в системе нет газовой фазы, которая удовлетворяла бы условиям равновесия реакций (7.1) и (7.2) одновременно.
Допустим, что при температуре Т1 реакция (7.1) находится в состоянии равновесия. При этом состав равновесной газовой фазы для реакции (7.1) отвечает точке б. Но газовая смесь такого состава не является равновесной по отношению к углероду, так как содержание СО2 в газовой фазе выше равновесного для реакции (7.2), которое соответствует точке в на рисунке.
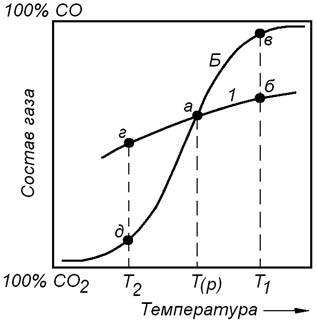
Рисунок 7.1 – Зависимость состава равновесной газовой фазы от температуры для экзотермической реакции косвенного восстановления и реакции С + СО2 = 2СО при постоянном давлении
В этих условиях реакция (7.2) протекает в направлении образования дополнительного количества оксида углерода и (%СО) в общей для двух реакций газовой фазе увеличивается. При этом газовая фаза перестанет отвечать условиям равновесия реакции косвенного восстановления, которая будет протекать в направлении восстановления оксида и образования дополнительного количества СО2. Результатом одновременного протекания реакций (7.1) и (7.2) будет процесс, который описывается уравнением реакции прямого восстановления (7.3).
Сказанное выше можно представить следующей схемой
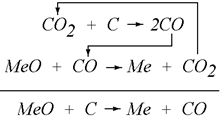
При наличии в исходном состоянии избытка углерода оксид металла будет полностью восстановлен и часть углерода останется не использованной. При этом равновесие в системе будет достигнуто, когда состав газовой фазы будет соответствовать точке в на рисунке 7.1.
При умеренных температурах в составе равновесного газа может находиться существенное количество СО2. Это означает, что восстановление оксида протекает как по реакции (7.3), так и по реакции (7.4).
При недостатке углерода он будет полностью израсходован и часть оксида останется не восстановленной. При этом равновесие в системе будет достигнуто, когда состав газовой будет соответствовать точке б.
|
|
При Т <Тр в системе также нет газовой фазы, которая одновременно удовлетворяла бы условиям равновесия реакций (7.1) и (7.2).
Допустим, что при температуре Т2 реакция (7.1) находится в состоянии равновесия. При этом состав равновесной газовой фазы для реакции (7.1) отвечает точке г. Но газовая смесь такого состава не является равновесной по отношению к углероду, так как содержание СО в газовой фазе выше равновесного для реакции (7.2), которое соответствует точке д на рисунке 7.1.
В этих условиях реакция (7.2) протекает в направлении разложения оксида углерода на углекислый газ и углерод. При этом (%СО2) в общей для двух реакций газовой фазе увеличивается, и она становится окислительной по отношению к металлу.
Протекающие при этом процессы можно представить следующей схемой
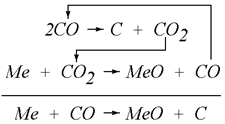
Таким образом, в присутствии углерода при Т <Тр оксид углерода по отношению к металлу может выступать в роли окислителя. Но окисление протекает не в результате непосредственного взаимодействия металла с СО, а при взаимодействии с СО2, который образуется в результате распада СО при наличии в системе углерода.
Если в исходном состоянии над металлом будет избыток газа, произойдет полное окисление металла. При этом состав равновесной газовой фазы будет соответствовать точке д.
Из рассмотренных примеров следует, что при постоянном давлении в системе возможны следующие процессы:
1. Равновесие при одной единственной температуре Тр характерной для каждого оксида.
2. Восстановление оксидов при температурах выше Тр, в связи с чем эту температуру называют также температурой начала восстановления.
3. Распад оксида углерода и окисление металла при температурах ниже Тр.
|
|
|

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!