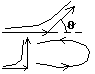 Существенную роль в создании классической модели атома (ядерной или планетарной) сыграли опыты Резенфорда по рассеянию α-частиц. α-частица представляет собой ядро атома гелия (He), образуется при распаде тяжелых элементов, вылетает со скоростью v≈10(с.-7)м/с. Резерфорд исследовал рассеяние α-частиц на металлических фольгах. d=10(c.-4)см – их толщина.
Существенную роль в создании классической модели атома (ядерной или планетарной) сыграли опыты Резенфорда по рассеянию α-частиц. α-частица представляет собой ядро атома гелия (He), образуется при распаде тяжелых элементов, вылетает со скоростью v≈10(с.-7)м/с. Резерфорд исследовал рассеяние α-частиц на металлических фольгах. d=10(c.-4)см – их толщина.
Подавляющее число α-частиц отклоняется на угол θ=π/2.
Очень незначительное число α-частиц изменили направление.
α-частица обладает массой и зарядом, т.е. на нее могут
действовать гравитационные и эл. силы. Т.к. гравитационные
силы незначительные, то отклонение α-частицы обусловлено действием на нее эл. поля со стороны зарядов внутри атомов. Можно расчитывать на какое расстояние должна приблизиться α-частица к заряду, чтоб под влиянием кулоновского поля этого заряда α-частица отбросилась назад.
 mv(c.2)/2 – 2Lφ=2L* (α/r), r ≈10(c.-13) см. => заряд, сосредоточенный в атоме, имеет положительный знак и сосредоточен в очень малом объеме. Из всех опытов Резенфорд пришел к следующим представлениям о строении атомоа. Внутри атома имеется положительно заряженное ядро, заряд которого +ze, причем в ядре сосредоточен весь положительный заряд атома. С ядром связана и большая часть массы атома. Заряд ядра совпадает с порядковым номером элемента в таблице Менделеева. Т.к. атом нейтрален, то в атоме кроме положительно заряженного ядра есть электроны, причем суммарный заряд электронов равен положительному заряду ядра. Положительно заряженное ядро и электроны, входящие в состав атома, определяют внутриатомное эл. поле, которое в свою очередь характеризует межатомные взаимодействия. Т.к. атом является устойчивой системой, то конфигурация электронов в атоме является устойчивой. Однако никакое устойчивое распределение зарядов не может быть статическим. На основании этого Резенфорд пришол к выводу, что электроны должны вращаться вокруг ядра, подобно вращению планет вокруг Солнца. В этом суть ядерной или планетарной модели Резенфорда.
mv(c.2)/2 – 2Lφ=2L* (α/r), r ≈10(c.-13) см. => заряд, сосредоточенный в атоме, имеет положительный знак и сосредоточен в очень малом объеме. Из всех опытов Резенфорд пришел к следующим представлениям о строении атомоа. Внутри атома имеется положительно заряженное ядро, заряд которого +ze, причем в ядре сосредоточен весь положительный заряд атома. С ядром связана и большая часть массы атома. Заряд ядра совпадает с порядковым номером элемента в таблице Менделеева. Т.к. атом нейтрален, то в атоме кроме положительно заряженного ядра есть электроны, причем суммарный заряд электронов равен положительному заряду ядра. Положительно заряженное ядро и электроны, входящие в состав атома, определяют внутриатомное эл. поле, которое в свою очередь характеризует межатомные взаимодействия. Т.к. атом является устойчивой системой, то конфигурация электронов в атоме является устойчивой. Однако никакое устойчивое распределение зарядов не может быть статическим. На основании этого Резенфорд пришол к выводу, что электроны должны вращаться вокруг ядра, подобно вращению планет вокруг Солнца. В этом суть ядерной или планетарной модели Резенфорда.
Модель Резенфорда явилась существенным шагом вперед,
т.к. представляла атом как динамическую систему
электрических зарядов. Для электронов, вращающихся
вокруг ядра, можно записать уравнение движения на
основе 2-го закона Ньютона: mv(c.2)/2=z*e*e/r (c.2) (1)
v – скорость электрона на орбите, r – радиус орбиты.
Однако модель Резенфорда явилась не универсальной. Недостатки: 1) уравнение (1) содержит 2 взаимосвязанных неизвестных v и r. Поэтому имеет. для них бесчисленное множество решений. Значит, что при изменении расстояния, а значит v и энергия электрона в атоме будут изменяться непрерывно. => атом Резенфорда будет непрерывно излучать. Опыт показывает, что в н.у. атом не излучает. 2) Т.к. атом Резенфорда излучает непрерывно, то спектр излучения атома должен быть сплошным. Опыт показывает, что спектры носят линейчатый харктер. 3) Согласно законам электродинамики электрон, вращаясь вокруг ядра, обладая нормальным ускорением, должен непрерывно излучать электро-магнитные волны => его энергия и расстояние м/у электроном и ядром должны непрерывно убывать. Т.к. из эксперимента известно, что атом излучает в течении τ=10(с.-8)с, то атом Резенфорда может существовать в течении этого времени, а после электрон упадет на ядро и атом прекратит свое существование. Эти недостатки имели принципиальное значени. Они показали, что движение электронов в атомах подчиняется иным законам, не нашедшим отражения в классической физике.
Постулаты Бора.
Для того, чтобы объяснить линейчатые спектры атомов датский физик Нильс Бор в 1913 году вводит два постулата.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся во времени) состояния, в которых он не излучает энергию. Энергии этих состояний образуют дискретный ряд: 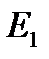 ,
, 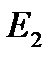 , …,
, …,  . Стационарным состояниям атома соответствуют орбиты, по которым движутся электроны. Хотя электроны движутся по стационарным орбитам с ускорением, они не излучают и не поглощают энергию.
. Стационарным состояниям атома соответствуют орбиты, по которым движутся электроны. Хотя электроны движутся по стационарным орбитам с ускорением, они не излучают и не поглощают энергию.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные значения момента импульса, удовлетворяющие условию:
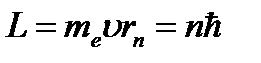 , n= 1, 2, 3,…, где
, n= 1, 2, 3,…, где  - масса электрона,
- масса электрона, 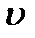 - его скорость по n -ой орбите радиуса
- его скорость по n -ой орбите радиуса 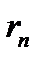 ,
, 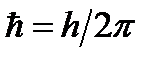 .
.
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) квант с энергией:
 .
.
При 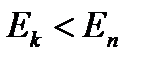 происходит излучение фотона (переход из состояния с большей энергией в состояние с меньшей энергией), при
происходит излучение фотона (переход из состояния с большей энергией в состояние с меньшей энергией), при  - поглощение фотона (переход атома в состояние с большей энергией).
- поглощение фотона (переход атома в состояние с большей энергией).
Набор возможных дискретных частот  определяет линейчатый спектр атома.
определяет линейчатый спектр атома.



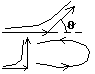 Существенную роль в создании классической модели атома (ядерной или планетарной) сыграли опыты Резенфорда по рассеянию α-частиц. α-частица представляет собой ядро атома гелия (He), образуется при распаде тяжелых элементов, вылетает со скоростью v≈10(с.-7)м/с. Резерфорд исследовал рассеяние α-частиц на металлических фольгах. d=10(c.-4)см – их толщина.
Существенную роль в создании классической модели атома (ядерной или планетарной) сыграли опыты Резенфорда по рассеянию α-частиц. α-частица представляет собой ядро атома гелия (He), образуется при распаде тяжелых элементов, вылетает со скоростью v≈10(с.-7)м/с. Резерфорд исследовал рассеяние α-частиц на металлических фольгах. d=10(c.-4)см – их толщина. mv(c.2)/2 – 2Lφ=2L* (α/r), r ≈10(c.-13) см. => заряд, сосредоточенный в атоме, имеет положительный знак и сосредоточен в очень малом объеме. Из всех опытов Резенфорд пришел к следующим представлениям о строении атомоа. Внутри атома имеется положительно заряженное ядро, заряд которого +ze, причем в ядре сосредоточен весь положительный заряд атома. С ядром связана и большая часть массы атома. Заряд ядра совпадает с порядковым номером элемента в таблице Менделеева. Т.к. атом нейтрален, то в атоме кроме положительно заряженного ядра есть электроны, причем суммарный заряд электронов равен положительному заряду ядра. Положительно заряженное ядро и электроны, входящие в состав атома, определяют внутриатомное эл. поле, которое в свою очередь характеризует межатомные взаимодействия. Т.к. атом является устойчивой системой, то конфигурация электронов в атоме является устойчивой. Однако никакое устойчивое распределение зарядов не может быть статическим. На основании этого Резенфорд пришол к выводу, что электроны должны вращаться вокруг ядра, подобно вращению планет вокруг Солнца. В этом суть ядерной или планетарной модели Резенфорда.
mv(c.2)/2 – 2Lφ=2L* (α/r), r ≈10(c.-13) см. => заряд, сосредоточенный в атоме, имеет положительный знак и сосредоточен в очень малом объеме. Из всех опытов Резенфорд пришел к следующим представлениям о строении атомоа. Внутри атома имеется положительно заряженное ядро, заряд которого +ze, причем в ядре сосредоточен весь положительный заряд атома. С ядром связана и большая часть массы атома. Заряд ядра совпадает с порядковым номером элемента в таблице Менделеева. Т.к. атом нейтрален, то в атоме кроме положительно заряженного ядра есть электроны, причем суммарный заряд электронов равен положительному заряду ядра. Положительно заряженное ядро и электроны, входящие в состав атома, определяют внутриатомное эл. поле, которое в свою очередь характеризует межатомные взаимодействия. Т.к. атом является устойчивой системой, то конфигурация электронов в атоме является устойчивой. Однако никакое устойчивое распределение зарядов не может быть статическим. На основании этого Резенфорд пришол к выводу, что электроны должны вращаться вокруг ядра, подобно вращению планет вокруг Солнца. В этом суть ядерной или планетарной модели Резенфорда.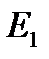 ,
, 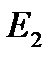 , …,
, …,  . Стационарным состояниям атома соответствуют орбиты, по которым движутся электроны. Хотя электроны движутся по стационарным орбитам с ускорением, они не излучают и не поглощают энергию.
. Стационарным состояниям атома соответствуют орбиты, по которым движутся электроны. Хотя электроны движутся по стационарным орбитам с ускорением, они не излучают и не поглощают энергию.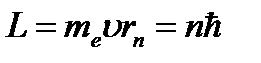 , n= 1, 2, 3,…, где
, n= 1, 2, 3,…, где  - масса электрона,
- масса электрона, 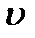 - его скорость по n -ой орбите радиуса
- его скорость по n -ой орбите радиуса 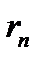 ,
, 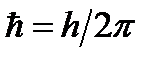 .
. .
.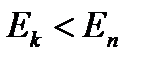 происходит излучение фотона (переход из состояния с большей энергией в состояние с меньшей энергией), при
происходит излучение фотона (переход из состояния с большей энергией в состояние с меньшей энергией), при  - поглощение фотона (переход атома в состояние с большей энергией).
- поглощение фотона (переход атома в состояние с большей энергией). определяет линейчатый спектр атома.
определяет линейчатый спектр атома.


