

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Электрокондуктометрические анализаторы в настоящее время широко используются в промышленности для автоматического контроля концентрации растворов солей, кислот, щелочей и других сред. Промышленные электрокондуктометрические анализаторы имеют класс точности 1-5. Они могут быть использованы для анализа газовых смесей. Такой анализ базируется на предварительном растворении анализируемого газа во вспомогательной жидкости и измерении её электрической проводимости.
Электрокондуктометрические анализаторы находят применение в медицинских и биологических исследованиях.
Принцип действия электрокондуктометрических (или просто кондукто-метрических) анализаторов или кондуктометров, которые относятся к электрохимическим средствам измерений, состоит в измерении электрической проводимости (электропроводности) растворов электролитов, по которой определяется концентрация растворённых веществ. Единицей электропроводности в СИ служит Сименс (См) - величина, обратная Ому.
В растворах электролитов часть молекул диссоциирует на положительные и отрицательные ионы, которые соответственно называют катионами и анионами. Это придает растворам способность проводить электрический ток. В общем случае, если жидкость является частью электрической цепи, то она ведет себя при определённых условиях как электрическое сопротивление, проводимость К которого определяется выражением (1)
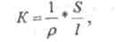
|
где р - удельное сопротивление; s и l - площадь и длина сечения проводника. Величина, обратная удельному сопротивлению р, называется удельной электрической проводимостью (или удельной электропроводностью):

|
Единицей удельной электропроводности обычно служит 1 См/см = 102 См/м. Удельная электропроводность разбавленного однокомпонентного раствора электролита определяется законом Кольрауша:
|
|

|
где а - степень электролитической диссоциации, определяющая долю диссоциировавших молекул электролита от общего их числа в растворе; С - эквивалентная концентрация раствора, выраженная в г-экв, растворенного вещества в 1 см3 раствора: z - валентность ионов; u к и u а - подвижности катионов и анионов соответственно.
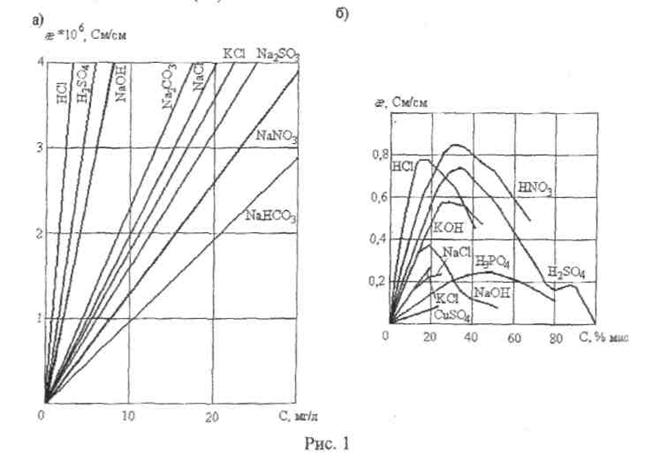
Вид функции, связывающей удельную электропроводность раствора с концентрацией, зависит от значения последней. Эта функция линейна (рис. 1а) только для разбавленных растворов (обычно до концентраций не превышающих 100 мг/л), пока малы силы электростатического межионного взаимодействия. С увеличением концентрации указанная функция становится нелинейной и даже неоднозначной (1б).
Для разбавленных растворов удельная электропроводность растворов является величиной аддитивной. Удельная электропроводность растворов возрастает с увеличением температуры, что обусловлено увеличением количества ионов. Зависимость удельной электропроводности ǽ, от температуры ( выражается уравнением второго порядка:
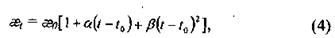
где а, β- температурные коэффициенты; ǽ0 - удельная электропроводность при температуре t0.
Чувствительные элементы кондуктометров, по сопротивлению которых определяется концентрация анализируемого раствора, называют электролитическими измерительными ячейками. По конструкции различают контактные и бесконтактные измерительные ячейки и соответственно кондуктометры. В контактных измерительных ячейках в анализируемом растворе размещаются электроды, т.е. имеет место гальванический контакт с ним. В бесконтактных измерительных ячейках этот контакт отсутствует, а используется электромагнитное взаимодействие с анализируемым раствором.
Простейшей является двухэлектродная ячейка (рис. 2а), которая представляет собой камеру 1 с двумя инертными металлическими электродами 2 и 3, заполняемую или промываемую анализируемой жидкостью. При приложении к электродам постоянной разности потенциалов на границе металл - электрод -электролит образуется так называемый двойной электрический слой, в пределах которого и протекают электрохимические процессы в ячейке. Этот слой рассматривают как плоский конденсатор, обкладками которого являются заряженные поверхности металлического электрода и слой ионов противоположного знака, находящихся вблизи поверхности электрода, по мере прохождения тока в одном направлении положительные и отрицательные ионы, соприкасаясь с электродами, разряжаются и выделяются на них виде атомов. При этом ток через раствор постоянно уменьшается, что можно рассматривать как процесс зарядки конденсаторов, образованных двойными электрическими слоями около электродов. Это явление называют поляризацией электродов. Им объясняется тот факт, что зависимость тока от напряжения, приложенного к электродам измерительной ячейки, является нелинейной (рис. 2б).
|
|
|
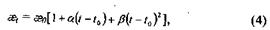
|
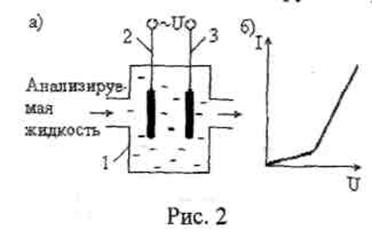 |
При прохождении через измерительную ячейку переменного тока явление поляризации электродов примерно на два порядка меньше искажает результат измерения электропроводности. Поэтому практически все измерения электропроводности растворов осуществляются на переменном токе. Причем для уменьшения погрешности от поляризации частоту переменного тока увеличивают.
Электрическое сопротивление измерительной ячейки определяется выражением:
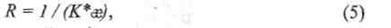
где К - константа измерительной ячейки, зависящая от площади поверхности электродов, расстояния между ними и их конфигурации, определяемая опытным путем.
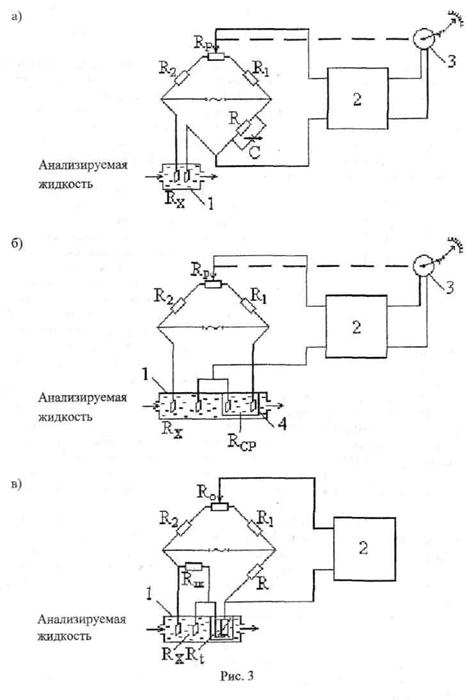
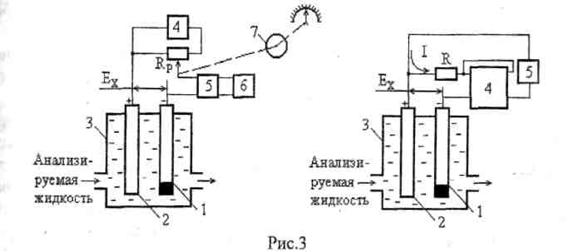
В практике автоматического аналитического контроля наиболее широкое применение имеют кондуктометры с контактными измерительными ячейками. Для измерения сопротивления электролитических измерительных ячеек применяются разные по схемам уравновешенные и неуравновешенные мосты переменного тока. На рис. За приведена схема простейшего контактного кондуктометра. Измерительная ячейка 1 с измеряемым сопротивлением Кх, в которую из блока подготовки поступает анализируемая жидкость, является одним из плечей уравновешенного моста. Смежное плечо моста составлено из сопротивления К и переменной емкости С, служащей для компенсации реактивной (емкостной) составляющей измерительной ячейки. Электронный усилитель 2 и реверсивный двигатель 3 служат для уравновешивания моста путем изменения сопротивлений плеч при перемещении движка реохорда Кр. Такой кондуктометр может использоваться только при постоянной температуре анализируемой жидкости. В тех случаях, когда температура анализируемой жидкости изменяется, используют схемы, показанные на рис. 36, в. В схеме рис. 36 для компенсации влияния температуры используется сравнительная электролитическая ячейка 4 с сопротивлением КсР, которая размещается в камере 4, и поэтому температура ее всегда равна температуре анализируемой жидкости. Сравнительная ячейка заполняется жидкостью, закономерность изменения электропроводности которой близка аналогичной закономерности для анализируемой жидкости (обычно при средней концентрации определяемого компонента в последней). Как видно из рисунка 3б, измерительная и сравнительная ячейки включены дифференциально, что и обеспечивает температурную компенсацию с достаточной для практики точностью.
|
|
Наибольшее распространение получили кондуктометры, в которых для температурной компенсации используются металлические терморезисторы (рис.3 в).
Терморезистор Rt в чехле 3 размещается в анализируемой жидкости, которая поступает в камеру 1. В силу того, что температурные коэффициенты электролитов и проводников противоположны по знаку, это позволяет при соответствующем подборе значения сопротивления Rt и сопротивления шунта Rш добиться постоянства общего сопротивления, включенного в измерительное плечо неуравновешенного моста, при изменениях температуры в заданном интервале для некоторого, например, среднего значения концентрации определяемого компонента в анализируемой жидкости. В приведённой схеме разбаланс моста измеряется вольтметром 2, а резистор Rо служит для установки начального уровня сигнала.
|
Потенциометрические анализаторы.
|
|
Назначение и принцип действия потенциометрического анализатора жидких сред
Потенциометрические анализаторы предназначены для измерений концентрации различных ионов в жидкостях (ионометрия) и контроля окислительно-восстановительного (редокс) потенциала (редоксметрия). Потенциометрический анализатор находит широкое применение в медицинских и биологических исследованиях.
Принцип действия потенциометрических анализаторов, относящихся к электрохимическим средствам измерений, основан на измерении потенциала электрода, размещенного в электролите, по которому определяется концентрация компонента анализируемого вещества. В зависимости от измеряемого параметра для получения измерительной информации используют: электродный потенциал, возникающий при погружении электрода, изготовленного из металла, в раствор, содержащий ионы этого металла; мембранный потенциал, возникающий на мембранах, обладающих селективной проницаемостью для одного типа ионов и разделяющих два одинаковых раствора, содержащих эти ионы в различных концентрациях; окислительно-восстановительный потенциал (редоксметрия), устанавливающийся на инертных металлических электродах, помещенных в раствор окислительно-восстановительных веществ.
В силу того, что электродный потенциал непосредственно измерить нельзя, его измеряют косвенным путем по ЭДС гальванического элемента (рис 1), составленного из измерительного (индикаторного) электрода 1 и сравнительного (вспомогательного или опорного) электрода 2. Оба электрода погружены в исследуемый электролит, например анализируемую жидкость, протекающую через ячейку 3. Потенциал измерительного электрода Еи изменяется при концентрации ионов в анализируемой среде, а потенциал сравнительного электрода ЕСр остается постоянным, так как он не зависит от концентрации ионов в анализируемой среде.
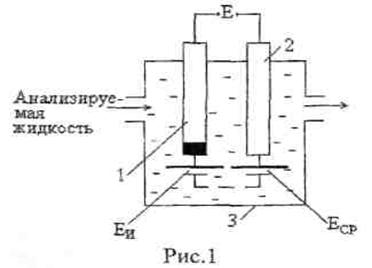
ЭДС такого гальванического элемента Е определяется разностью потенциалов измерительного и сравнительного электродов:

Измерение этой ЭДС при постоянном потенциале ЕСр позволяет получить информацию о концентрации определяемых ионов в анализируемой жидкости или о ее окислительно-восстановительных свойствах.
Для получения однозначной связи между ЭДС гальванического элемента и концентрацией определяемого иона измерительный электрод должен обладать селективностью к этому иону и не реагировать на изменение концентраций других ионов, содержащихся в анализируемой жидкости. На практике это требование трудно реализуемо, а потенциометрические анализаторы успешно применяются в основном в автоматическом контроле бинарных и псевдобинарных жидкостей.
|
|
В настоящее время известно большое число конструкций измерительных электродов для потенциометрии, обеспечивающих возможность селективного измерения концентрации ионов: Н+ К+, Na+, Са2+, Ва2+, Nl2+, (Са2++Ма2+), Cd2+, F, С, Br, N03 CN, С104, Г, SO и др. Такие электроды называют ионоселективными.
Характерной особенностью ионоселективных электродов является то, что в электродных реакциях не участвуют электроны, а основной является реакция обмена ионами между растворами, разделенными мембраной, обладающей селективной проницаемостью для одного типа ионов.
|
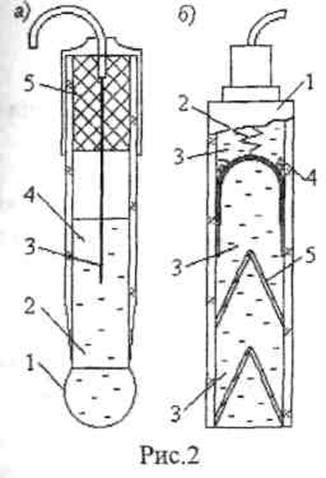
Одним из наиболее распространенных ионоселективных электродов является стеклянный электрод (рис. 2а), который применяется для измерений активной концентрации ионов водорода Н" и ионов натрия Na+. Корпус стеклянного электрода представляет собой стеклянную трубку 2, к нижнему концу которой припаяна мембрана 1 (сферическая, конусообразная или плоская) толщиной 0,06-0,1мм, изготовленная из специальных сортов стекла. Верхний конец трубки закрыт пробкой 5. Внутренняя полость трубки заполнена жидкостью 4 (обычно раствором 0,1 н. НС1 с кристаллами AgCl), называемой приэлектродной. Она выполняет функцию стандартного вещества и имеет постоянную активную концентрацию определяемого иона. В указанную жидкость погружен вспомогательный электрод 3 (контактный полуэлемент), представляющий собой серебряную проволочку, покрытую AgCl или AgBr (хлорсеребряный или бромосеребряный электроды).
Стекло мембран обычно состоит из оксидов элементов III и ГУ групп периодической системы (например, Al, Si) и оксидов элементов I и II групп (например, Na, Ca) и имеет трехмерную решетку, в которой наиболее подвижными переносчиками зарядов являются однозарядные катионы, что определяет селективную проницаемость стеклянных мембран для этих ионов. Обычно это свойство объясняется либо проницаемостью стекла для ионов водорода it либо адсорбцией ионов на поверхности. Электрическое сопротивление стеклянных электродов, определяемое сопротивлением их мембраны, велико и составляет 100... 1000 МОм, что делает необходимым использование для измерения электродного потенциала измерительных устройств с высоким входным сопротивлением. Наиболее широкое применение в потенциометрических анализаторах имеет сравнительный хлорсеребряный электрод (см. рис.2б). Он имеет стеклянный корпус 1, во внутренней полости которого расположен серебряный электрод 2, помещенный в 3,5 н. раствор 3 хлористого калия. Постоянный потенциал серебряного электрода обеспечивается наличием избытка хлористого серебра, которое в виде пасты 4 из кристаллов последнего располагается в верхнем отсеке электрода. Эластичные резиновые мембраны 5 предохраняют электрод от попадания внутрь его посторонних ионов из анализируемой жидкости при погружении в него электрода.

|
Электрический контакт между анализируемой жидкостью и раствором хлористого калия обеспечивается через кольцевые зазоры между внутренней поверхностью корпуса 1 и резиновыми мембранами 5 в местах прилегания последних к поверхности. Изменение объема жидкости, заполняющей электрод, при изменениях температуры компенсируется за счет деформации резиновых мембран. Сигнал гальванической ячейки потенциометрического анализатора, предназначенного для измерений концентрации aiионов в жидкой среде, описывается выражением
где Е* - постоянная ЭДС, зависящая от конструкций измерительного и сравнительного электродов; R — универсальная газовая постоянная; Т— абсолютная температура; и - валентность i - го иона; F- постоянная Фарадея.

|
Как видно из выражения (2), зависимость сигнала гальванической ячейки от концентрации является нелинейной. При этом значения концентрации, измеряемой потенциометрическими анализаторами, составляют 10°... 10" г-ион/л. В связи с этим в 1907г. датский химик Сервисен для выражения концентрации ионов водорода в растворах ввел понятие рН (р - первая буква слова potenz -степень, Н - химический символ водорода), которое определяется как отрицательный десятичный логарифм активной концентрации водородных ионов:

|
С учетом (3) выражение (2) можно представить в виде:
Таким образом, сигнал гальванической ячейки связан с величиной рН линейно, а сама эта величина является мерой активной концентрации (грамм-ионов, содержащихся в 1 л анализируемой жидкости).
На рис. 3 приведены наиболее типичные схемы промышленных потенциометрических анализаторов жидкостей.
В потенциометрическом анализаторе (рис. За), который содержит гальваническую ячейку 3 с измерительным 1 и сравнительным 2 электродами измерения сигнала последней осуществляется с помощью специального автоматического потенциометра с реохордом Rp, питающимся от стабилизированного источника постоянного тока 4. При измерении сигнал гальванической ячейки сравнивается с падением напряжения на реохорде. Отличие этого потенциометра от обычного состоит в том, что кроме усилителя переменного тока 6, реверсивного двигателя 7 и других узлов он содержит электрометрический усилитель 5, имеющий входное сопротивление 600 МОм. Потенциометрический анализатор (рис 3б) содержит гальваническую ячейку 3 с измерительным 1 и сравнительным 2 электродами, сигнал которой в процессе измерения сравнивается с падением напряжения на сопротивлении R, создаваемом током I. Последний унифицирован по значению и возникает в выходной цепи усилителя 4, имеющего высокое входное сопротивление. Таким образом, сигнал гальванической ячейки преобразуется в унифицированный сигнал промежуточным (нормирующим) преобразователем. Унифицированный токовый сигнал измеряется вторичным прибором 5 (обычно автоматическим потенциометром).
Известны схемы потенциометрических анализаторов, в которых предусмотрена коррекция показаний в зависимости от температуры анализируемой жидкости.
Потенциометрические автоматические анализаторы рН имеют диапазон измерений 0-1...0-14 рН и время реакции 15...30 с, а анализаторы рХ - диапазоны измерений 0-1...0-5 рХ и время реакции 5...10 мин. Классы точности потенциометрических анализаторов 0,5-10.
Потенциометрические анализаторы двуокиси углерода.
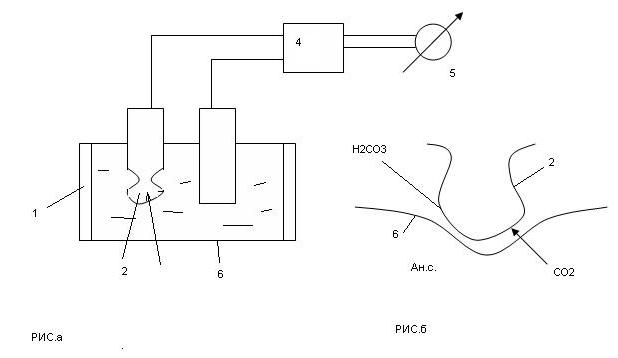
Анализатор содержит камеру 1, в которой размещены измерительный 2 и сравнительный 3 электроды потенциометрического анализатора, способного измерять концентрацию ионов водорода Н  в воде, заполняющей камеру 1. Эту камеру от анализируемой среды (газа / жидкости), содержащей СО
в воде, заполняющей камеру 1. Эту камеру от анализируемой среды (газа / жидкости), содержащей СО 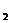 отделяет тонкая (15-20мкм) фторопластовая мембрана, через которую молекулы СО
отделяет тонкая (15-20мкм) фторопластовая мембрана, через которую молекулы СО  диффундируют в жидкую среду (камера 1) и растворяются в ней. При этом образуется угольная кислота. Чем больше концентрация СО
диффундируют в жидкую среду (камера 1) и растворяются в ней. При этом образуется угольная кислота. Чем больше концентрация СО  , тем больше концентрация угольной кислоты. Изменяется потенциал измерительного электрода 2 и оставляется постоянным потенциал электрода 3. разность потенциалов определяется электрометрическим усилителем 4, сигнал которого посылается на вольтметр 5.
, тем больше концентрация угольной кислоты. Изменяется потенциал измерительного электрода 2 и оставляется постоянным потенциал электрода 3. разность потенциалов определяется электрометрическим усилителем 4, сигнал которого посылается на вольтметр 5.
|
|
|

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!