1. Цель работы. Освоить метод оксиметрического определения концентрации растворенного кислорода и скорости его потребления микроорганизмами. Научиться снимать зависимость скорости роста аэробных микроорганизмов от концентрации растворенного кислорода, находить критическую концентрацию кислорода и константу Моно.
2. Основные положения. По отношению к молекулярно растворенному кислороду микроорганизмы делятся на 3 группы: аэробы, анаэробы, факультативные анаэробы (или факультативные аэробы). Аэробы нуждаются в кислороде, используя его в качестве акцептора электронов окисляемых веществ. Анаэробы не используют молекулярный кислород, напротив, он ингибирует их рост. Безусловные (облигатные) анаэробы способны расти только при очень низком содержании кислорода в питательном растворе (при концентрации кислорода менее 0,01 мг/л). Факультативные анаэробы способны расти как в присутствии кислорода, так и без него. В аэробных условиях, когда в среде содержится кислород, факультативы ведут себя как аэробы. При низких концентрациях кислорода (менее 0,1 мг/л), т.е. в условиях, близких к анаэробным, факультативные формы переходят на анаэробный метаболизм, т.е. растут подобно анаэробам. Однако переключение клеточного метаболизма с аэробного на анаэробный (а также с анаэробного на аэробный) требует значительного времени (около 2¸3 клеточных генераций). Поэтому при быстром (в течение нескольких минут) уменьшении концентрации растворенного кислорода факультативы ведут себя как аэробы даже при содержании кислорода менее 0,1 мг/л.
Когда кислород является лимитирующим рост фактором, то его влияние на удельную скорость роста микроорганизмов (аэробов или факультативных аэробов при быстром уменьшении концентрации кислорода) описывается уравнением Моно:
 , (4.1)
, (4.1)
| где
|  – удельная скорость роста, час-1; – удельная скорость роста, час-1;
|
|
|  – максимальная удельная скорость роста, час-1; – максимальная удельная скорость роста, час-1;
|
|
|  – концентрация растворенного кислорода, мг/л; – концентрация растворенного кислорода, мг/л;
|
|
|  – константа насыщения (константа Моно), мг/л. – константа насыщения (константа Моно), мг/л.
|
Для аэробных бактерий константа  имеет очень низкие значения (около 0,1 мг/л). Это создает экспериментальные трудности в ее определении. По этой причине иногда находят критическую концентрацию (
имеет очень низкие значения (около 0,1 мг/л). Это создает экспериментальные трудности в ее определении. По этой причине иногда находят критическую концентрацию ( ) растворенного кислорода, определяемую как концентрация кислорода, ниже которой скорость роста микроорганизмов падает. При математическом описании вводят кусочно-линейную аппроксимацию уравнения Моно:
) растворенного кислорода, определяемую как концентрация кислорода, ниже которой скорость роста микроорганизмов падает. При математическом описании вводят кусочно-линейную аппроксимацию уравнения Моно:
 (4.2)
(4.2)
Зависимости (4.1) и (4.2) приведены на рис. 4.1. Как видно из графика, константа Моно ( ) численно равна концентрации кислорода, при которой удельная скорость роста равна половине максимальной.
) численно равна концентрации кислорода, при которой удельная скорость роста равна половине максимальной.
Если удалось экспериментально снять зависимость (4.1) и получить значение  , то критическая концентрация вводится по соотношению:
, то критическая концентрация вводится по соотношению:
 . (4.3)
. (4.3)
Если точность экспериментальной техники не позволяет получить зависимость в области низких концентраций кислорода, то определение  невозможно. В этом случае находят критическую концентрацию непосредственно по экспериментальным данным (рис. 4.2).
невозможно. В этом случае находят критическую концентрацию непосредственно по экспериментальным данным (рис. 4.2).









Рис. 4.1. Зависимость  по уравнению Моно (-¾¾) и согласно кусочно-линейной аппроксимации (××××××××)
по уравнению Моно (-¾¾) и согласно кусочно-линейной аппроксимации (××××××××)
Рис. 4.2. Определение  по экспериментальным данным
по экспериментальным данным
Метод прямого определения скорости роста микроорганизмов является трудоемким и имеет невысокую точность. Упростить технику эксперимента и повысить его точность можно, перейдя к измерению скорости потребления кислорода, которая связана со скоростью роста соотношением:
 , (4.4)
, (4.4)
| где
|  - экономический коэффициент (прирост биомассы на единицу потребленного субстрата), мг биомассы/мг субстрата; - экономический коэффициент (прирост биомассы на единицу потребленного субстрата), мг биомассы/мг субстрата;
|
|
|  - энергетический коэффициент (потребление кислорода на единицу потребленного субстрата), мг кислорода/мг субстрата; - энергетический коэффициент (потребление кислорода на единицу потребленного субстрата), мг кислорода/мг субстрата;
|
|
|  - концентрация биомассы, мг биомассы/л; - концентрация биомассы, мг биомассы/л;
|
|
| 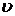 - скорость потребления кислорода микроорганизмами, мг кислорода/л. - скорость потребления кислорода микроорганизмами, мг кислорода/л.
|
Если в ходе эксперимента значения параметров  ,
,  ,
,  были постоянны, то
были постоянны, то  и
и 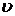 прямопропорциональны:
прямопропорциональны:
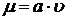
 . (4.5)
. (4.5)
Следовательно, зависимость  будет такой же, как зависимость
будет такой же, как зависимость  . Тогда значения константы Моно (
. Тогда значения константы Моно ( ) и критической концентрации (
) и критической концентрации (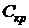 ) можно найти, получив экспериментально зависимость
) можно найти, получив экспериментально зависимость  .
.
Зависимость скорости роста или скорости потребления кислорода от его концентрации в водной среде необходима для расчета систем аэробной биологической очистки сточных вод (аэротенков), а также для описания микробиологических превращений в водоемах.
В аэротенках микроорганизмы находятся в виде хлопьев активного ила, состоящих из тысяч бактериальных клеток. Внутрь хлопьев кислород проникает за счет диффузии. Вследствие диффузионных процессов концентрация кислорода внутри хлопьев ила существенно меньше, чем в растворе. Так как экспериментально определяется концентрация кислорода в растворе, то зависимость от нее скорости роста микроорганизмов активного ила растягивается по оси абсцисс в сравнении с аналогичной зависимостью для свободноплавающих бактерий. Собственно, константа  и критическая концентрация кислорода увеличиваются. Поэтому для активного ила типичные значения
и критическая концентрация кислорода увеличиваются. Поэтому для активного ила типичные значения  составляют 0,5¸2 мг/л, т.е. примерно в 10 раз больше, чем для свободно плавающих клеток.
составляют 0,5¸2 мг/л, т.е. примерно в 10 раз больше, чем для свободно плавающих клеток.
Задание.
1. Приготовить модельную сточную воду.
2. Снять кинетическую кривую потребления кислорода активным илом в системе «активный ил - модельная сточная вода».
3. Обработать экспериментальные данные и получить зависимость скорости потребления кислорода от его концентрации, а также значения константы Моно и критической концентрации растворенного кислорода.
Ход работы.
1. Приготовление модельной сточной воды.
Модельная сточная вода готовится по одному из трех вариантов (вариант задается преподавателем).
Вариант I. В 1 литре предварительно отстоянной и аэрированной водопроводной воды растворить 500 мг глюкозы (можно использовать сахарозу или ксилозу), 54 мг хлористого аммония (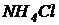 ) и 13 мг дигидрофосфата калия (
) и 13 мг дигидрофосфата калия (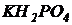 ). Контролировать рН. Если рН оказался ниже 6,5, то добавить раствор едкого натра (NaOH), чтобы выполнялось рН=6,5¸8,0. Полученная модельная сточная вода имеет БПК5=300 мг/л и содержит азот и фосфор в соотношении:
). Контролировать рН. Если рН оказался ниже 6,5, то добавить раствор едкого натра (NaOH), чтобы выполнялось рН=6,5¸8,0. Полученная модельная сточная вода имеет БПК5=300 мг/л и содержит азот и фосфор в соотношении:
БПК5:N:Р=100:4:1
Вариант II. Черный сульфатный щелок развести в 100 раз водопроводной водой и добавить биогенные соли (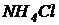 ,
, 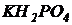 или
или 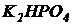 ) из соотношения БПК5:N:Р=100:4:1 (величина БПК5 разбавленного щелока задается преподавателем). Полученный раствор нейтрализовать серной кислотой до рН=6,5¸8,0. Описанными методами моделируется вода сульфатно-целлюлозного производства.
) из соотношения БПК5:N:Р=100:4:1 (величина БПК5 разбавленного щелока задается преподавателем). Полученный раствор нейтрализовать серной кислотой до рН=6,5¸8,0. Описанными методами моделируется вода сульфатно-целлюлозного производства.
Вариант III. Модельная сточная вода сульфитно-целлюлозного производства готовится разбавлением отработанного сульфитного щелока так же, как в варианте II, но для нейтрализации используется раствор едкого натра.
2. Получение кинетической кривой потребления кислорода активным илом.
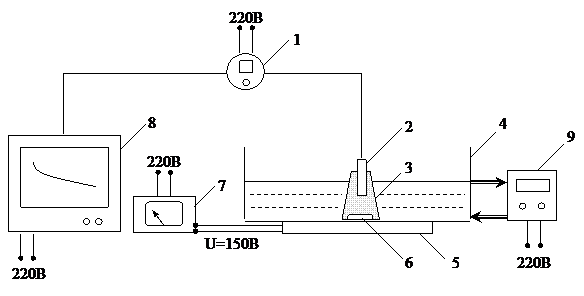
Наиболее точно потребление кислорода измеряется оксиметрическим методом. Принцип метода состоит в следующем. Насыщенную кислородом сточную воду смешивают с активным илом и помещают в сосуд с мешалкой. Затем в сосуд помещают датчик анализатора кислорода (оксиметра) таким образом, чтоб обеспечить герметичность сосуда и полное отсутствие в нем воздуха. Включают перемешивание. В результате потребления кислорода микроорганизмами его концентрация падает. Концентрация кислорода непрерывно измеряется оксиметром и фиксируется на ленте самописца, где вычерчивается кинетическая кривая 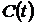 . Схема лабораторной установки для измерения потребления кислорода активным илом приведена на рис. 4.3.
. Схема лабораторной установки для измерения потребления кислорода активным илом приведена на рис. 4.3.
Рис. 4.3. Схема установки для измерения потребления кислорода активным илом:
1 – оксиметр (кислородомер); 2 – датчик оксиметра (кислородомера); 3 – рабочий сосуд с активным илом; 4 – ванна термостатирования; 5 – магнитная мешалка; 6 – перемешивающее устройство; 7 – лабораторный трансформатор (латр); 8 – самописец; 9 – термостат
При выполнении работы необходимо соблюдать определенную последовательность операций:
· Измерить объем жидкости (воды) в сосуде 3 при погруженном в него датчике 2. Для этого в сосуд наливают воду и опускают датчик так, чтобы часть воды вытеснилась из сосуда и вылилась в ванну 4. Затем датчик вынимают, а воду переливают в мерный цилиндр и измеряют ее объем (V).
· Рассчитать объем ила (Vи) и сточной воды (Vв) так, чтобы выполнялось:
Vи+Vв=V
Vв:Vи»4.
· Отобрать из лабораторного аэротенка иловую смесь объемом около 5 Vи и поместить ее в цилиндр для отстаивания. Когда объем, занимаемый осевшим илом, станет меньше Vи, слить сифоном надосадочную воду до отметки Vи. Активный ил объемом Vи из цилиндра перелить в сосуд 3 с перемешивающим устройством 6.
· Модельную сточную воду объемом Vв, предварительно насыщенную кислородом (аэрация в течение 5 мин. от микрокомпрессора), перелить в сосуд 3 с перемешивающим устройством 6.
· Опустить в сосуд с мешалкой датчик 2 оксиметра 1. Убедиться, что в сосуде отсутствуют пузырьки воздуха (могут прилипать к датчику), а жидкость занимает весь объем сосуда.
· Выставить на латре 7 напряжение U=150 В и включить магнитную мешалку 5. Убедиться, что обеспечивается хорошее перемешивание иловой смеси.
· Включить перо и ленту самописца 8. Убедиться, что показания оксиметра и самописца совпадают. Контролировать ход процесса, наблюдая за лентой самописца.
· Когда концентрация кислорода снизится до 5 мг/л, включить на оксиметре новый диапазон 0¸5 (исходное положение переключателя диапазонов оксиметра должно быть 0¸20). На диапазоне 0¸5 цена деления шкалы оксиметра составляет 0,2 мг/л, что позволяет производить визуальные измерения (по шкале оксиметра) более точно, чем отсчет по ленте самописца. Поэтому в момент, когда С=5,0 мг/л, включаем секундомер и снимаем показания по шкале оксиметра, занося результаты в таблицу (см. табл. 4.1).
Таблица 4.1
Результаты определения кинетики потребления кислорода
Активным илом
| t, сек.
|
|
|
|
|
|
|
| ...
|
|
|
| ...
|
| С, мг/л
| 5,0
| 4,8
| 4,6
| 4,4
| 4,2
| 4,0
| 3,8
| ...
| 2,0
| 1,9
| 1,8
| ...
|
Когда концентрация кислорода снизится до 2 мг/л, переходим на шкалу 0¸2, имеющую цену деления 0,1 мг/л. Продолжаем отсчет времени через каждые 0,1 мг/л (см. табл. 4.1), пока концентрация кислорода не достигнет нуля.



 , (4.1)
, (4.1) – удельная скорость роста, час-1;
– удельная скорость роста, час-1;
 – максимальная удельная скорость роста, час-1;
– максимальная удельная скорость роста, час-1;
 – концентрация растворенного кислорода, мг/л;
– концентрация растворенного кислорода, мг/л;
 – константа насыщения (константа Моно), мг/л.
– константа насыщения (константа Моно), мг/л.
 ) растворенного кислорода, определяемую как концентрация кислорода, ниже которой скорость роста микроорганизмов падает. При математическом описании вводят кусочно-линейную аппроксимацию уравнения Моно:
) растворенного кислорода, определяемую как концентрация кислорода, ниже которой скорость роста микроорганизмов падает. При математическом описании вводят кусочно-линейную аппроксимацию уравнения Моно: (4.2)
(4.2) , то критическая концентрация вводится по соотношению:
, то критическая концентрация вводится по соотношению: . (4.3)
. (4.3)













 по уравнению Моно (-¾¾) и согласно кусочно-линейной аппроксимации (××××××××)
по уравнению Моно (-¾¾) и согласно кусочно-линейной аппроксимации (××××××××)
 , (4.4)
, (4.4) - экономический коэффициент (прирост биомассы на единицу потребленного субстрата), мг биомассы/мг субстрата;
- экономический коэффициент (прирост биомассы на единицу потребленного субстрата), мг биомассы/мг субстрата;
 - энергетический коэффициент (потребление кислорода на единицу потребленного субстрата), мг кислорода/мг субстрата;
- энергетический коэффициент (потребление кислорода на единицу потребленного субстрата), мг кислорода/мг субстрата;
 - концентрация биомассы, мг биомассы/л;
- концентрация биомассы, мг биомассы/л;
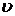 - скорость потребления кислорода микроорганизмами, мг кислорода/л.
- скорость потребления кислорода микроорганизмами, мг кислорода/л.
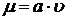
 . (4.5)
. (4.5) будет такой же, как зависимость
будет такой же, как зависимость 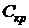 ) можно найти, получив экспериментально зависимость
) можно найти, получив экспериментально зависимость 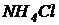 ) и 13 мг дигидрофосфата калия (
) и 13 мг дигидрофосфата калия (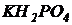 ). Контролировать рН. Если рН оказался ниже 6,5, то добавить раствор едкого натра (NaOH), чтобы выполнялось рН=6,5¸8,0. Полученная модельная сточная вода имеет БПК5=300 мг/л и содержит азот и фосфор в соотношении:
). Контролировать рН. Если рН оказался ниже 6,5, то добавить раствор едкого натра (NaOH), чтобы выполнялось рН=6,5¸8,0. Полученная модельная сточная вода имеет БПК5=300 мг/л и содержит азот и фосфор в соотношении: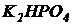 ) из соотношения БПК5:N:Р=100:4:1 (величина БПК5 разбавленного щелока задается преподавателем). Полученный раствор нейтрализовать серной кислотой до рН=6,5¸8,0. Описанными методами моделируется вода сульфатно-целлюлозного производства.
) из соотношения БПК5:N:Р=100:4:1 (величина БПК5 разбавленного щелока задается преподавателем). Полученный раствор нейтрализовать серной кислотой до рН=6,5¸8,0. Описанными методами моделируется вода сульфатно-целлюлозного производства.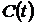 . Схема лабораторной установки для измерения потребления кислорода активным илом приведена на рис. 4.3.
. Схема лабораторной установки для измерения потребления кислорода активным илом приведена на рис. 4.3.