

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
Топ:
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Интересное:
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Дисциплины:
|
из
5.00
|
Заказать работу |
1) 1780 Лавуазье, Лаплас установили:
Кол-во теплоты, поглощаемое при разложении соединения должно быть равно количеству теплоты, которое выделяется при образовании этого соединения при этех же условиях. |qразл|=|qIобр| 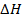 разл=
разл= 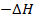 обр. Т.е. при написании обратной реакции надо изменить знак
обр. Т.е. при написании обратной реакции надо изменить знак 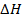 .
.
2) 1840 Гесс:
Суммарный тепловой эффект химической реакции при постоянном P не зависит от промежуточных стадий реакций.
Оба принципа вытекают из I закона термодинамики и являются следствиями того факта, что H – функция состояния.
P=const: 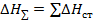
Это позволит рассчитать изменение Н для реакций, которые нельзя изучить непосредственно.
3С(тв.)+ 2О2(газ)=2СО(газ)+CО2(газ)
Нецелесообразно измерять теплоту сгорания углерода до окиси углерода в ограниченном количестве О2, т.к. в продуктах реакции всегда есть смесь СО+ CО2 неопределенного состава.
Однако,
- можно измерить теплоту сгорания С до CО2 в избытке О2: для графита при 250С
С(тв.)+ О2(газ)=CО2(газ) 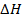 0=-94,0518ккал.
0=-94,0518ккал.
- можно измерить теплоту сгорания СО до CО2
СО(газ)+ 1/2О2(газ)=CО2(газ) 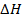 0=-67,6361ккал
0=-67,6361ккал
Нужную реакцию можно сконструировать из этих двух:
С(тв.)+ О2(газ)=CО2(газ) 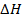 0= - 94,0518ккал.
0= - 94,0518ккал.
+
CО2(газ)=СО(газ)+ 1/2О2(газ) 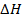 0=+67,6361ккал
0=+67,6361ккал
_______________________________________
С(тв.)+ 1/2О2(газ)= СО(газ)) 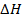 0= - 26,4157ккал
0= - 26,4157ккал

Допущения:
Пусть энтальпия элемента равна нулю при любой температуре.
Действительно, для нас представляет интерес разность энтальпий продуктов и исходных веществ в том случае, когда речь идет о простых элементах типа (O;H;N), то ясно, что они не из чего не образуются, нет перехода, нет изменения энтальпии.
Значит произвольно положим энтальпию простого элемента равной нулю при любой температуре, и это будет нашей точкой отсчета.
Простыми считаются элементарные вещества, находящиеся в том агрегатном состоянии, которое для них устойчиво при атмосферном давлении P=1атм и рассматриваемой температуре Т.
Например, при комнатной температуре Т=298К (250С) простыми веществами являются газы H2, O2, N2, жидкости Hg, Br и твердые вещества, такие как C, Si, Fe и др.
Теплота образования простых веществ принимается равной нулю.
11 Энтальпия образования химической реакции.
Химическую реакцию с двумя исходными веществами А1 и А2 и двумя продуктами реакции А3 и А4 можно записать:

Где 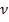 - стехиометрические коэффициенты.
- стехиометрические коэффициенты.
Пусть для продуктов реакции 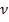 3,
3, 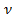 4>0, для исходных веществ
4>0, для исходных веществ 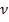 1,
1, 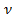 2<0
2<0
Поэтому химическую реакцию можно представить в виде:

(1.25)
Изменение энтальпии для этой реакции равно разности суммы энтальпий продуктов реакции к сумме H исходных веществ.

(1.26)
Важно не абсолютное значение Н в-ва, а насколько это отличается от Н других веществ, т.е. разности энтальпий продуктов реакции и исходных веществ.
Допущение:
Пусть энтальпия элемента равна нулю при любой Т.
Отсюда:
Hi вещества, находящегося в стандартном состоянии равна 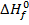 - изменению Н в реакции образования моля вещества из элементов в их стандартном состоянии.
- изменению Н в реакции образования моля вещества из элементов в их стандартном состоянии.
Например:
Н образования СО2= 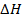 по следующей реакции.
по следующей реакции.
С(графит)+О2(газ)=СО2(газ)  0=-94,0518 ккал/моль
0=-94,0518 ккал/моль
ð  =-94,0518 ккал/моль
=-94,0518 ккал/моль
 0=
0= 
Где  0 = теплоте полного сгорания углерода до двуокиси в избытке кислорода можно измерить точно.
0 = теплоте полного сгорания углерода до двуокиси в избытке кислорода можно измерить точно.
Поскольку энтальпия сгорания водорода до Н2О (ж.) имеет то же значение, что и энтальпия образования воды.
Если реакция образования какого-либо вещества из элементов не идет достаточно быстро, то для расчета Н образования можно воспользоваться значениями 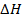 0 для ряда других реакций из которых можно составить данную.
0 для ряда других реакций из которых можно составить данную.
Изменение стандартной Н для реакций можно рассчитать из Н образования по уравнению:
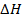 0=
0= 
(1.27)
Энтальпии образования многих соединений, ионов известны с большой точностью. Они сведены в таблицы. Пользуясь этими энтальпиями образования можно рассчитать изменения энтальпии для большого числа реакций по уравнению 1.27.

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!