

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Интересное:
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
В усреднитель поступающие с трёх технологических процессов стоки, имеют различные составы. Так как все ванны имеют разный компонентный состав, то происходит трехкратное разбавление всех имеющихся концентраций
Согласно проведенным расчетам в таблице 2 приведены итоговые концентрации поступающие в усреднитель а после на сооружения очистки.
Таблица №2
| Вещество | Концентрация вещества мг/дм | Эквивалентная масса | Концентрация вещества мг*экв/дм | Kt мг*экв/дм | An мг*экв/дм |
| Na2CO3 | 108,84 | 53,00 | 2,05 | 2,05 | 2,05 |
| HCl | 256,50 | 36,45 | 7,04 | 7,04 | 7,04 |
| FeSO4 | 4395,00 | 79,78 | 55,09 | 55,09 | 55,09 |
| CuSO4 | 1870,67 | 80,99 | 23,10 | 23,10 | 23,10 |
| Н2SO4 | 339,00 | 49,00 | 6,92 | 6,92 | 6,92 |
Ниже в таблице 3 приведен ионный состав воды поступающий в усреднитель:
Таблица №3
| Вещество | Катионы | Анионы | |||||
| H | Na | Fe | Cu | CO3 | SO4 | Cl | |
| Na2CO3 | 2,05 | 2,05 | |||||
| HCl | 7,04 | 7,04 | |||||
| FeSO4 | 55,09 | 55,09 | |||||
| CuSO4 | 23,10 | 23,10 | |||||
| Н2SO4 | 6,92 | 6,92 | |||||
| Итого: | 13,96 | 2,05 | 55,09 | 23,10 | 2,05 | 85,11 | 7,04 |
Из полученных табличных данных составляем диаграммы ионного состава сточной воды поступившей в усреднитель:

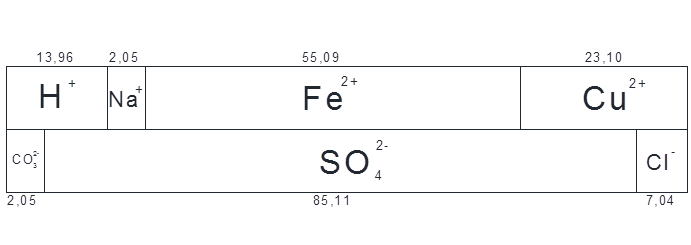
Согласно химическим составам процесса обезжиривания и травления в усреднитель поступают кислые и щелочные воды соответственно. В процессе смешения будет происходить процесс нейтрализации. В результате процесса произойдёт изменение в результате чего часть ионов водорода при взаимодействии с карбонат-ионом перейдёт в форму гидрокарбонатов, а затем в углекислый газ в эквивалентном количестве, в два этапа, по уменьшению ионизации:
· При константе ионизации К2=10,32:
НСО3=Н++СО32-
· При константе ионизации К1=6,35:
Н2СО3=Н++НСО32-
В результате чего углекислота распадается на углекислый газ и воду:
|
|
Н2СО3=Н2O+СO2-;
Диаграмма после процесса нейтрализации сточной воды в усреднителе представлена на рисунке 3.1.
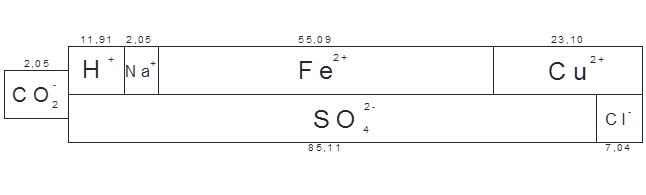
Рисунок 3.1 – Диаграмма состава сточной воды в усреднителе после нейтрализации
По результатам расчетов в процессе смешения и нейтрализации образуются кислые сточные воды с большой концентрацией тяжелых металлов в виде двухвалентных железа и меди.
Удаление железа и меди
Для обезжелезивания сточной воды был принят метод глубокой аэрации, установленной в усреднителе. В процессе аэрации происходит окисление двухвалентного железа в трехвалентное после чего гидроксид железа легко отделяется от жидкостной фазы простым отстаиванием. Кроме окисления железа произойдет отдув углекислого газа из воды. Реакция окисления железа в водном растворе протекает по следующей реакции:

При окисление иона железа кислородом происходит изменение его валентности с Fe2+ до Fe3+ и соответственно изменяется его эквивалентная масса:
МЭ(Fe3+)=  =
=  =82,62 мг*экв/дм3;
=82,62 мг*экв/дм3;
После перехода в другую валентность железа, из воды выделяется гидроксид ион в количестве равном:
ОН-=82,62- 55,09=27,53 мг*экв/ дм3;
 Рисунок 4.1 – Диаграмма сточной воды при переходе Fe2+ к Fe3+
Рисунок 4.1 – Диаграмма сточной воды при переходе Fe2+ к Fe3+
В результате образование гидроксидов произойдет взаимодействие Н+ и ОН- с образованием воды, после чего останется часть гидроксидов:
ОН-= ОН-Н+-=27,53-11,91=15,62 мг-экв/дм3;
Диаграмма сточной воды после реакции представлена на рисунке 4.2.
 Рисунок 4.2 – Диаграмма состава сточной воды после аэрации
Рисунок 4.2 – Диаграмма состава сточной воды после аэрации
Значение рН, соответствующее началу осаждения гидроксида железа и гидроксида меди и полному его осаждению будут 6,4-8,0 и 7,5-10 единиц соответственно. Так как в воде среда щелочная то часть имеющихся гидроксидов пойдет на окисление железа и меди но так как остаточных анионов ОН не достаточно то требуется ввести реагент для доведения гидроксогруппы для необходимого значения. В качестве реагента вводим едкий натр технический марки ТР, и долей активного вещества 69,85%. Доза щелочи для нейтрализации с учетом имеющейся ОН группы будет равна:
|
|
Доза для окисления железа будет равна:
 =
=  *40=(82,62-15,62)*40=2680 мг /дм3;
*40=(82,62-15,62)*40=2680 мг /дм3;
Доза для окисления цинка будет равна:
 =
=  *40=23,10*40 = 924 мг /дм3;
*40=23,10*40 = 924 мг /дм3;
Доза для доведения рН до 10:
рН0=7=> рНтреб.=10
РОН=14-10=4
ДNaOH=1*10-4-1*10-7≈1*10-4 г*экв/дм3;
 1*10-4 *
1*10-4 *  =1*10-4 *40*103= 4 мг/ дм3;
=1*10-4 *40*103= 4 мг/ дм3;
После введения NaOH и достижения рН=10 единицам.
Общая доза технического продукта будет равна:
 =
=  = 5165,35 мг/ дм3
= 5165,35 мг/ дм3
(5,16535 г/дм3)
После введения реагента сточная вода направляется в отстойник, где происходит осаждение гидроксидов железа и меди. Далее для нейтрализации избыточной щелочности воды вводится соляная кислота. Доза соляной кислоты для доведения сточной воды определяется по формуле:
 мг*экв/ дм3=
мг*экв/ дм3=  ;
;
Итоговая диаграмма сточной воды после всех протекающих реакций при введении реагента в сточную воду представлена на рисунке 4.3.

Рисунок 4.3 – Диаграмма состава сточной воды после реагентного удаления железа и меди
Расчет усреднителя
Расход и концентрация загрязнений производственных сточных вод могут колебаться в течение суток в широких пределах. Для исключения колебаний расхода сточной воды поступающей на очистку необходимо предусматривать регулирующие емкости — усреднители, обеспечивающие возможность равномерной подачи сточных вод с усредненной концентрацией на очистные сооружения.
Наиболее полное перемешивание может быть достигнуто барботерами, мешалками, насосами (рисунок 5.1). Барботирование (перемешивание сточной воды сжатым воздухом) производится через перфорированные трубы с отверстиями, расположенными снизу.

Рисунок 5.1 – Усреднитель барбатажного типа
Для определения емкости уследнителя необходимо знать наибольший объем подлежащий заполнению в течении суток. Для этого по таблица 5.1 определяем наибольший объем заполняемый в течении двух рабочих смен.
Таблица 5.1 Приращение объема водной массы D W, м3;
| Часы суток | Поступление в % | Подача в усреднитель qi м3 /ч | Расход после усреднителя qex м3 /ч | Поступление в емкость, ∆qi м3 | Расход из емкости ∆qi м3 | Остаток в емкости |
| ∆Wi м3 | ||||||
| 0-1. | ||||||
| 1-2. | ||||||
| 2-3. | ||||||
| 3-4. | ||||||
| 4-5. | ||||||
| 5-6. | ||||||
| 6-7. | ||||||
| 7-8. | ||||||
| 8-9. | 3,125 | 43,767 | 62,517 | 18,75 | ||
| 9-10. | 6,25 | 62,517 | 62,517 | - | - | |
| 10-11. | 6,25 | 62,517 | 62,517 | - | - | |
| 11-12. | 9,375 | 81,267 | 62,517 | 18,75 | - | 18,75 |
| 12-13. | 3,125 | 43,767 | 62,517 | - | 18,75 | |
| 13-14. | 6,25 | 62,517 | 62,517 | - | - | |
| 14-15. | 6,25 | 62,517 | 62,517 | - | - | |
| 15-16. | 9,375 | 81,267 | 62,517 | 18,75 | - | 18,75 |
| 16-17. | 3,125 | 43,767 | 62,517 | - | 18,75 | |
| 17-18. | 6,25 | 62,517 | 62,517 | - | - | |
| 18-19. | 6,25 | 62,517 | 62,517 | - | - | |
| 19-20. | 9,375 | 81,267 | 62,517 | 18,75 | - | 18,75 |
| 20-21. | 3,125 | 43,767 | 62,517 | - | 18,75 | |
| 21-22. | 6,25 | 62,517 | 62,517 | - | - | |
| 22-23. | 6,25 | 62,517 | 62,517 | - | - | |
| 23-24 | 9,375 | 81,267 | 62,517 | 18,75 | - | 18,75 |
| Всего | 1000,272 | 62,517 |
Согласно расчетам, приведенным в таблице 5.1, максимальный объем усреднителя составит 18,75 м3.
|
|
Принимаем двух секционный усреднитель, тогда площадь одной секции будет:
 ;
;
Где:
W-объём усреднителя 18,75 м3;
n-количество секций, 2 шт.
H-глубина усреднителя 1 м.
Назначается ширина секций B и определяется длинна усреднителя L:

Определяетя скорость продольного движения воды v:

Скорость не должна превышать V<0,0025 
 0,0005 м/с следовательно условие выполняется.
0,0005 м/с следовательно условие выполняется.
Для аэрации сточной воды проектируются трубы-барботёры, которые укладываются вдоль резервуара на подставках высотой 6 см. Глубина погружения барботёров Hb=2 м.
В качестве барботеров принимаются полиэтиленовые перфорированные трубы.
Так как в усреднителе производится аэрация воды, то для определения интенсивности подачи воздуха требуется доза кислорода используемого в процессе окисления железа.
На окисление 1 мг двухвалентного железа расходуется 0,143 мг кислорода. Для обеспечения высокой скорости химической реакции содержание кислорода в воде должно быть 0,5-0,9 мг на 1 мг железа. Исходя из этого, количество подаваемого в систему кислорода будет равно:
 =
=  =1,4 г/дм3 (1,4 кг/м3);
=1,4 г/дм3 (1,4 кг/м3);
Один м3 воздуха равен 1,27 кг, и имеет содержание О2= 21% тогда масса кислорода будет равна:
m(О2)=1,27*0,21=0,267 кг О2/м3;
Из полученного количества кислорода только 20 % вступают в реакцию с железом, тогда полезная масса кислорода вступающая в реакцию будет равна:
mп(О2)=0,267*0,20=0,0534 кг О2/м3.
Количество воздуха необходимое на подачу в усреднитель рассчитываем как отношение требуемой массы кислорода в 1 м3 к массе кислорода в 1 м3 воздуха. Тогда:
|
|
 м3/ч = 0,263 м3/мин;
м3/ч = 0,263 м3/мин;
Для интенсивного перемешивания СВ в усреднителе 1 повышаем расход до 1 м3/мин.
Для подачи воздуха принимаем одну воздуходувку фирмы KAESER модели ВВ 51С производительностью 2,17 м3/мин, избыточным давлением 1000 мбар. и диаметром трубопровода 50 мм. Габариты установки 800х790х1120 мм.
Подбор и расчет сооружений
Подбор камер реакций
Для смешения реагента с водой требуются сооружения, обеспечивающие полное смешивание его с водой. В качестве такого сооружения была принята вертикальная камера реакций с механическим перемешиванием фирмы «Уралтехнострой-Туймазыхиммаш» (Рисунок 6.1).

Рисунок 6.1 – Вертикальная камера реакций с механическим перемешиванием фирмы «Уралтехнострой-Туймазыхиммаш»
Данные аппараты применяются для проведения химических реакций. В зависимости от свойств среды комплектуются моторредукторами МПО-1 и МПО-2 различных мощностей и числом оборотов, торцевыми и сальниковыми уплотнениями. По конструкции перемешивающие устройства изготавливаются: пропеллерные, турбинные, лопастные, рамные. Объёмы камер реакций далее КР, принимаем из расчета пребывания сочных вод в камере 10 минут.
В потоке предусмотрена одна точка ввода реагента. Объемы подбираем по 10 минутному пребыванию воды.
Условно обозначим камеру реакций как КР-1.
Объем находим по формуле:
 *0,1667=10,42 м3;
*0,1667=10,42 м3;
Где: Qп – расход после усреднителя  м3/ч;
м3/ч;
 – время пребывания сточной воды в КР, 10мин. (0,1667 ч);
– время пребывания сточной воды в КР, 10мин. (0,1667 ч);
Исходя из полученного объема принимаем КР характеристиками представленными в таблице 6.1:
Таблица 6.1 – Характеристика камеры реакций
| Объем полный, м3 | до 20 |
| Диаметр внутренний, мм | |
| Длина, мм | |
| Ширина, мм | |
| Высота, мм | |
| Температура стенки, 8С | от – 60 до + 250 |
| Материальное исполнение | углеродистая сталь |
| Масса аппаратов, кг | |
| расчетным давлением в корпусе, МПа | 0,6 |
| Толщина стенок,мм | 2Х18 |
| Тип мешалки | МПО-1 |
| Диаметр мешалки, мм | |
| Числом оборотов, об/мин |
|
|
|

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!