Таблица 1-1. Классификация основных аминокислот белков по их химическому строению
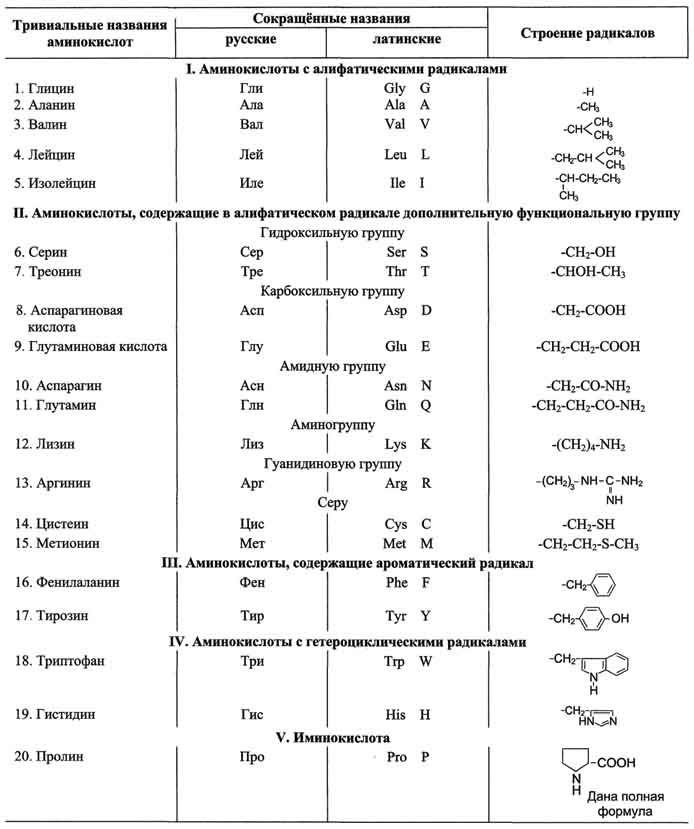
Таблица 1-2. Примеры названий аминокислот по заместительной номенклатуре и соответствующие тривиальные названия
| Название аминокислоты по заместительной номенклатуре
| Формула аминокислоты
| Тривиальное название
|
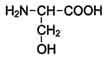
| 2-амино-З-гидроксипропановая кислота
| 
| Серии
|
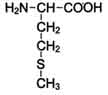
| 2-амино-4-метилтиомасляная кислота
| 
| Метионин
|
Для записи аминокислотных остатков в молекулах пептидов и белков используют трёхбуквенные сокращения их тривиальных названий, а в некоторых случаях и однобуквенные символы (см. табл. 1-1).
Тривиальные названия часто происходят от названия источника, из которого они впервые были выделены, или от свойств данной аминокислоты. Так, серии впервые был выделен из фиброина шёлка (от лат. serieum - шелковистый), а глицин получил свое название из-за сладкого вкуса (от греч. glykos - сладкий).
3. Классификация аминокислот
по растворимости их радикалов в воде
Все 20 аминокислот в белках организма человека можно сгруппировать по способности их радикалов растворяться в воде. Радикалы можно выстроить в непрерывный ряд, начинающийся полностью гидрофобными и заканчивающийся сильно гидрофильными.
Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные её отталкивают).
Аминокислоты с неполярными радикалами
К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается.
Аминокислоты с полярными незаряженными радикалами
Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серии, треонин и тирозин, имеющие гидроксильные группы, аспарагин и глутамин, содержащие амидные группы, и цистеин с его тиольной группой.
Цистеин и тирозин содержат соответственно тиольную и гидроксильную группы, способные к диссоциации с образованием Н+, но при рН около 7,0, поддерживаемого в клетках, эти группы практически не диссоциируют.
Схема. Структура полярных заряженных аминокислот в диссоциированной форме
Таблица 1-3. Изменение суммарного заряда аминокислот в зависимости от рН среды

необходимые для выполнения ими специфических функций. Так,?-карбоксиглутаминовая кислота входит в состав белков, участвующих в свёртывании крови, и две близко лежащие карбоксильные группы в их структуре необходимы для связывания белковых факторов с ионами Са2+. Нарушение карбоксилирования глутамата приводит к снижению свёртываемости крови.
Значение гидроксильных групп в составе лизина и пролина описано в разделе 15.
6. Химические реакции, используемые для
обнаружения аминокислот
Способность аминокислот вступать в те или иные химические реакции определяется наличием в их составе функциональных групп. Так как все аминокислоты, входящие в состав белков, содержат у?-углеродного атома амино- и карбоксильную группы, они могут вступать в характерные для всех аминокислот химические реакции. Наличие каких-либо функциональных групп в радикалах индивидуальных аминокислот определяет их способность вступать в специфичные для данных аминокислот реакции.
УГЛЕВОДЫ
Углеводы — это питательные вещества, присутствующие почти во всех продуктах питания, в основном в пище растительного происхождения. Организм использует их для получения энергии, которую расходует на многочисленные реакции метаболизма: углеводы — это основное «горючее» организма.
ВИДЫ УГЛЕВОДОВ
Углеводы состоят из атомов углерода, кислорода и водорода. Они также называются гидратами углерода, поскольку каждый его атом соединен с атомом кислорода и двумя атомами водорода — в такой же пропорции кислород и водород содержатся в молекулах воды (Н20). Согласно химическому составу и структурным единицам - сахаридам, выделяют основные группы углеводов.
Простые углеводы, или сахара, состоят из одной структурной единицы и называются моносахаридами — например, глюкоза, фруктоза и галактоза; дисахариды состоят из двух структурных единиц — например, пищевой сахар, состоящий из одной молекулы глюкозы и одной молекулы фруктозы. Лактоза — молочный сахар, состоит из молекул глюкозы и галактозы; мальтоза состоит из двух молекул глюкозы. Сложные углеводы называются полисахаридами и состоят из множества простых соединений атомов и молекул, объединенных в длинные цепи, например крахмал и гликоген, присутствующие в растительной пище.
Злаки, корнеплоды и овощи — это продукты, содержащие много углеводов, которые составляют основу рациона человека.
РАСЩЕПЛЕНИЕ УГЛЕВОДОВ В ОРГАНИЗМЕ
Большая часть углеводов, присутствующих в продуктах питания, являются ди- и полисахаридами, но только моносахариды благодаря крошечному размеру могут всасываться через стенки пищеварительного тракта. Поэтому сложные углеводы вступают в реакцию с ферментами, расщепляющими их на структурные единицы — моносахариды. Завершающим этапом процесса пищеварения является усвоение молекул глюкозы, фруктозы и галактозы, которые транспортируются к печени, где превращаются в глюкозу, поступающую в кровь и разносящуюся по всему организму.
ГЛЮКОЗА
Человеческий организм может использовать как источник энергии только один вид углеводов — глюкозу. Молекулы глюкозы, высвобожденные в процессе расщепления сложных углеводов, всасываются в кишечнике или в печени. Глюкоза стоком крови разносится к тканям, где происходит химический процесс высвобождения из нее энергии. Уровень глюкозы в крови настолько важен, что всегда, делая анализ крови, измеряют ее концентрацию, которая называется уровнем сахара в крови, — это индикатор состояния здоровья человека.
Все продукты питания в большем или меньшем количестве содержат углеводы, за исключением тех, которые состоят исключительно из жиров, например масла. Продукты, наиболее богатые глюкозой, — это злаки и их производные, овощи, корнеплоды, фрукты, а также сахар, мед и сладости.
КЛЕТЧАТКА
Целлюлоза (клетчатка) — это сложный углевод, формирующий стенки растительных клеток. У травоядных животных есть пищеварительные ферменты, помогающие переваривать целлюлозу, расщепляя ее на составляющие — молекулы глюкозы, которые всасываются кишечником и используются для пополнения энергетического потенциала. Человеческий организм не вырабатывает ферментов, способных переваривать клетчатку, которую также называют растительными волокнами, выводящимися из нашего организма без изменения. Тем не менее употреблять их очень полезно, и их выведение свидетельствует о хорошей работе толстого кишечника.
Сейчас каждый знает, что ни одно заболевание не проходит без нарушений процессов обмена веществ и, следовательно, нарушений в деятельности ферментов, которая в здоровом организме отличается удивительной согласованностью. У врачей возникла мысль: нельзя ли использовать ускорители химических реакций — ферменты — для предупреждения и лечения болезней. Особенно широко для этих целей стали применяться ферменты, содержащиеся в пищеварительных соках: пепсин, трипсин, химотрипсин.
Для профилактики и лечения используют не только сами ферменты, но и их некоторые небелковые соединения — коферменты. В их состав входят многие известные нам витамины. Достаточно упомянуть о таких витаминах, как В1, витамин В2, никотиновая кислота. Эти и другие коферменты являются наиболее ценными лекарственными веществами в первую очередь потому, что действуют не на признаки болезни, а на ее причины.
Процессы обмена веществ в нашем организме регулируются нервной системой. Естественно поэтому, что и активность ферментов, участвующих в химических превращениях, также зависит от деятельности нервной системы. Наблюдения показывают, что умственное напряжение, волнение, связанное, например, с участием в спортивных соревнованиях, различных конкурсах, сдача экзаменов повышают активность ферментов, расщепляющих белки. А это в свою очередь ведет к тому, что организм начинает расходовать больше белков. Это необходимо учитывать при составлении рациона питания.
Сколько людей мечтает об искусственных питательных веществах в виде небольших таблеток или пилюль, которые бы полностью заменили громоздкую и часто неудобоваримую пищу наших дней. Нельзя ли избавить человека от необходимости потреблять природные пищевые продукы: хлеб, мясо, овощи, фрукты, содержащие не только полезные, но и ненужные, а то и просто вредные вещества, на переваривание которых наш организм затрачивает много энергии.
Но мечты о питательных таблетках, конечно, нереальны. Ближайшие тысячелетия не смогут изменить наше тело, приспособленное на протяжении миллионов лет к сложившимся процессам пищеварения. Однако, создание более удобоваримой пищи — это мечта реальная, она становится явью. Сколько неприятностей доставляет нам жесткое, как подошва, мясо! Но есть чудесный порошок. Достаточно его щепотки, чтобы превратить самый жесткий бифштекс в нежное филе или телятину. Это — препарат фермента папаина, получаемого из плодов культивируемого на юге нашей страны дерева — карика папайя. Не только мясо, но и горох, фасоль, чечевицу можно так размягчить предварительной обработкой ферментом, что на их варку понадобится в 4 раза меньше времени, чем обычно.
Существует много ферментов, которые мы можем уже теперь использовать для предварительной подготовки самых разнообразных пищевых продуктов. В кухне недалекого будущего ферменты призваны сыграть огромную роль. Зная свойства ферментов, человек усилит их действие во много раз. Будут созданы не только фабрики жиров, углеводов, вкусовых и ароматических веществ, но и фабрики-лаборатории, где будут добываться, а впоследствии синтезироваться сами ферменты.
Свойства ферментов.
Белки - это основа жизненных процессов, важнейшая составная часть живого вещества.
Жизнь без этих ускорителей реакций невозможна.
Какими же свойствами обладают ферменты?
Во-первых, их способность резко изменять (обычно в сторону ускорения) темпы химических превращений. Такая высокая активность характерна для биологических катализаторов, действующих в живых организмах
В процессе становления жизни на Земле могли образоваться скопления органических соединений, похожие на известные нам белки. Но процессы в них протекали очень вяло, можно сказать, что жизнь в них едва теплилась. А теперь представьте себе: на кучу тлеющих углей вылили бензин, вспыхнул яркий огонь. Подобным образом действовал на белки и первый фермент. Именно он обеспечил наибольшую скорость химических процессов и сделал белок живым существом любопытное свойство ферментов, как катализаторов, заключается в обратимости химических превращений.
Например, какое-либо вещество распадается, но при определенных условиях продукты этого распада, соединяясь, образуют первичное вещество. Ферменты способствуют не только расщеплению, распаду, но и, наоборот, воссоздают, синтезируют продукты распада в более сложные вещества.
Ферменты очень чувствительны к температуре. Все они - белки, а для белков характерны сильные изменения под действием высокой температуры. Это легко подтвердить примером из повседневной практики, нагревая куриное яйцо. Следует отметить, что нагревание до 40—50 градусов повышает способность ферментов ускорять химические реакции. Дальнейшее нагревание начинает снижать эту активность, а при температуре выше 90 градусов ферменты полностью утрачивают свои каталитические свойства, инактивируются.
Для каждого фермента существует оптимальная температура. В организме теплокровных животных и человека наиболее благоприятной для ферментов является температура тела.
Активность ферментов имеет огромное значение в жизнедеятельности живых организмов. Это легко иллюстрировать на примере растений. Зимой в них как бы замирает жизнь, а весной ферменты делаются все более активными. Ферменты очень тонко реагируют также на степень кислотности среды. Это важное свойство ферментов позволяет понять процесс пищеварения. Пища в полости рта смачивается слюной. Реакция ее почти нейтральная. Наибольшей активностью при такой реакции обладает содержащийся в слюне фермент амилаза. Он действует только на углеводы.
Ферменты называют «ключами» жизни за их чрезвычайно важное свойство: действовать избирательно, специфично, лишь на конкретное вещество. Можно повышать или, напротив, угнетать активность фермента некоторыми химическими, часто очень простыми по составу, веществами. Такие вещества действуют тоже очень специфично. Синильная кислота, например, резко повышает активность фермента папаина, расщепляющего белки, но совершенно парализует дыхательный фермент. Многие ферменты содержатся в тканях и клетках организма в совершенно неактивном состоянии. Это впервые показал И. П. Павлов на примере пищеварения. Пепсин делается активным только после того, как на его пассивную форму — пепсиноген — подействует соляная кислота.
Ферменты широко распространены в живой природе. Они содержатся во всех животных и растительных тканях, первоосновой которых являются белки. Это позволяет предположить, что все белки обладают в той или иной степени ферментативными свойствами.
Главный белок мышц — миозин обладает способностью сокращаться в объеме. Оказалось, что миозин — не только сократимый белок, но одновременно и фермент, который ускоряет химическую' реакцию, необходимую для этого сокращения.
План
1. Брожение лактозы.
2. Коагуляция казеина.
3. Биохимические свойства кисломолочных продуктов.
4. Биотехнология в переработке молока.
Основные биохимические процессы, протекающие при выработке кисломолочных продуктов - это молочнокислое и спиртовое брожение молочного сахара, протеолиз, коагуляция казеина и гелеобразование, в результате которых формируются консистенция, вкус и запах готовых продуктов.
По характеру брожения лактозы кисломолочные продукты принято делить на 2 группы: 1 - продукты, в основе изготовления которых лежит молочнокислое брожение (простокваша, ацидофилин, йогурт, творог, сметана); 2 - продукты со смешанным брожением - кефир, кумыс, курунга и др.
Протеолиз более интенсивно протекает в продуктах второй группы, по сравнению с большинством продуктов первой группы.
Брожение лактозы
При производстве большинства молочных продуктов в молоко или сливки вносят специально подобранные штаммы молочнокислых, пропионовокислых бактерий и дрожжей.
В результате жизнедеятельности микроорганизмов происходит глубокий распад молочного сахара, липидов и белков молока с образованием многочисленных химических соединений.
В основе изготовления целого ряда молочных продуктов лежат процессы глубокого распада молочного сахара под действием микроорганизмов, называемые брожением.
Существует несколько типов брожения лактозы, различающихся составом конечных продуктов.
Начальным этапом всех типов брожения является расщепление молочного сахара на глюкозу и галактозу под влиянием фермента лактазы (b-галактозидазы).
Далее брожению подвергается глюкоза.
Галактоза при участии уридиндифосфатглюкозы переходит в глюкозо-1-фосфат, который после изомеризации в глюкозо-6-фосфат включается в схему превращения глюкозы:
 Галактоза + АТФ галактокиназа галактозо-1-фосфат + АДФ
Галактоза + АТФ галактокиназа галактозо-1-фосфат + АДФ
 Галактозо-1-фосфат + УДФГ галактозо-1-фосфат-уридилилтрансфераза УДФГал + глюкозо-1-фосфат
Галактозо-1-фосфат + УДФГ галактозо-1-фосфат-уридилилтрансфераза УДФГал + глюкозо-1-фосфат
 УДФГал 4-эпимераза УДФГ
УДФГал 4-эпимераза УДФГ
Все типы брожения до образования пировиноградной кислоты идут с получением одних и тех же промежуточных продуктов и по одному и тому же пути - пути Эмбдена-Мейергофа.
Дальнейшие превращения пировиноградной кислоты могут идти в разных направлениях, которые будут определяться специфическими особенностями данного микроорганизма и условиями среды.
Конечными продуктами брожения могут быть молочная, пропионовая, уксусная, масляная кислоты, спирт и другие соединения.
Молочнокислое брожение является основным процессом при изготовлении заквасок, сыра и кисломолочных продуктов, а молочнокислые бактерии - наиболее важной группой микроорганизмов для молочной промышленности.
Молочнокислые бактерии по характеру продуктов сбраживания глюкозы относят к гомоферментативным или гетероферментативным.
Гомоферментативные бактерии образуют главным образом молочную кислоту (более 90%) и лишь незначительное количество побочных продуктов.
Гетероферментативные бактерии около 50% глюкозы превращают в молочную кислоту, а остальное количество - в этиловый спирт, уксусную кислоту и СО2.
Для гомоферментативных бактерий (Str. lactis, Str. cremoris, Str. diacetilactis, Lbm. bulgaricum, Lbm. acidophilum, Lbm. casei) характерным является сбраживание глюкозы по гликолитическому пути Эмбдена-Мейергофа:
C6H12O6 + 2Фн + 2АДФ ® 2C3H6O3 +2АТФ + H2O
Превращение глюкозы в пировиноградную кислоту в результате ряда последовательных реакций происходит при участии 10 ферментов.
Из 1 моль глюкозы образуется 2 моль молочной кислоты с одновременным синтезом 2 моль АТФ.
Гетероферментативные бактерии не могут сбраживать глюкозу по гликолитическому пути, так как у них отсутствует ключевой фермент альдолаза, необходимый для расщепления фруктозо-1,6-дифосфата на две молекулы триозофосфата.
Поэтому Str. citrovorus, Str. paracitrovorus, Lbm. brevis сбраживают глюкозу пентозофосфатным путем:
C6H12O6 + Фн + АДФ ® C3H6O3 + C2H5OH + CO2 +АТФ
В ходе реакций по пентозофосфатному пути из каждого моль глюкозы образуется моль молочной кислоты, моль этанола и CO2.
В аэробных условиях возможно образование двух молекул АТФ, тогда ацетилфосфат превращается не в этанол, а в уксусную кислоту.
Спиртовое брожение глюкозы имеет место при выработке кефира, кумыса, курунги и других кисломолочных продуктов.
Возбудителями спиртового брожения являются дрожжи Sacch. cartilaginosus, Sacch. fragilus, Sacch. cerevisiae и др. Они сбраживают глюкозу с образованием этанола и углекислоты:
C6H12O6 + 2Фн + 2АДФ ® 2C2H5OH + 2CO2 +2АТФ.
Возбудителем пропионовокислого брожения являются пропионовокислые бактерии Propionibacterium, которые превращают глюкозу или молочную кислоту в пропионовую и уксусную кислоты.
Пропионовокислое брожение углеводов и молочной кислоты играет важную роль в процессе созревания твердых сыров с высокой температурой второго нагревания:
3C6H12O6 + 8Фн + 8АДФ ® 4CH3CH2COOH + 2CH3COOH + 2CO2 + 2H2O + 8АТФ.
Маслянокислое брожение происходит в молочных продуктах под действием маслянокислых бактерий (Cl. butyricum и др.), сбраживающих как глюкозу, так и молочную кислоту.
Известно несколько типов маслянокислого брожения, различающихся образующимися продуктами. Например:
2C6H12O6 + 2H2O + 7Фн + 7АДФ ® CH3CH2CH2COOH + 2CH3COOH + 4CO2 + 6H2 + 7АТФ.
При других типах маслянокислого брожения наблюдается образование бутилового и изопропилового спиртов, этанола, ацетона.
Маслянокислое брожение является причиной порчи кисломолочных продуктов и является нежелательным процессом в молочной промышленности.
Коагуляция казеина
Важнейшими процессами, происходящими при выработке кисломолочных продуктов, являются коагуляция казеина и гелеобразование (переход коллоидной системы молока из свободнодисперсного состояния, золя, в связаннодисперсное состояние - гель).
Коагуляция казеина при производстве кисломолочных продуктов может осуществляться двумя способами - кислотным или сычужным.
Кислотная коагуляция казеина вызывается молочной кислотой, которая накапливается в молочных продуктах в результате брожения лактозы. Молочная кислота снижает отрицательный заряд мицелл казеина и переводит его в изоэлектрическое состояние (рН 4,6-4,7), в котором макромолекулы белка теряют свою растворимость и устойчивость. Кроме того, происходит переход в плазму фосфата кальция и органического кальция казеинаткальцийфосфатного комплекса, что дестабилизирует мицеллы казеина и вызывает их диспергирование.
Сычужная коагуляция казеина включает 2 стадии - ферментативную и коагуляционную. Механизм как первой, так и второй стадии окончательно не установлен. Наиболее убедительной считается теория протеолитического действия сычужного фермента (гидролитическая теория). Согласно этой теории, на первой стадии под действием основного компонента сычужного фермента химозина происходит разрыв пептидной связи фенилаланин-метионин в полипептидных цепях k-казеина ККФК, в результате чего молекулы k-казеина расщепляются на гидрофобный пара-k-казеин и гидрофильный гликомакропротеид. Гидратная оболочка мицелл частично разрушается, силы электростатического отталкивания между частицами уменьшаются и дисперсная система теряет устойчивость. На второй стадии частично дестабилизированные мицеллы казеина (параказеина) собираются в агрегаты, которые затем соединяются продольными и поперечными связями в единую сетку, образуя сгусток.
Процесс гелеобразования - агрегирование частиц казеина и формирование единой пространственной сетки молочного сгустка.
Независимо от способа коагуляции, различают 4 стадии формирования сгустка:
1 - индукционный период;
2 - сдадия флоккуляции - массовая коагуляция;
3 - стадия метастабильного равновесия - уплотнение сгустка;
4 - стадия синерезиса - самопроизвольное уплотнение структуры за счет перегруппировки частиц и увеличения числа контактов между ними, т.е. сжатие геля и выпрессовывание из него дисперсионной среды.
При структурообразовании дисперсных систем могут образовываться два типа пространственных структур - коагуляционные (тиксотропно-обратимые) и конденсационные (необратимо-разрушающиеся). Коагуляционные структуры обладают эластичностью, пластичностью и малой прочностью, так как частицы удерживаются только межмолекулярными силами. В конденсационных структурах частицы соединены прочными химическими связями, которые обеспечивают их прочность, но делают их хрупкими, неэластичными.
Сгустки кисломолочных продуктов имеют, как правило, смешанный характер с преобладанием необратимо-разрушающихся либо тиксотропно-обратимых связей. Соотношение этих связей зависит от целого ряда факторов, правильное использование которых позволяет получать сгустки с заданными свойствами.
Таблица 1-1. Классификация основных аминокислот белков по их химическому строению

Таблица 1-2. Примеры названий аминокислот по заместительной номенклатуре и соответствующие тривиальные названия
| Название аминокислоты по заместительной номенклатуре
| Формула аминокислоты
| Тривиальное название
|
| 2-амино-З-гидроксипропановая кислота
| 
| Серии
|
| 2-амино-4-метилтиомасляная кислота
| 
| Метионин
|
Для записи аминокислотных остатков в молекулах пептидов и белков используют трёхбуквенные сокращения их тривиальных названий, а в некоторых случаях и однобуквенные символы (см. табл. 1-1).
Тривиальные названия часто происходят от названия источника, из которого они впервые были выделены, или от свойств данной аминокислоты. Так, серии впервые был выделен из фиброина шёлка (от лат. serieum - шелковистый), а глицин получил свое название из-за сладкого вкуса (от греч. glykos - сладкий).
3. Классификация аминокислот
по растворимости их радикалов в воде
Все 20 аминокислот в белках организма человека можно сгруппировать по способности их радикалов растворяться в воде. Радикалы можно выстроить в непрерывный ряд, начинающийся полностью гидрофобными и заканчивающийся сильно гидрофильными.
Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные её отталкивают).
Аминокислоты с неполярными радикалами
К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается.







 Галактоза + АТФ галактокиназа галактозо-1-фосфат + АДФ
Галактоза + АТФ галактокиназа галактозо-1-фосфат + АДФ Галактозо-1-фосфат + УДФГ галактозо-1-фосфат-уридилилтрансфераза УДФГал + глюкозо-1-фосфат
Галактозо-1-фосфат + УДФГ галактозо-1-фосфат-уридилилтрансфераза УДФГал + глюкозо-1-фосфат УДФГал 4-эпимераза УДФГ
УДФГал 4-эпимераза УДФГ


