В 3 пробирки внести по 3 капли раствора хлорида железа (III). Одну оставить в качестве контрольной. В две другие добавить по 3 капли раствора щелочи. К образовавшемуся осадку в одну из них добавить 12 – 15 капель щавелевой кислоты HOOC–COOH (Сэкв = 2,0 моль(экв)/л), в другую – столько же лимонной кислоты (Сэкв = 2,0 моль(экв)/л)
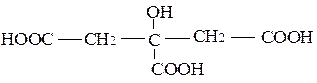 .
.
В обе пробирки и в контрольную внести 1 – 2 капли раствора тиоцианата калия или аммония (Сэкв = 0,01 моль(экв)/л), который образует с ионами Fe3+ ярко окрашенный тиоцианат железа Fe(SCN)3. Во всех ли пробирках наблюдается окрашивание?
При растворении гидроксида железа (III) в щавелевой и лимонной кислотах образуются внутрикомплексные соединения, в которых карбоксильные группы кислот присоединяются к комплексообразователю. Для щавелевокислого комплекса формула имеет вид:
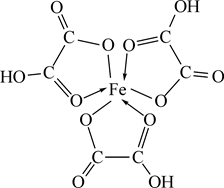
Моно- или полидентатным лигандом является остаток щавелевой кислоты? Написать аналогичную формулу лимоннокислого (цитратного) комплекса. Обратить внимание на особую прочность внутрикомплексных соединений.
Опыт 6. комплексные соединения в реакциях обмена
В пробирку к 4 – 5 каплям раствора сульфата меди добавить такой же объем раствора комплексной соли K4[Fe(CN)6]. Отметить цвет образовавшегося осадка гексацианоферрата меди. Написать молекулярное и ионное уравнения реакции.
Опыт 7. комплексные соединения
В окислительно-восстановительных реакциях
а) Восстановление серебра из его комплексного соединения
Добавить в пробирку к 5 – 6 каплям раствора нитрата серебра раствор хлорида натрия. Полученный осадок растворить в 25%-ном растворе аммиака. Опустить в раствор кусочек гранулированного цинка. Что наблюдается?
Написать уравнения: получения осадка хлорида серебра, его растворения в аммиаке с образованием комплекса серебра и взаимодействия полученного комплексного соединения с цинком. Какой ион является окислителем в последней реакции? Написать уравнение электролитической диссоциации комплексного иона и ионное уравнение окислительно-восстановительной реакции.
б) Восстановление гексацианоферрата (III) калия
В пробирку внести 8 – 10 капель раствора иодида калия (Сэкв = 0,10 моль(экв)/л), 6 – 8 капель раствора соляной кислоты (Сэкв = 2,0 моль(экв)/л) и 5 – 6 капель бензола. Отметить, что бензол остается бесцветным. Добавить один микрошпатель кристаллов комплексной соли железа (III) K3[Fe(CN)6] и перемешать раствор стеклянной палочкой. По изменению окраски бензола убедиться в выделении свободного иода.
Написать уравнение реакции взаимодействия гексацианоферрата (III) калия с иодидом калия, учитывая, что K3[Fe(CN)6] переходит при этом в K4[Fe(CN)6]. (Соляную кислоту в уравнение реакции не вводить). Указать окислитель и восстановитель.
в) Окисление гексацианоферрата (II) калия
Поместить в пробирку 4 – 5 капель раствора перманганата калия, подкислить раствором серной кислотой (Сэкв = 2,0 моль(экв)/л) и добавить по каплям раствор гексацианоферрата (II) калия до обесцвечивания раствора.
Написать уравнение реакции, учитывая, что комплекс железа (II) переходит в комплекс железа (III) с тем же координационным числом, а перманганат калия в кислой среде восстанавливается до сульфата марганца (II).
Опыт 8. прочность комплексных ионов.
Разрушение комплексов
а) Разрушение комплекса при разбавлении раствора
Внести в пробирку 2 капли раствора нитрата серебра AgNO3 и добавлять раствор иодида калия KCl (Сэкв = 0,10 моль(экв)/л) по каплям, встряхивая пробирку после каждого добавления.
Почему растворяется выпавший вначале осадок иодида серебра? К получившемуся раствору добавить 4 – 5 капель воды. Что наблюдается?
Описать наблюдаемые процессы. Написать уравнения реакций: образования иодида серебра, его перехода в комплексное соединение, диссоциации комплексного иона, выражение константы нестойкости. Какое влияние оказывает добавление раствора на диссоциацию комплексного иона?
б) Получение аммиакатов.
Налить в пробирку 1 – 2 мл раствора AgNO3 и добавить немного раствора NaCl. К образовавшемуся осадку приливать раствор аммиака до его растворения. Составить уравнения реакций, учитывая, что координационное число равно двум. Объяснить происходящие изменения.
Полученный раствор разлить в четыре пробирки и использовать в опытах б), в), д).
в) Разрушение комплекса при замене комплексообразователя.
Налить в пробирку 1 – 2 мл раствора [Ag(NH3)2]Cl, полученного в опыте 3 а), и добавить туда кусочек цинка. Что наблюдаете? Записать уравнение реакции образование комплексного аммиаката цинка, учитывая, что координационное число Zn2+ равно четырем.
Объяснить, пользуясь таблицей констант нестойкости комплексных ионов, причину вытеснения цинком серебра из его аммиачного комплексного иона.
г) Качественные реакции на ион серебра.
Налить в две пробирки одинаковые объемы раствора AgNO3. В одну из них добавить раствор NaOH, а в другую – KI. Записать наблюдения.
Эти реакции характерны для иона Ag+ и могут быть использованы для его обнаружения. Составить уравнения реакций.
Раствор [Ag(NH3)2]Cl, полученный в опыте 3 а), налить по 1 мл в две пробирки. В одну пробирку прилить раствор NaOH, а в другую – KI. Что происходит? Написать уравнение диссоциации комплексного иона [Ag(NH3)2]+ и выражение его константы нестойкости. Дать объяснение наблюдаемым явлениям, пользуясь уравнением диссоциации комплексного иона и правилом произведения растворимости.
д) Получение тиосульфатного комплекса серебра.
Получить в пробирке осадок AgCl. Затем добавлять раствор Na2S2O3 (Сэкв = 1,0 моль(экв)/л) до полного растворения осадка. Написать уравнение реакции образования Na3[Ag(S2O3)2].
К полученному раствору комплексного соединения
е) Сравнительная устойчивость тиоцианатного комплекса кобальта в воде и в спирте
Получить в пробирке тетратиоцианатокобальтат (II) аммония (NH4)2[Co(SCN)4], добавляя к 7 – 8 каплям насыщенного раствора хлорида кобальта (II) равный объем насыщенного раствора тиоцианата аммония. Наблюдать появление ярко-синей окраски комплексного соединения. Разделить раствор на 2 пробирки; в одну из них добавить амиловый спирт, в другую – 10 капель воды. Как изменяется окраска в каждой пробирке?
Написать уравнения реакций; образования комплексного соединения, его диссоциации и диссоциации комплексного иона. В воде или в спирте диссоциация комплексного иона протекает полнее? Чем это объясняется?
ж) Разрушение комплекса при осаждении комплексообразователя
В две пробирки с раствором сульфата меди добавить: в одну раствор оксалата аммония, в другую – сульфида аммония. Написать уравнения реакций и отметить цвета выпавших осадков. В двух других пробирках получить комплексное соединение меди, добавив к 4 – 5 каплям раствора CuSO4 (Сэкв = 1,0 моль(экв)/л) раствор аммиака до растворения выпадающего вначале осадка основной соли меди. Отметить цвет полученного комплексного соединения. Написать уравнение реакции взаимодействия сульфата меди с аммиаком, учитывая, что координационное число меди равно четырем.
Испытать действие растворов оксалата аммония и сульфида аммония на полученный раствор комплексной соли меди. От действия какого реактива выпадает осадок? На присутствие каких ионов в растворе комплексной соли указывает появление этого осадка? Добавить в пробирку, где выпал осадок, еще 6 – 7 капель того же реактива и для ускорения коагуляции осторожно нагреть. Сохранилась ли в растворе окраска комплекса меди?
Описать наблюдаемые явления. Ответить на поставленные по ходу работы вопросы. Написать уравнения проделанных реакций, уравнение электролитической диссоциации комплексной соли меди и ее комплексного иона. Как влияет добавление (NH4)2S на диссоциацию комплексного иона? Почему при добавлении оксалата аммония осадок не выпадает? Сравнить по табл. произведение растворимости соответствующих солей меди.
Опыт 9. двойные соли
В трех пробирках приготовить раствор двойной соли (NH4)2SO4 · FeSO4 · 6H2O (соли Мора), внеся в каждую по 6 – 8 капель воды и по одному микрошпателю соли. В одну пробирку к раствору соли Мора добавить 5 – 6 капель раствора сульфида аммония, в другую – столько же раствора хлорида бария. Выпавший черный осадок представляет собой сульфид железа (II). Отметить цвет осадков и написать ионные уравнения реакций их образования. На присутствие каких ионов в растворе двойной соли указывают эти реакции?
В третью пробирку добавить 7 – 8 капель раствора едкого натра (Сэкв = 2,0 моль(экв)/л) и, укрепив в штативе, опустить ее в водяную баню, нагретую почти до кипения. Подержать над пробиркой красную лакмусовую бумажку, смоченную водой. По изменению окраски лакмуса и по запаху определить, какой газ выделяется из пробирки. Написать ионное уравнение реакции его образования. На присутствие каких ионов в растворе двойной соли указывает эта реакция?
Учитывая результаты опыта, написать уравнение электролитической диссоциации соли Мора.
Проверить действием раствора сульфида аммония, обнаруживаются ли ионы Fe2+ в растворе K4[Fe(CN)6]. Наблюдается ли выпадение черного осадка FeS? Почему?
Описать наблюдаемые явления. Ответить на вопросы, поставленные по ходу работы, и написать уравнения соответствующих реакций. Написать уравнение электролитической диссоциации K4[Fe(CN)6]. Чем отличается электролитическая диссоциация двойной соли от диссоциации соли, содержащей устойчивый комплексный ион?



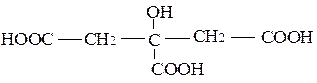 .
.

