Клетки-мишени распознают сигнальные молекулы, или первичные мессенджеры, с помощью специальных молекулярных структур — рецепторов, имеющих белковую природу. В механизме распознавания сигналов существенное значение имеет конформационное соответствие молекул лиганда и рецептора, которые «подходят» друг к другу так же, как ключ подходит к замку. Присоединение лиганда к рецептору ведет к аллостерическому изменению конформации рецепторного белка (процесс, называемый активацией рецептора), в результате чего изменяется функциональная активность рецептора.
Как правило, рецепторы способны связываться не только с эндогенными лигандами, но и с другими структурно сходными молекулами. Это позволяет использовать экзогенные вещества, взаимодействующие с рецепторами и изменяющие их состояние, в качестве лекарственных препаратов. В настоящее время более 60 % лекарственных средств, применяемых для лечения больных людей, действуют на сигнальные системы клетки.
Все рецепторы по их локализации в клетке подразделяются на две большие группы: внутриклеточные рецепторы и рецепторы, расположенные в плазматической мембране.
Внутриклеточные рецепторы располагаются в цитоплазме или в ядре клетки. Неактивные рецепторы обычно находятся в составе комплексов с другими белками — шаперонами, и лишь после связывания лиганда рецептором лиганд-рецепторный комплекс освобождается от указанных белков и активируется. Химическими сигналами для внутриклеточных рецепторов служат молекулы, которые переносятся через плазматическую мембрану путем простой диффузии. К ним, например, относятся стероидные гормоны, гормоны щитовидной железы и простагландины. Важная особенность работы внутриклеточных рецепторов заключается в том, что они не только распознают и связывают сигнальные молекулы, но и сами участвуют в передаче сигнала, выполняя при этом, как правило, функцию транскрипционных факторов (рис. 5.4).

Рецепторы, расположенные в плазматической мембране (их называют также рецепторами клеточной поверхности), относятся к интегральным мембранным белкам. Рецепторы клеточной поверхности взаимодействуют с разнообразными сигнальными молекулами, общим признаком которых служит гидрофильность и, следовательно, невозможность прямого переноса через липидный бислой плазматической мембраны внутрь клетки. Выделяют три главных типа рецепторов клеточной поверхности: рецепторы ионных каналов, рецепторы, сопряженные с G-белками, и каталитические рецепторы.
Рецепторы ионных каналов представляют собой регулируемые лигандами ионные каналы, которые располагаются в мембране постсинаптической клетки и участвуют в синаптической передаче сигналов между электрически возбудимыми клетками. Обычно такие рецепторы состоят из нескольких субъединиц, пронизывающих всю толщу плазматической мембраны. Специфические сигнальные молекулы, связываясь с белком-рецептором, изменяют его конформацию, в результате чего ионные каналы открываются или закрываются (рис. 5.5).

Хорошей иллюстрацией работы рецепторов ионных каналов служит функционирование никотинового ацетилхолинового рецептора, расположенного в мембране мышечного волокна в области нервно-мышечного синапса. В открытом состоянии этот канал проницаем для различных катионов (Na+, К+, Са2+) и непроницаем для анионов. Проведение электрического импульса в нервной клетке приводит к освобождению ацетилхолина из ее нервных окончаний в синаптическую щель. После связывания ацетилхолина с рецептором ионный канал рецепторного белка сразу же открывается, что сопровождается значительным притоком положительно заряженных ионов, преимущественно катионов Na+, внутрь мышечной клетки. Это вызывает деполяризацию мембраны мышечной клетки и ее сокращение. Для того чтобы сокращения мышечной клетки могли успешно регулироваться сигналами, поступающими от нервной клетки, ацетилхолин быстро удаляется из синаптической щели. Это достигается за счет диффузии ацетилхолина из синаптической щели в окружающее межклеточное пространство, а также посредством расщепления медиатора, находящегося в синаптической щели, ферментом ацетилхолинэстеразой на ацетат и холин. Таким образом, механизм синаптической передачи сигналов между электрически возбудимыми клетками с помощью рецепторов ионных каналов заключается в преобразовании ими химических сигналов в электрические. Процесс передачи сигнала от рецепторов ионных каналов (их также называют ионотропными рецепторами) отличается большой скоростью и длится менее миллисекунды.
Рецепторы, сопряженные с G-белками, относятся к одному из наиболее распространенных типов клеточных рецепторов и функционируют в тесной кооперации с регуляторными G-белками. G-белки названы так, поскольку в своем сигнальном механизме они используют замену ГДФ на ГТФ как молекулярный функциональный «выключатель» для регулировки клеточных процессов. Они встречаются у всех представителей эукариот и отличаются широкой функциональной специализацией. Например, в организме человека с ними взаимодействуют нейромедиаторы, гормоны, факторы роста и другие биологически активные соединения. Указанные рецепторы входят также в состав зрительного, обонятельного и вкусового анализаторов. Однако, несмотря на большое функциональное разнообразие рецепторов, сопряженных с G-белками, все они имеют сходную структуру (рис. 5.6).

Типичный рецептор представляет собой интегральный белок, который состоит из одной полипептидной цепи, пронизывающей липидный бислой плазматической мембраны семь раз. Такие белки называют «серпантинными». N-концевой участок полипептидной цепи рецептора находится на наружной стороне мембраны, а домен, содержащий карбоксильную группу, — на внутренней.
Рецепторы, сопряженные с G-белками, чаще всего передают сигнал путем активации или инактивации определенных ферментов (например, аденилат-циклазы, фосфолипазы С) или ионных каналов, связанных с плазматической мембраной. При этом взаимодействие между рецептором и ферментом или ионным каналом осуществляется не прямым путем, а опосредованно через регуляторные белки, которые получили название гуанилат-связывающих регуляторных белков, или G-белков. Указанные белки состоят их трех субъединиц (Gγ Gγ Gα), имеют центры связывания гуаниловых нуклеотидов — гуанозиндифосфата (ГДФ) и гуанозинтрифосфата (ГТФ), обладают собственной фосфатазной активностью, позволяющей им гидролизовать ГТФ до ГДФ. Благодаря этому они способны функционировать как «выключатели». Если с G-белком связан ГТФ, то это соответствует его активированному состоянию (G — ГТФ), то есть положению «включено». Если в нуклеотид-связывающем центре G-белка присутствует ГДФ, то такая его форма (G—ГДФ) неактивна, что соответствует положению «выключено».
Рецепция и инициация проведения сигнала с участием рецепторов, сопряженных с G-белками, осуществляется следующим образом (рис. 5.7).

Сигнальная молекула, например гормон, связываясь с рецептором, индуцирует его активацию (этап I). Активированный рецептор вызывает изменение конформации G-белка, обмен ГДФ, связанного с G-белком, на присутствующий в среде ГТФ и диссоциацию субъединиц G-белка (этапы II—III). После этого активированная α-субъединица (альфа-субъединица) G-белка диффундирует в плоскости плазматической мембраны и, взаимодействуя с ферментом, активирует его (этап IV). Спустя некоторое время, благодаря собственной гуанозинфосфатазной активности G-белка, связанный с указанным белком ГТФ гидролизуется до ГДФ. В результате α-субъединица G-белка становится неактивной, отделяется от фермента и связывается с другими субъединицами G-белка с образованием его исходной тримерной неактивной структуры (этап V).
Рецепторы и сопряженные с ними G-белки могут не только активировать соответствующие ферменты, но и инактивировать их. Сопряжение рецептора с G-белком позволяет не только усиливать передаваемый сигнал, так как одна молекула G-белка способна активировать или инактивировать много молекул фермента, но и осуществлять тонкую регуляцию работы рецептора.
Каталитические рецепторы в отличие от рецепторов, сопряженных с G-белками, обладают собственной ферментативной активностью. К наиболее изученным каталитическим рецепторам относятся тирозинкиназные рецепторы (рис. 5.8).
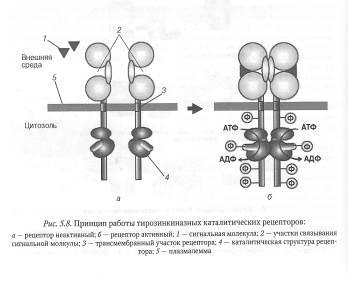
Каталитический домен таких рецепторов располагается с внутренней стороны цитоплазматической мембраны и функционирует как тирозинкиназа — фермент, который переносит фосфатные группы от АТФ на гидроксильную группу тирозиновых остатков белков. В неактивном состоянии тирозинкиназный рецептор обычно состоит из двух отдельных полипептидных цепей, имеющих сходное строение, цитоплазматические домены которых обладают ферментативной активностью. Связывание сигнальной молекулы, например фактора роста, с рецептором вызывает агрегацию двух полипептидных цепей с образованием димерного белка.
Одновременно с этим осуществляется перекрестное автофосфорилирование тирозиновых остатков цитоплазматических доменов рецепторного белка и его активация. Сигнальные системы с участием тирозинкиназных рецепторов играют большую роль в регуляции метаболизма, роста, деления и дифференцировки клеток. Например, в организме человека с тирозинкиназными рецепторами связываются многочисленные факторы роста, гормон инсулин, цитокины и другие биологически активные соединения.
Передача сигнала от рецепторов клеточной поверхности
К эффекторным молекулам
Передача сигнала от рецепторов клеточной поверхности, как правило, осуществляется с участием нескольких релейных белковых молекул, составляющих основу сигнал-передающих путей. В многоступенчатом процессе передачи сигнала активированный рецептор изменяет конформацию и биологическую активность взаимодействующих с ним белков-посредников, и далее сигнал, подобно падающему домино, передается другим релейным молекулам, последовательно активируя их и достигая, в конце концов, эффекторных белков, реализующих ответную реакцию клетки. Таким образом, передача сигнала от рецепторов клеточной поверхности к эффекторным молекулам включает цепь молекулярных взаимодействий релейных белковых молекул, которые сопровождаются специфическими изменениями их конформации и биологической активности.
Многие релейные белки, участвующие в проведении сигнала от рецепторов клеточной поверхности к эффекторным белкам, представляют собой протеинкиназы — ферменты, которые переносят фосфатную группу от молекул АТФ на другие белковые молекулы, в результате чего биологическая активность фосфорилированных белков изменяется. Цитоплазматические протеинкиназы, участвующие в передаче сигнала в клетке, отличаются высокой специфичностью по отношению к своему субстрату, благодаря чему достигается «адресное» фосфорилирование только определенных белков. Часто в процессе передачи сигнала после фосфорилирования и активации одной протеинкиназы следуют повторяющиеся друг за другом реакции фосфорилирования других протеинкиназ, что приводит к образованию каскада реакций фосфорилирования (рис. 5.9).
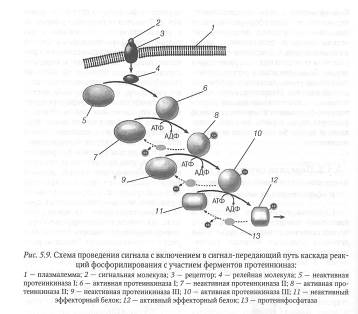
Наличие каскадов реакций фосфорилирования с участием митогенактивируемых протеинкиназ характерно для многих сигнальных систем, контролирующих про- лиферативную активность клеток. Наряду с протеинкиназами большую роль в передаче сигналов играют ферменты протеинфосфатазы, которые быстро удаляют фосфатные группы от белков. Этот процесс получил название дефосфорилирования. За счет дефосфорилирования протеинфосфатазами белков, ранее фосфорилированных протеинкиназами, достигается переход их из активного в исходное неактивное состояние, что делает возможным проведение нового сигнала от рецептора. Таким образом, в каждый данный момент активность релейных белков, регулируемых фосфорилированием, зависит от баланса активности ферментов протеинкиназ и протеинфосфатаз. Благодаря этому система, обеспечивающая фосфорилирование и дефосфорилирование белков в клетке, действует как «молекулярный выключатель», который активирует или инактивирует релейные белки, участвующие в проведении сигнала.
Каскад реакций фософорилирования с участием митогенактивируемых протеинкиназ характерен для сигнальных путей, идущих от тирозинкиназных рецепторов, с которыми связываются разнообразные факторы роста (рис. 5.10).
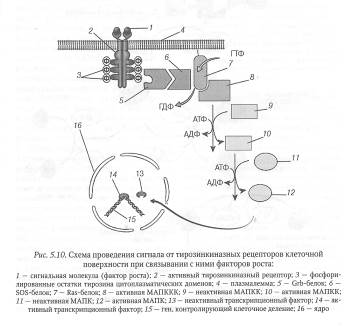
В передачу сигнала в таких сигнальных системах, кроме митогенактивируемых протеинкиназ (МАПК), вовлекаются так называемые Ras-белки. Ras-белки — продукты онкогена ras, впервые идентифицированного в саркоме крысы (от англ. rat sarcomas). Указанный белок представляет собой мономерную ГТФазу, связанную с внутренней стороной цитоплазматической мембраны. Подобно G-белкам, Ras-белок может находиться в активной и неактивной формах. В активной форме с Ras-белком связан ГТФ, в неактивной — ГДФ. Функциональное состояние Ras-белка регулируется двумя белками. Один из них, получивший название SOS-белка (фактор, высвобождающий гуаниловые нуклеотиды), при взаимодействии с Ras-белком стимулирует замещение в нем ГДФ на ГТФ, в результате чего Ras-белок активируется. Второй белок, называемый Grb-белок (от англ. growth factor receptor bound), при взаимодействии с Ras-белком усиливает его гуанозинфосфатазную активность и тем самым способствует переходу Ras-белка в неактивную форму, в которой он находится в обычных условиях.
Связывание фактора роста с тирозинкиназным рецептором вызывает автофосфорилирование тирозинкиназного домена рецепторного белка и его активацию. В результате рецептор присоединяет специфический адапторный Grb-белок и активирует SOS-белок, который стимулирует замену в Ras-белке ГДФ на ГТФ. Активированный Ras-белок инициирует каскад реакций фосфорилирования с участием цитоплазматических митогенактивируемых протеинкиназ (киназа киназы митогенактивируемой протеинкиназы — МАПККК; киназа митогенактивируемой протеинкиназы - МАПКК; митогенактивируемая протеинкиназа — МАПК), результатом чего служит изменение экспрессии генов, контролирующих клеточную пролиферацию.
Указанный механизм регуляции деления клеток действует у организмов, находящихся на разных уровнях организации (червей, насекомых, млекопитающих и др.).
Во многих сигнальных путях, идущих от рецепторов клеточной поверхности, в проведении сигнала, наряду с белками, участвуют малые небелковые молекулы и ионы, которые получили название вторичных посредников или вторичных мессенджеров. Эти молекулы, благодаря своим малым размерам и хорошей растворимости в воде, быстро диффундируют в цитоплазме клетки и действуют как аллостерические эффекторы — присоединяясь к определенным белкам, изменяют их конформацию и биологическую активность. К наиболее распространеным вторичным посредникам относятся циклический аденозин монофосфат (цАМФ) и ионы Са2+
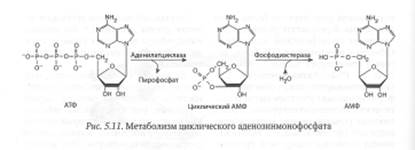
Циклический аденозин монофосфат в клетках животных и человека синтезируется из АТФ ферментом аденилатциклазой, связанным с плазматической мембраной клетки, и быстро расщепляется цАМФ-фосфодиэстеразами до аденозин-5'-монофосфата (рис. 5.11).
Процесс проведения сигнала с участием цАМФ лучше всего изучен при действии адреналина на клетки печени животных и человека (рис. 5.12).
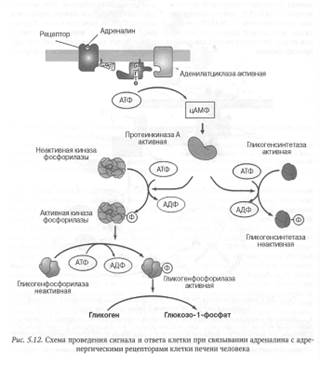
Связывание адреналина с рецептором, сопряженным с G-белком, активирует фермент аденилатциклазу. Этот фермент превращает аденозин трифос- фат (АТФ) в циклический аденозин-монофосфат, или цАМФ. В результате концентрация цАМФ в клетке быстро возрастает. Образовавшийся цАМФ активирует протеинкиназу А, которая фосфорилирует другой фермент - киназу фосфорилазы. Киназа фосфорилазы в свою очередь фосфорилирует и тем самым активирует фермент гликогенфосфорилазу, катализирующий реакцию деполимеризации гликогена с образованием глюкозо-1-фосфата. Активированная протеинкиназа А фосфорилирует также фермент гликогенсинтетазу, катализирующий последний этап в реакциях синтеза гликогена из глюкозы. Это приводит к потере активности указанного фермента и к прекращению синтеза гликогена. В отсутствие гормона концентрация цАМФ в клетке быстро снижается, так как этот циклический нуклеотид под действием фермента фосфодиэстеразы превращается в аденозинмонофосфат — соединение, лишенное какой-либо биологической активности.
Таким образом, действие адреналина на мышечные клетки сопровождается одновременно как усилением распада, так и прекращением синтеза гликогена, что способствует максимальной мобилизации энергетических ресурсов организма в условиях стресса.
Ионы Са2+ в качестве вторичных посредников в сигнальных системах используются даже чаще, чем цАМФ. В обычных условиях концентрация указанных ионов в цитозоле клетки примерно в 10 000 раз меньше, чем в окружающей клетку среде. Столь низкая концентрация ионов Са2+ в цитозоле связана с активным транспортом их Са2+-насосами из цитозоля в окружающую среду, а также в полость эндоплазматического ретикулума и матрикс митохондрий (рис. 5.13).

Другая важная особенность ионов Са2+ как вторичных посредников связана со способностью указанных ионов связываться с различными внутриклеточными белками и изменять их биологическую активность. Благодаря этому ионы Са2+ участвуют в регуляции самых разнообразных проявлений клеточной активности: метаболизма, секреции, пролиферации и др.
В сигнальных системах, в которых в качестве вторичного посредника используются ионы Са2+, в механизме проведения сигнала участвуют два других посредника: инозитолтрифосфат и диацилглицерол (рис. 5.14).
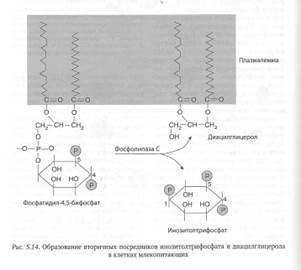
В клетках животных эти посредники образуются из мембранного липида фосфатидилинозитол-4,5-дифосфата под действием фермента фосфолипазы С, связанного с плазмалеммой клетки.
В общей форме механизм проведения сигнала от рецепторов клеточной поверхности с участием ионов кальция осуществляется по определенной схеме (рис. 5.15).

Взаимодействие сигнальной молекулы с поверхностным рецептором приводит к активации фермента фосфолипазы С, связанного с плазмалеммой клетки. В результате этого расположенный во внутреннем слое цитоплазматической мембраны фосфатидилинозитол-4,5-дифосфат под действием фосфолипазы С гидролизуется с образованием двух вторичных посредников: инозитолтрифосфата и диацилглицерола, и далее путь передачи сигнала разделяется на две ветви.
Инозитолтрифосфат быстро диффундирует из мембраны в цитоплазму и связывается с кальциевыми каналами, встроенными в мембрану эндоплазматического ретикулума. В результате кальциевые каналы открываются, и ионы Са2+ по градиенту концентрации выходят из полости эндоплазматиче- ского ретикулума в цитозоль. Увеличение концентрации ионов Са2+ в цитозоле и их связывание с Са2+-связывающими белками инициирует многие ответные реакции клеток: секрецию, клеточное деление, мышечное сокращение и др.
После освобождения рецептора от сигнальной молекулы инозитолтрифос- фат, связанный с кальциевыми каналами эндоплазматического ретикулума, дефосфорилируется цитоплазматическими фосфатазами и отсоединяется от ионных каналов, в результате чего они закрываются. Имеющийся в цитозоле избыток ионов Са2+, как отмечалось выше, удаляется из него с помощью АТФ-зависимых Са2+-насосов, встроенных в мембрану эндоплазматического ретикулума и плазмалеммы. Благодаря указанным механизмам, активность инозитолтрифосфата и высокая концентрация ионов Са2+ сохраняются в клетке лишь в течение короткого времени, необходимого для проведения сигнала.
Диацилглицерол, образующийся в результате гидролиза фосфатидилинозитол-4,5-дифосфата, в отличие от инозитолтрифосфата, сохраняет связь с плазмалеммой и потенциально способен выполнять две функции. Одна из них связана с распадом диацилглицерола под действием ферментов с образованием арахидоновой кислоты, необходимой для синтеза простагландинов и других эйкозаноидов, инициирующих многие ответные реакции клетки. Вторая функция диацилглицерола заключается в активации в присутствии ионов Са2+ фермента протеинкиназы С, который участвует в регуляции многих клеточных процессов: деления, секреции, транспорта и др.
Механизм проведения сигнала от поверхностных рецепторов, реализуемый несколькими релейными молекулами, обеспечивает более совершенную регуляцию ответных реакций клеток на действие различных сигнальных молекул, чем простая передача сигнала без посредников. Благодаря указанному механизму достигается значительное усиление сигнала и, следовательно, ответной реакции клетки. Это обусловлено тем, что на каждом последующем этапе на пути передачи сигнала активируется значительно больше молекул-посредников, чем на предыдущем.
Например, связывание одной молекулы адреналина с рецептором клетки печени приводит к образованию в ней нескольких миллионов молекул глюкозо-1-фосфата. Наличие нескольких релейных молекул, вовлеченных в передачу сигнала, обеспечивает возможность взаимодействия сигналов, идущих от разных рецепторов (рис. 5.16),
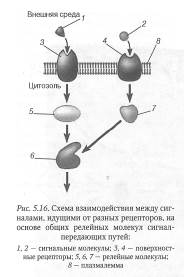

а также «ветвления» сигнальных путей, идущих от одного рецептора (рис. 5.17), и, как следствие этого, формирования нескольких ответных реакций клетки на действие одного и того же сигнала.



















