Эквивалентное соотношение означает одинаковое число моль эквивалентов. Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково.
Эквивалент элемента – это такое его количество, которое соединяется с 1 молем водорода или замещает то же количество атомов водорода в химических реакциях.

Фактор эквивалентности- ƒэкв.(х) или 1/Z число, показывающее, какая реальная частица вещества Х эквивалентна одному иону водорода в данной обменной реакции или одному электрону в данной окислительно-восстановительной реакции.
ƒэкв рассчитывают на основании стехиометрических коэффициентов реакции.
Для разных классов химических соединений существуют соответствующие формулы расчета фактора эквивалентности.
Например, для элемента он рассчитывается так: 1/В, где В – валентность элемента в том или ином соединении. Вот, например, основной оксид хрома – Cr2O3. В этом соединении хром имеет валентность, равную 3. Следовательно, его ƒэкв (фактор эквивалентности) равен 1/3. А в бихромате калия, имеющий формулу K2Cr2O7, уже валентность хрома равна 6, следовательно, его ƒэкв будет составлять 1/6.
Если речь идет о простом веществе, то есть таком, молекулы которого состоят из атомов только одного элемента, то его фактор эквивалентности вычисляется по формуле 1/В*N, где В – валентность элемента, а N – количество его атомов в молекуле. Легко можно увидеть, что, например, кислород и озон, хоть в их состав входит только один элемент, будут иметь разные ƒэкв. У кислорода, имеющего формулу молекулы О2, он будет равен 1/4, а у озона с формулой О3, соответственно, 1/6.
Для оксидов: ƒэкв равен единице, деленной на произведение числа атомов кислорода на степень окисления кислорода
ƒэкв (H2O) = 1/Z (H2O) = 1/2
ƒэкв (SO2) = 1/Z (SO2) = 1/4
ƒэкв(Mn2O7) = ——
7∙ 2
Для кислот: ƒэквравен единице, деленной на основность кислоты, которая определяется числом ионов водорода
1/Z = ƒэкв(HCl) = 1
1/Z = ƒэкв(H2 SO4) = 1/2
1/Z = ƒэкв(H3 PO4) = 1/3
Однако, в уравнениях реакций ƒэкв будет зависеть также и от условий реакции, т.е. в каких соотношениях были взяты исходные вещества и какие продукты образуются например:
в уравнении реакции гидроксида натрия с ортофосфорной кислотой:
NaOH + H3PO4 = NaH2PO4 + H2O
2NaOH + H3PO4 = Na2HPO4 + 2H2O
3NaOH + H3PO4 = Na3PO4 + 3H2O
В первом случае на каждую молекулу щелочи, вступающую в реакцию, приходится одна молекула кислоты и фактор эквивалентности кислоты также равен 1.
Во втором случае одна молекула кислоты вступает во взаимодействие с двумя молекулами щелочи. То есть на одну молекулу едкого натра приходится 1/2 молекулы кислоты. Таким образом фактор эквивалентности кислоты теперь равен 1/2.
Соответственно, в третьем случае, фактор эквивалентности кислоты равен 1/3, поскольку на одну молекулу щелочи приходится три молекулы кислоты.
Для оснований: ƒэквравен единице, деленной на кислотность, равную числу гидроксогрупп, вступающих в реакцию
ƒэкв(NaOH) =1/Z (NaOH) = 1
ƒэкв(Ca(OH)2) = 1/Z (Ca(OH)2) = ½
Для солей: ƒэкв соли равен единице, деленной на произведение числа атомов металла в молекуле соли на степень окисления металла.
ƒэкв (Na2SO4) = 1/Z (Na2SO4) =1/2*1
ƒэквAl2(SO4)3 = 1/2 * 3
Количество моль - эквивалентов измеряется в молях, как любое количество вещества. Масса 1 моль эквивалента, молярная масса эквивалента, равна произведению фактора эквивалентности на молярную массу вещества:
M(ƒэкв(х) х) = ƒэкв(х) ∙ М(х)
Так, молярная масса эквивалента иона алюминия
М(1/3Аl+3) =1/3 ∙ 27 = 9 г/моль
Количество моль - эквивалентов можно определить по формуле:
m
nэкв= ——
Mэкв
Молярная масса эквивалента и эквивалент элемента не являются постоянной величиной в соединении, а зависят от валентности или степени окисления элемента.
Например:
Мэк в(С) в  = 12 ∙ 1/2 = 6 г/моль
= 12 ∙ 1/2 = 6 г/моль
Мэкв (С) в  = 12 ∙ 1/4 = 3 г/моль
= 12 ∙ 1/4 = 3 г/моль
Постоянными являются эквиваленты М э(Н) = 1,008 г/моль, Мэ (О) = 8 г/моль, Мэ (Аl) = 9 г/моль, Мэ (Са) = 20 г/моль.
Если не учитывать конкретную химическую реакцию, то фактор эквивалентности и молярная масса эквивалентов сложных веществ рассчитываются по формулам:
 ;
;
Мэ  =
=  ,
,
где М – молярная масса вещества
В - валентность функциональной группы
N - число функциональных групп
Для кислот функциональной группой является ион водорода, для оснований – ион гидроксила, для солей – ион металла и т.д. (H+, OH-, Kat+n, An-n)
Для определения эквивалентной массы сложного вещества в реакции следует разделить его полную массу (М) на сумму замещенных радикалов (H+, OH-, Kat+n, Ann-)
Молярная масса эквивалента оксида равна произведению фактора эквивалентности на молярную массу оксида
М окс
Мэоксида = ƒэкв∙ Мокс = ———
No ∙ noО.
где: Nо - число атомов кислорода
nоО – степень окисления кислорода в оксиде, которая равна всегда - 2.
Например:
Мэ (Mn2O7) = —— = 15,9 г/моль
7 ∙ 2
Молярная масса эквивалента кислоты равна произведению фактора эквивалентности на молярную массу кислоты
Мк
Мэкислоты = ƒэкв∙ Мк= —
Nн+
где: Мк - молекулярная (формульная) масса кислоты
N н+ - число атомов водорода, способных замещаться на металл.
Пример: Мэ (H2SO4) = 1/2 ∙ 98 = 49 г/моль
Молярная масса эквивалента основания равна произведению фактора эквивалентности на молярную массу основания
Мосн
Мэ основания = ƒэкв∙ Мосн = ——
Nон-
Пример Мэ [Cr(OH)3 ] = 1/3 ∙ 103 = 34,3 г/моль
Молярная масса эквивалента соли равна произведению фактора эквивалентности на молярную массу соли
Мэ соли = ƒэкв соли ∙ Мс = 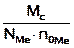

N ме – число атомов металла
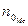 - степень окисления металла
- степень окисления металла
Мэ Al2(SO4)3= ——— = 57 г/моль
2* 3
В ОВР для определения ƒэкв необходимо единицу разделить на число отданных или присоединенных электронов. Например, в реакции: Na2SO3+KMnO4+H2SO4→Na2SO4+MnSO4+K2SO4+H2O
ƒэкв(KMnO4)=1/5, так как: MnO4- + 8H+ + 5ē = Mn2+ + 4H2O
В 1792 г. немецким физиком Рихтером был сформулирован закон эквивалентов: массы реагирующих друг с другом веществ (m1,m2) пропорциональны молярным массам их эквивалентов (МЭ1,МЭ2)
m1 Mэ1
—— = ———
m2 МЭ2
Из математической записи закона эквивалентов следует, что количество моль - эквивалентов веществ в реакции равны между собой.
nэкв1 = nэкв2
Для реакций с участием газов используют молярный объем эквивалента – это объем, занимаемый 1 моль-эквивалентом газа.
Так, МЭ (Н) = 1г/моль, если моль газа 2г/моль занимают V=22,4л, то 1 эквивалент – в два раза меньший объем, равный 11,2 л.
VЭКВ (Н2) = 22,4: 2 = 11,2л.
Аналогично МЭКВ (О)= ¼ М(О2) = 32: 4 = 8г/моль, отсюда
Vэ(О2) = 22,4: 4 = 5,6л.
Тогда математическая запись закона через эквивалентный объем:
mв-ва Vгаза mв-ва МЭв-ва
—— = —— <=> —— = ——
MЭв Vэгаза Vгаза VЭг
Пример 1: Молярная масса эквивалента некоторого металла равна 12 г/моль. Какая масса этого металла прореагировала с кислотой, если при этом выделилось 1150 мл водорода (н.у.)?
Решение: По закону эквивалентов число моль эквивалентов прореагировавшего металла и водорода одинаково:
nэкв (1/z Ме) = nэкв (1/z Н2).
Выразим число моль эквивалентов металла через отношение масс, а для водорода – через отношение объемов:
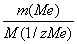 =
=  .
.
Ответ: 1.23 г.
Пример 2: При нагревании в кислороде 3.60 г некоторого металла его масса увеличилась до 5.04 г. Рассчитайте молярную массу эквивалента металла и его оксида.
Ответ: 20 г/моль; 28 г/моль.
Пример 3: В оксиде некоторого элемента массовая доля кислорода составляет 20 %. Рассчитайте молярную массу эквивалента элемента и его оксида.
Ответ: 32 г/моль; 40 г/моль.




 = 12 ∙ 1/2 = 6 г/моль
= 12 ∙ 1/2 = 6 г/моль = 12 ∙ 1/4 = 3 г/моль
= 12 ∙ 1/4 = 3 г/моль ;
; =
=  ,
,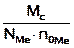

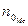 - степень окисления металла
- степень окисления металла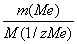 =
=  .
.


