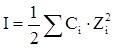1. В растворах электролитов происходит самопроизвольный распад (диссоциация) молекул на ионы, в результате чего раствор становится электропроводным.
Степень диссоциации электролита (α) рассчитывается по формуле:
α = 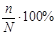
где n – число молекул, распавшихся на ионы;
N – общее число молекул растворенного вещества в растворе.
2. В зависимости от степени диссоциации, электролиты делятся на сильные и слабые. Однако это деление условно, т.к. одно и то же вещество, в зависимости от природы растворителя, может быть как сильным, так и слабым электролитом.
3. Одноосновные кислоты и однокислотные основания диссоциируют одноступенчато, многоосновные кислоты и многокислотные основания – многоступенчато. Преимущественно диссоциация протекает по первой ступени.
Амфотерные электролиты (амфолиты) диссоциируют одновременно и по кислотному, и по основному типу. К ним относятся многие гидроксиды металлов: Al(OH)3, Cr(OH)3, Fe(OH)3, Zn(OH)2, Sn(OH)2, Pb(OH)2, Be(OH)2, а также вода.
Теория слабых электролитов
К слабым электролитам относятся ковалентные соединения, обратимо (частично) диссоциирующие в водных растворах. К ним относятся:
а) почти все органические и многие неорганические кислоты: H2S, H2SO3, HNO2, HCN, и др;
б) труднорастворимые в воде основания, а также NH4OH,
в) некоторые соли HgCl2, Fe(CNS)3;
г) вода.
В растворах слабых электролитов устанавливается равновесие между молекулами веществ и их ионами: KaтAн  Kaт+ + Aн-, α < 1.
Kaт+ + Aн-, α < 1.
Данные равновесия описываются с помощью констант равновесия, называемых константами диссоциации (Кдис). Согласно закону действующих масс
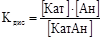
Частными случаями Кдис являются: константы кислотности Ка, константы основности Кb,
Слабые электролиты подчиняются закону разбавления Оствальда: при разбавлении раствора водой степень электролитической диссоциации электролита увеличивается. Ниже приведено математическое выражение данного закона: 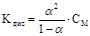
Если α << 1, то α ≈ 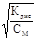 где α — степень диссоциации электролита
где α — степень диссоциации электролита
8. Основные положения теории сильных электролитов Дебая-Гюккеля. Ионная сила раствора. Активность и коэффициент активности.
В растворах сильных электролитов нет динамического равновесия между ионами и недиссоциированными молекулами: процесс диссоциации сильных электролитов необратим, вследствие этого растворы сильных электролитов и не подчиняются закону действия масс.
Теория сильных электролитов Дебая-Гюккеля. Сильными электролитами называются соединения с ионным или ковалентным полярным типом связи, необратимо (полностью) диссоциирующие в водных растворах. К сильным электролитам относятся:
(а) некоторые неорганические кислоты: HCl, HClO4, HNO3, H2SO4 и др.,
(б) щелочи: NaOH, KOH, Ba(OH)2, Ca(OH)2 и др.,
(в) соли.
Диссоциацию сильного электролита можно представить схемой:
KaтAн → Kaт+ + Aн-, a = 1
Из-за высокой концентрации ионов, в растворе сильного электролита создается собственное электромагнитное поле, интенсивность которого определяется величиной ионной силы раствора (I). Ионная сила раствора рассчитывается по уравнению:
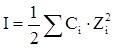
где Сi — молярная концентрация каждого иона, моль/л,
Zi — заряд каждого иона
В растворе сильного электролита вокруг каждого иона создается ионная атмосфера, состоящая из ионов противоположного знака.
Во внешнем электрическом поле ион и его атмосфера приобретают разнонаправленное движение, вследствие чего происходит электрофоретическое торможение ионов и уменьшение электропроводности раствора. Из-за уменьшения электропроводности, вызванной взаимным торможением ионов, создается впечатление, что концентрация ионов в растворе меньше, чем истинная. Эта «кажущаяся» концентрация называется активностью (а). Активность ионов (моль/л) рассчитывается по уравнению: а = f·См, где f — коэффициент активности иона, характеризующий отклонение физических свойств растворов от идеальных свойств (f<1).
Активность (a) учитывает взаимное притяжение ионов, взаимодействие растворенного вещества с растворителем, присутствие других электролитов и явления, изменяющие подвижность ионов в растворе. Активность для бесконечно разбавленных растворов равна молярной концентрации вещества: а = См и выражается в грамм ионах на литр.
Коэффициент активности (f) характеризует степень отклонения свойств реальных растворов от свойств идеальных растворов; он является величиной, отражающей все происходящие в растворе явления, вызывающие понижение подвижности ионов и снижающие их химическую активность. Численно коэффициент активности равняется отношению активности к общей молярной концентрации иона:
f = a/c а = cf
В растворах сильных электролитов ионы проявляют свои свойства не в соответствии с их концентрацией, а в соответствии с их активностью.



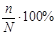
 Kaт+ + Aн-, α < 1.
Kaт+ + Aн-, α < 1.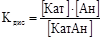
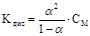
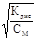 где α — степень диссоциации электролита
где α — степень диссоциации электролита