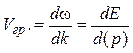

3. Волны де Бройля испытывают дисперсию, то есть их скорость зависит от длины волны.


§2. Соотношение неопределённостей Гейзенберга
1. Согласно соотношению неопределенностей Гейзенберга, микрочастица (микрообъект) не может иметь одновременно и определенную координату (х, у, z), и определенную соответствующую проекцию импульса (рх, pу, pz), причем неопределенности этих величин удовлетворяют условиям:




т. е. произведение неопределенностей координаты и соответствующей ей проекции импульса не может быть меньше величины порядка h.
Другими словами, для микрочастицы невозможно одновременно с большой точностью задать и координату (ее местонахождение) и импульс (ее скорость) так как чем точнее мы определяем координату частицы, т.е. чем меньше D x, тем более неопределенной становится проекция импульса частицы D px на эту координатную ось и наоборот.
Отсюда вытекает и фактическая невозможность одновременно с любой наперед заданной точностью измерить координату и импульс микрообъекта.
2. Влияние массы на соотношение неопределенностей
Учитывая, что px = m Vx, можно записать соотношение неопределенностей координаты и проекции скорости на эту координату:
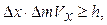
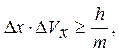
Отсюда следует: чем больше масса частицы, тем меньше неопределенность ее координаты и скорости. То есть, для макрочастиц волновые свойства не играют никакой роли: их координаты и скорость могут быть одновременно измерены с достаточно достоверной точностью.
3. Соотношение неопределенностей для энергии Е и времени t:

Подчеркнем, что D Е — неопределенность энергии некоторого состояния системы, D t — промежуток времени, в течение которого оно существует. Следовательно, система, имеющая среднее время жизни D t, не может быть охарактеризована определенным значением энергии: разброс энергии D E = h /D t возрастает с уменьшением среднего времени жизни.
Это означает, что частота излученного фотона также должна иметь неопределенность D n = D E / h, т. е. линии спектра должны характеризоваться частотой, равной n ± D E / h. Опыт действительно показывает, что все спектральные линии размыты; измеряя ширину спектральной линии, можно оценить времясуществования атома в возбужденном состоянии.
§3 Волновая функция и ее физический смысл
Экспериментальное подтверждение гипотезы де Бройля привели к созданию квантовой механики, описывающей законы движения и взаимодействия микрочастиц с учетом их волновых свойств.
В квантовой механике состояние микрочастиц описывается с помощью волновой функции Y (x,y,z,t), которая является основным носителем информации об их корпускулярных и волновых свойствах.
Вероятность нахождения частицы в элементе объемом dV равна dW = | Y |2 dV
Квадрат модуля Y (пси) - функции имеет смысл плотности вероятности, т. е. определяет вероятность нахождения частицы в единичном объеме в окрестности точки с координатами х, у, z:
| Y |2 = dW / dV
Таким образом, физический смысл имеет не сама Y -функция, а квадрат ее модуля | Y |2 (квадрат модуля амплитуды волн де Бройля), которым задается интенсивность волн де Бройля.
Физический смысл волновой функции:
Волновая функция имеет статистический, вероятностный характер: квадрат модуля волновой функции (квадрат модуля амплитуды волн де Бройля) определяет вероятность нахождения частицы в момент времени t в области с координатами х и (х + dx), у и (у + dy), z и (z+ dz):
Волновая функция Y, являясь основной характеристикой состояния микрообъектов, позволяет в квантовой механике вычислять средние значения физических величин, характеризующих данный микрообъект. Например, среднее расстояние á r ñ электрона от ядра вычисляют по формуле

§ 4 Уравнение Шрёдингера
Квантовая механика, описывает законы движения и взаимодействия микрочастиц с учетом их волновых свойств Уравнение Шредингера, играет в атомных процессах такую же фундаментальную роль, как законы Ньютона в классической механике. За создание волновой механики Шрёдингер в 1933 г. удостоен Нобелевской премии.
1. Общее уравнение Шредингера ( зависящее от времени )
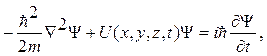
где:  (х, у, z,t) — искомая волновая функция частицы.
(х, у, z,t) — искомая волновая функция частицы.
 оператор Лапласа
оператор Лапласа
U - функция координат и времени, градиент которой, взятый с противоположным знаком, определяет силу, действующую на частицу.
2. Уравнение Шредингера для стационарных состояний:
(если функция U= U(x, у, z) не зависит явно от времени и имеет смысл потенциальной энергии.

где: Е –общая энергия частицы
3. Уравнение Шредингера для свободной частицы, движущейся в отсутствие силовых полей (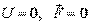 ) в направлении оси
) в направлении оси  ,
,

Решением соответствующего уравнения Шредингера является волновая функция

соответствующая плоской волне де Бройля.
Физика атомов и молекул
Модели атома
Первая модель атома Томсона (однородно положительно заряженная сфера, в которую вкраплены электроны) была признана несостоятельной после опытов Резерфорда по рассеянию  -частиц.
-частиц.
Опыт Резерфорда: пучок  -частиц направленный на тонкую золотистую фольгу (Ф) регистрировался после соударения с атомами фольги
-частиц направленный на тонкую золотистую фольгу (Ф) регистрировался после соударения с атомами фольги
 Опыты показали, что
Опыты показали, что
Ø некоторые  -частицы отклонились от первоначального направления,
-частицы отклонились от первоначального направления,
Ø небольшое количество отразилось от фольги, т. е отклонилось на большие углы (около 1800),
Ø а большинство частиц проходило сквозь фольгу, как сквозь пустое пространство.
Выводы Резерфорда:  -частица может отражаться только от массивного положительного заряда, сосредоточенного в центре атома. Отсюда: планетарная модель атома Резерфорда - весь положительный заряд атома и почти вся его масса сосредоточены в атомном ядре. Вокруг ядра с большой скоростью движутся по круговым орбитам электроны (как планеты вокруг Солнца).
-частица может отражаться только от массивного положительного заряда, сосредоточенного в центре атома. Отсюда: планетарная модель атома Резерфорда - весь положительный заряд атома и почти вся его масса сосредоточены в атомном ядре. Вокруг ядра с большой скоростью движутся по круговым орбитам электроны (как планеты вокруг Солнца).
Из модели следует 2 противоречия:
1. Вращаясь, электрон должен испускать свет и терять энергию, т.е. атом должен быть нестабильным (на самом деле атом устойчив);
2. По модели спектр излучения атома должен быть сплошным (на самом деле – атом излучает линейчатый спектр).
Атом водорода в теории Бора
Исходя из идеи Планка о квантовании энергии, Бор на основе модели атома Резерфорда создал свою теорию водородоподобного атома, основанную на трёх постулатах:
Постулаты Бора:
1. Электроны в атоме движутся по стационарным орбитам, среди которых разрешенными являются только те, радиусы которых удовлетворяют условию квантовых значений момента импульса:


 (n =1,2,3…)
(n =1,2,3…)
где - постоянная Планка,
 - масса электрона,
- масса электрона,
 - скорость движения электрона по круговой орбите,
- скорость движения электрона по круговой орбите,
 - радиус орбиты,
- радиус орбиты,
2. Движение электрона по стационарной орбите не сопровождается излучением и поглощением энергии.
3. Испускание и поглощение энергии происходит только при переходе электрона с одной стационарной орбиты на другую. 
При En > Em – излучение
En < Em - поглощение
Набор возможных дискретных значений частот квантовых переходов определяет линейчатый спектр атомов.




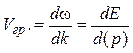







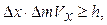
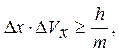


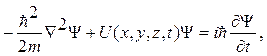
 (х, у, z,t) — искомая волновая функция частицы.
(х, у, z,t) — искомая волновая функция частицы. оператор Лапласа
оператор Лапласа
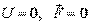 ) в направлении оси
) в направлении оси  ,
,

 -частиц.
-частиц. Опыты показали, что
Опыты показали, что

 (n =1,2,3…)
(n =1,2,3…) - масса электрона,
- масса электрона, - скорость движения электрона по круговой орбите,
- скорость движения электрона по круговой орбите, - радиус орбиты,
- радиус орбиты,




