Аннотация
Целю данной курсовой работы является оценка воздействия бария и его соединений на окружающую среду. В работе приведены данные о мировых запасах бария, добыче и получении бария из руды, а так же его применение в производстве.
Определены соединения бария, образующиеся при производстве стали, и рассчитана приведенная масса выбросов этих соединений.
Курсовая работа оформлена на 26 листах, содержит 8 таблиц, 2 рисунка, 11 формул и список литературных источников из 17 наименований.
Содержание
Аннотация. 4
Введение. 6
1 Литературный обзор. 7
1.1 Мировые запасы бария. 7
1.2 Добыча бариевой руды.. 8
1.3 Получение бария из руды.. 8
1.4 Применение бария в производстве. 10
1.5 Воздействие бария и его соединений на организм.. 11
1.6 Рекомендации по безопасности и охране здоровья. 13
2 Применение бария и кальция в качестве раскислителя при выплавке стали. 14
3 Анализ соединений бария, образующихся при его применении в производстве стали. 16
3.1 Контроль концентрации вредных соединений бария в воздухе рабочей зоны.. 16
3.2 Соединения бария, образующиеся при обработке стали на агрегате ковш-печь. 18
Выводы.. 24
Список использованных источников. 25
Введение
В настоящее время улучшение свойств изделий из стали является одной из актуальных задач металлургического производства. Одной из важных и эффективных мер для улучшения эксплуатационных свойств стали, является удаление примесей либо изменение состава и морфологии неметаллических включений и, соответственно, выбор подходящего раскислителя и модифицирующей добавки.
Влияние присадок щелочноземельных и других активных элементов на свойства стали изучается исследователями на протяжении более 40 лет. Практически во всех работах отмечается положительный эффект от присадок комплексных сплавов, содержащих в себе щелочноземельные и/или редкоземельные элементы. Такие сплавы широко используются как для раскисления металла, так и для модифицирования стали с получением более высоких прочностных и пластических свойств готового металла. Наибольшее распространение комплексные сплавы-модификаторы получили в литейном производстве. Модификаторы, в состав которых входит алюминий, кальций, барий и другие элементы, успешно используют не только при выплавке стали, но и при производстве цветных металлов и сплавов с особыми свойствами, например медь и алюминий.
Обработка барием с целью изменения состава и морфологии оксидных и сульфидных включений и повышения чистоты стали, является частным случаем микролегирования жидкой стали. Результаты исследований показывают положительный эффект. Обработка стали барийсодержащими сплавами может уменьшить количество используемого алюминия; продукты раскисления легко всплывают в шлак; свойства оставшихся в металле включений улучшаются, соответственно, улучшаются механические свойства
За последнее десятилетие значительно возросло применение щелочноземельных металлов, таких как кальций и барий. Соединения бария потенциально опасны для здоровья человека. Они могут вызывать острые и хронические поражения отдельных органов и систем, что должно приниматься во внимание при получении и применении бариевых соединений.
Литературный обзор
Мировые запасы бария
Барий– химический элемент 2-й группы периодической системы, атомный номер 56, относительная атомная масса 137,33. Расположен в шестом периоде между цезием и лантаном. Природный барий состоит из семи стабильных изотопов с массовыми числами 130 (0,101 %), 132 (0,097 %), 134 (2,42 %), 135 (6,59 %), 136 (7,81 %), 137 (11,32 %) и 138 (71,66 %). Барий в большинстве химических соединений проявляет максимальную степень окисления +2, но может иметь и нулевую. В природе барий встречается только в двухвалентном состоянии [1].
В земной коре содержится 0,05 % бария. Это довольно много – значительно больше, чем, например, свинца, олова, меди или ртути. В чистом виде в земле его нет: барий активен, он входит в подгруппу щелочноземельных металлов и, естественно, в минералах связан достаточно прочно [2]. Присутствует он как в изверженных, так и в метаморфических и осадочных породах, где входит в состав многих минералов, однако промышленное значение в настоящее время имеют только два из них: барит и в меньшей степени витерит.
Барит или “тяжелый шпат”, представляет собой природный сульфат бария (BaSO4), содержащий 65,7 % ВаО. В качестве наиболее часто встречающихся примесей отмечаются: изоморфные- Sr, Pb, Ra; механические - оксиды железа и марганца, сульфиды цветных металлов и железа, глинистое и органическое вещество. Количество и состав примесей обуславливают разнообразие окраски барита, которая бывает белой, от серой до черной, голубой, желтой, розовой, бурой, коричневой, красной; прозрачные бесцветные кристаллы крайне редки. Плотность химически чистого барита 4,48 г/см при 25 0С, у природных баритов 4,3-4,7 г/см. Твердость по Моосу 3-3,5. Барит наблюдается в виде зернистых образований или конкреций, изредка образует хорошо ограненные таблитчатые кристаллы ромбической сингонии; хрупок; обладает стеклянным блеском, на плоскостях спайности перламутровым; химически инертен, практически нерастворим в воде, плохо растворятся (даже при нагревании) в соляной кислоте, незначительно (10-12 %) в концентрированной серной кислоте [3].
Мировые минерально-сырьевые ресурсы барита оценивались в 1999 в 2 млрд. тонн, значительная часть их сосредоточена в Китае (около 1 млрд. тонн) и в Казахстане (0,5 млрд. тонн). Большие запасы барита есть и в США, Индии, Турции, Марокко и Мексике. Российские ресурсы барита оцениваются в 10 миллионов тонн, его добыча ведется на трех основных месторождениях, расположенных в Хакасии, Кемеровской и Челябинской областях. Общая годовая добыча барита в мире составляет около 7 миллионов тонн, Россия производит 5 тыс. тонн и импортирует 25 тыс. тонн барита в год [1].
Витерит - природный карбонат бария (ВаСО3), содержащий 77,7 % ВаО; формирует шаровидные, почковидные, зернистые образования; кристаллы бипирамидальной формы, встречаются двойники. По физическим свойствам близок к бариту, имеет ту же плотность и твердость; цвет белый, часто серый или желтоватый, может быть бесцветным. В отличие от барита легко растворяется даже в слабых кислотах. Значительные концентрации витерита крайне редки. Единственное крупное месторождение - Сеттлингстоун в Великобритании. Поэтому промышленностью в основном потребляется достаточно широко распространенный в природе барит [3].
Добыча бариевой руды
В настоящее время при общей мировой добыче барита свыше 7 млн т/год лидирующее положение занимают КНР (до 3,5 млн т), США (до 0,7 млн т), Индия (до 0,5 млн т) и Марокко (0,35 млн т), оставшаяся часть приходится в основном на Мексику, Иран, Таиланд, Болгарию, Германию, Испанию, Северную Корею и Турцию. В России максимум добычи составил 0,16 млн т (1996 г.), в Казахстане - 0,135 млн т (1994 г.), в Грузии - 0,012 млн т (1995 г.) [4].
Получение бария из руды
В настоящее время промышленностью разрабатываются месторождения барита, среди которых по условиям образования могут быть выделены гидротермальные, осадочные и месторождения выветривания. Каждый из этих типов включает месторождения, крайне разнообразные по форме и размерам залежей, взаимоотношениями с вмещающими породами, возрасту и составу руд. Промышленное значение в настоящее время имеют лишь гидротермальные месторождения.
Требования к сырью.
В зависимости от сферы потребления барита изменяются и требования к качеству исходного сырья. В настоящее время они регламентируются ГОСТ 4682-74 “Концентрат баритовый”, в котором выделяются два промышленных класса (А и Б) и шесть марок. Барит класса Б используется в нефти - и газодобывающей промышленности, в других отраслях промышленности применяется барит класса А. В обоих классах нормируется содержание сернокислого бария и водорастворимых солей, которые в зависимости от марки не должны выходить за пределы соответственно 90-95 и 0,25-0,45 %. Для класса А содержание некоторых примесей в зависимости от марки не должно превышать (в %): SiO2 1,5-4,5; Fe2O3 0,5-2,5; СаО 0,5-7; для класса Б нормируется также гранулометрический состав: содержание остатка на сите 0009К не должно превышать 4 %, содержание фракции 5 мкм составляет более 5-20 % [3].
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно [2].
Основное сырьё для получения бария — баритовый концентрат (80-95 % BaSO4), который, в свою очередь, получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
 (1)
(1)
 {\displaystyle {\mathsf {BaSO_{4}+4C\rightarrow BaS+4CO}}} (2)
{\displaystyle {\mathsf {BaSO_{4}+4C\rightarrow BaS+4CO}}} (2)
{\displaystyle {\mathsf {BaSO_{4}+2CH_{4}\rightarrow BaS+2C+4H_{2}O}}}
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
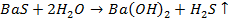 (3)
(3)
 (4)
(4)
 (5)
(5)
 (6)
(6)
BaCO3 + C 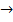 BaO + 2CO (7)
BaO + 2CO (7)  {\displaystyle {\mathsf {BaS+2H_{2}O\rightarrow Ba(OH)_{2}+H_{2}S\uparrow }}}
{\displaystyle {\mathsf {BaS+2H_{2}O\rightarrow Ba(OH)_{2}+H_{2}S\uparrow }}}
{\displaystyle {\mathsf {BaS+H_{2}O+CO_{2}\rightarrow BaCO_{3}+H_{2}S\uparrow }}}{\displaystyle {\mathsf {Ba(OH)_{2}\rightarrow BaO+H_{2}O}}}
{\displaystyle {\mathsf {BaCO_{3}\rightarrow BaO+CO_{2}}}}Металлический барий получают из оксида восстановлением алюминием [5]:
{\displaystyle {\mathsf {3BaO+2Al\rightarrow 3Ba+Al_{2}O_{3}}}}  3BaO + 2Al
3BaO + 2Al  3Ba + Al2O3 (8)
3Ba + Al2O3 (8)
Впервые этот процеcc осуществил русский физико - химик Н.Н.Бекетов [1]. Сейчас процесс восстановления алюминием проводят в вакууме при температурах от 1200 до 1250 °C, при этом образующийся барий испаряется и конденсируется на более холодных частях реактора.
Кроме того, барий можно получить электролизом расплавленной смеси хлоридов бария и кальция.
Рекомендации по безопасности и охране здоровья
Подходящие приспособления для мытья и другие санитарные устройства должны быть обеспечены работникам, контактирующим с токсичными растворимыми соединениями бария, должны быть установлены жесткие правила индивидуальной гигиены. Курение, еда и питье на рабочем месте должны быть строго запрещены. Полы в рабочих помещениях должны быть плотными и регулярно мыться. Необходимо прилагать усилия для снижения концентрации баритовой пыли в воздухе до минимума. Вдобавок, особое внимание следует уделять наличию оксида кремния во взвешенной в воздухе пыли.
Выводы
Основной задачей расчетов было определение вредных составляющих газовойфазы и их возможного влияния на организм человека. Анализ соединений, образующихся при взаимодействии между компонентами газовой, шлаковой и металлической фаз, показал возможное образование бария, а также оксидов и сульфидов бария.
Взаимодействие бария с воздухом сводится к образованию гидроксидов бария (при переменном составе присадок бария). При увеличение присадок бария без изменения состава и количества воздуха гидроксиды бария начинают разлагаться (при температуре 1300-1400°С) и образовывать оксид бария (BaO). При неизменном содержании бария и последующем увеличении присадок воздуха состав газовой фазы был представлен прежде всего гидрооксидом бария и оксидом бария.
Поэтому в процессе выплавки стали с применением барийсодержащих модификаторов необходимо блокировать подсосы воздуха при подаче ферросплава (обеспечить минимальную вытяжку).
При взаимодействии бария с компонентами шлаковой фазы (плавиковым шпатом и алюминиевым шлаком) возможно образование соединений хлорида и фторида бария, которые входят в состав вредных веществ содержащихся в воздухе рабочей зоны и подлежат контролю. Данные соединения выделяются в газовую фазу при температуре 1600-1650° С, при 1700° С отмечается образование соединений BaF2 и BaCl2. В связи с этим шлакообразующие целесообразнее подавать при низких температурах (меньше 1650° С) и обязательно в виде проволоки в глубину расплава.
Аннотация
Целю данной курсовой работы является оценка воздействия бария и его соединений на окружающую среду. В работе приведены данные о мировых запасах бария, добыче и получении бария из руды, а так же его применение в производстве.
Определены соединения бария, образующиеся при производстве стали, и рассчитана приведенная масса выбросов этих соединений.
Курсовая работа оформлена на 26 листах, содержит 8 таблиц, 2 рисунка, 11 формул и список литературных источников из 17 наименований.
Содержание
Аннотация. 4
Введение. 6
1 Литературный обзор. 7
1.1 Мировые запасы бария. 7
1.2 Добыча бариевой руды.. 8
1.3 Получение бария из руды.. 8
1.4 Применение бария в производстве. 10
1.5 Воздействие бария и его соединений на организм.. 11
1.6 Рекомендации по безопасности и охране здоровья. 13
2 Применение бария и кальция в качестве раскислителя при выплавке стали. 14
3 Анализ соединений бария, образующихся при его применении в производстве стали. 16
3.1 Контроль концентрации вредных соединений бария в воздухе рабочей зоны.. 16
3.2 Соединения бария, образующиеся при обработке стали на агрегате ковш-печь. 18
Выводы.. 24
Список использованных источников. 25
Введение
В настоящее время улучшение свойств изделий из стали является одной из актуальных задач металлургического производства. Одной из важных и эффективных мер для улучшения эксплуатационных свойств стали, является удаление примесей либо изменение состава и морфологии неметаллических включений и, соответственно, выбор подходящего раскислителя и модифицирующей добавки.
Влияние присадок щелочноземельных и других активных элементов на свойства стали изучается исследователями на протяжении более 40 лет. Практически во всех работах отмечается положительный эффект от присадок комплексных сплавов, содержащих в себе щелочноземельные и/или редкоземельные элементы. Такие сплавы широко используются как для раскисления металла, так и для модифицирования стали с получением более высоких прочностных и пластических свойств готового металла. Наибольшее распространение комплексные сплавы-модификаторы получили в литейном производстве. Модификаторы, в состав которых входит алюминий, кальций, барий и другие элементы, успешно используют не только при выплавке стали, но и при производстве цветных металлов и сплавов с особыми свойствами, например медь и алюминий.
Обработка барием с целью изменения состава и морфологии оксидных и сульфидных включений и повышения чистоты стали, является частным случаем микролегирования жидкой стали. Результаты исследований показывают положительный эффект. Обработка стали барийсодержащими сплавами может уменьшить количество используемого алюминия; продукты раскисления легко всплывают в шлак; свойства оставшихся в металле включений улучшаются, соответственно, улучшаются механические свойства
За последнее десятилетие значительно возросло применение щелочноземельных металлов, таких как кальций и барий. Соединения бария потенциально опасны для здоровья человека. Они могут вызывать острые и хронические поражения отдельных органов и систем, что должно приниматься во внимание при получении и применении бариевых соединений.
Литературный обзор
Мировые запасы бария
Барий– химический элемент 2-й группы периодической системы, атомный номер 56, относительная атомная масса 137,33. Расположен в шестом периоде между цезием и лантаном. Природный барий состоит из семи стабильных изотопов с массовыми числами 130 (0,101 %), 132 (0,097 %), 134 (2,42 %), 135 (6,59 %), 136 (7,81 %), 137 (11,32 %) и 138 (71,66 %). Барий в большинстве химических соединений проявляет максимальную степень окисления +2, но может иметь и нулевую. В природе барий встречается только в двухвалентном состоянии [1].
В земной коре содержится 0,05 % бария. Это довольно много – значительно больше, чем, например, свинца, олова, меди или ртути. В чистом виде в земле его нет: барий активен, он входит в подгруппу щелочноземельных металлов и, естественно, в минералах связан достаточно прочно [2]. Присутствует он как в изверженных, так и в метаморфических и осадочных породах, где входит в состав многих минералов, однако промышленное значение в настоящее время имеют только два из них: барит и в меньшей степени витерит.
Барит или “тяжелый шпат”, представляет собой природный сульфат бария (BaSO4), содержащий 65,7 % ВаО. В качестве наиболее часто встречающихся примесей отмечаются: изоморфные- Sr, Pb, Ra; механические - оксиды железа и марганца, сульфиды цветных металлов и железа, глинистое и органическое вещество. Количество и состав примесей обуславливают разнообразие окраски барита, которая бывает белой, от серой до черной, голубой, желтой, розовой, бурой, коричневой, красной; прозрачные бесцветные кристаллы крайне редки. Плотность химически чистого барита 4,48 г/см при 25 0С, у природных баритов 4,3-4,7 г/см. Твердость по Моосу 3-3,5. Барит наблюдается в виде зернистых образований или конкреций, изредка образует хорошо ограненные таблитчатые кристаллы ромбической сингонии; хрупок; обладает стеклянным блеском, на плоскостях спайности перламутровым; химически инертен, практически нерастворим в воде, плохо растворятся (даже при нагревании) в соляной кислоте, незначительно (10-12 %) в концентрированной серной кислоте [3].
Мировые минерально-сырьевые ресурсы барита оценивались в 1999 в 2 млрд. тонн, значительная часть их сосредоточена в Китае (около 1 млрд. тонн) и в Казахстане (0,5 млрд. тонн). Большие запасы барита есть и в США, Индии, Турции, Марокко и Мексике. Российские ресурсы барита оцениваются в 10 миллионов тонн, его добыча ведется на трех основных месторождениях, расположенных в Хакасии, Кемеровской и Челябинской областях. Общая годовая добыча барита в мире составляет около 7 миллионов тонн, Россия производит 5 тыс. тонн и импортирует 25 тыс. тонн барита в год [1].
Витерит - природный карбонат бария (ВаСО3), содержащий 77,7 % ВаО; формирует шаровидные, почковидные, зернистые образования; кристаллы бипирамидальной формы, встречаются двойники. По физическим свойствам близок к бариту, имеет ту же плотность и твердость; цвет белый, часто серый или желтоватый, может быть бесцветным. В отличие от барита легко растворяется даже в слабых кислотах. Значительные концентрации витерита крайне редки. Единственное крупное месторождение - Сеттлингстоун в Великобритании. Поэтому промышленностью в основном потребляется достаточно широко распространенный в природе барит [3].
Добыча бариевой руды
В настоящее время при общей мировой добыче барита свыше 7 млн т/год лидирующее положение занимают КНР (до 3,5 млн т), США (до 0,7 млн т), Индия (до 0,5 млн т) и Марокко (0,35 млн т), оставшаяся часть приходится в основном на Мексику, Иран, Таиланд, Болгарию, Германию, Испанию, Северную Корею и Турцию. В России максимум добычи составил 0,16 млн т (1996 г.), в Казахстане - 0,135 млн т (1994 г.), в Грузии - 0,012 млн т (1995 г.) [4].
Получение бария из руды
В настоящее время промышленностью разрабатываются месторождения барита, среди которых по условиям образования могут быть выделены гидротермальные, осадочные и месторождения выветривания. Каждый из этих типов включает месторождения, крайне разнообразные по форме и размерам залежей, взаимоотношениями с вмещающими породами, возрасту и составу руд. Промышленное значение в настоящее время имеют лишь гидротермальные месторождения.
Требования к сырью.
В зависимости от сферы потребления барита изменяются и требования к качеству исходного сырья. В настоящее время они регламентируются ГОСТ 4682-74 “Концентрат баритовый”, в котором выделяются два промышленных класса (А и Б) и шесть марок. Барит класса Б используется в нефти - и газодобывающей промышленности, в других отраслях промышленности применяется барит класса А. В обоих классах нормируется содержание сернокислого бария и водорастворимых солей, которые в зависимости от марки не должны выходить за пределы соответственно 90-95 и 0,25-0,45 %. Для класса А содержание некоторых примесей в зависимости от марки не должно превышать (в %): SiO2 1,5-4,5; Fe2O3 0,5-2,5; СаО 0,5-7; для класса Б нормируется также гранулометрический состав: содержание остатка на сите 0009К не должно превышать 4 %, содержание фракции 5 мкм составляет более 5-20 % [3].
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно [2].
Основное сырьё для получения бария — баритовый концентрат (80-95 % BaSO4), который, в свою очередь, получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
 (1)
(1)
 {\displaystyle {\mathsf {BaSO_{4}+4C\rightarrow BaS+4CO}}} (2)
{\displaystyle {\mathsf {BaSO_{4}+4C\rightarrow BaS+4CO}}} (2)
{\displaystyle {\mathsf {BaSO_{4}+2CH_{4}\rightarrow BaS+2C+4H_{2}O}}}
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
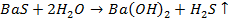 (3)
(3)
 (4)
(4)
 (5)
(5)
 (6)
(6)
BaCO3 + C 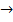 BaO + 2CO (7)
BaO + 2CO (7)  {\displaystyle {\mathsf {BaS+2H_{2}O\rightarrow Ba(OH)_{2}+H_{2}S\uparrow }}}
{\displaystyle {\mathsf {BaS+2H_{2}O\rightarrow Ba(OH)_{2}+H_{2}S\uparrow }}}
{\displaystyle {\mathsf {BaS+H_{2}O+CO_{2}\rightarrow BaCO_{3}+H_{2}S\uparrow }}}{\displaystyle {\mathsf {Ba(OH)_{2}\rightarrow BaO+H_{2}O}}}
{\displaystyle {\mathsf {BaCO_{3}\rightarrow BaO+CO_{2}}}}Металлический барий получают из оксида восстановлением алюминием [5]:
{\displaystyle {\mathsf {3BaO+2Al\rightarrow 3Ba+Al_{2}O_{3}}}}  3BaO + 2Al
3BaO + 2Al  3Ba + Al2O3 (8)
3Ba + Al2O3 (8)
Впервые этот процеcc осуществил русский физико - химик Н.Н.Бекетов [1]. Сейчас процесс восстановления алюминием проводят в вакууме при температурах от 1200 до 1250 °C, при этом образующийся барий испаряется и конденсируется на более холодных частях реактора.
Кроме того, барий можно получить электролизом расплавленной смеси хлоридов бария и кальция.
Применение бария в производстве
Применение металлического бария весьма ограничено из-за его высокой химической активности, соединения бария используются гораздо шире. В небольших количествах барий используется в металлургии для очистки расплавленных меди и свинца от примесей серы, кислорода и азота. Барий добавляют в типографские и антифрикционные сплавы, сплав бария с никелем используется для изготовления деталей радиоламп и электродов свечей зажигания в карбюраторных двигателях.
Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах.
Оксид бария, в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей.
Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зелёный огонь).
Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов применяется для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространённых типов таких стекол имеет следующий состав: оксид фосфора — 61 %; ВаО — 32 %; оксид алюминия — 1,5 %; оксид натрия — 5,5 %. В стекловарении для атомной промышленности применяется также и фосфат бария.
Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (оксид бария - оксид меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
Применение в медицине
Сульфат бария, нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта. [5]



 (1)
(1) {\displaystyle {\mathsf {BaSO_{4}+4C\rightarrow BaS+4CO}}} (2)
{\displaystyle {\mathsf {BaSO_{4}+4C\rightarrow BaS+4CO}}} (2)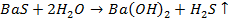 (3)
(3) (4)
(4) (5)
(5) (6)
(6)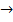 BaO + 2CO (7)
BaO + 2CO (7)  {\displaystyle {\mathsf {BaS+2H_{2}O\rightarrow Ba(OH)_{2}+H_{2}S\uparrow }}}
{\displaystyle {\mathsf {BaS+2H_{2}O\rightarrow Ba(OH)_{2}+H_{2}S\uparrow }}} 3BaO + 2Al
3BaO + 2Al  3Ba + Al2O3 (8)
3Ba + Al2O3 (8)


