

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...
Топ:
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
К.Г. Матьков
КАТАБОЛИЗМ ПРОСТЫХ БЕЛКОВ И ОБМЕН АМИНОКИСЛОТ
Учебное пособие
Чебоксары
2006
УДК
М
Рецензенты:
кафедра биохимии Российского государственного медицинского университета им. Н.И. Пирогова (зав. кафедрой д-р мед. наук, профессор А.А. Терентьев); кафедра биохимии человека и животных ННГУ им. Н.И. Лобачевского (зав. кафедрой д-р биол. наук В.Н. Крылов)
М К.Г. Матьков, Катаболизм простых белков и обмен аминокислот: Учеб. пособие/;/Чуваш. ун-т Чебоксары, 2006. 150 с.
Описан катаболизм простых белков и обмен протеиногенных аминокислот. По каждому из разделов приведены задания в форме вопросов или задач. Материал дан с учетом учебной программы по биохимии.
Для студентов медицинских специальностей 1-2 курса медицинских вузов.
Утверждено Редакционно-издательским советом университета
Отв. редактор: д-р биол. наук, профессор Р.И. Кляшева
Матьков К.Г.
Чувашский государственный университет, 2006
ВВЕДЕНИЕ
Простые белки – это линейные биополимеры, состоящие из a-L-аминокислот, связанных между собой пептидной (амидной) связью. Обмен этих белков включает внеклеточные и внутриклеточные химические процессы их преобразования. Как и для других соединений, эти преобразования состоят из реакций катаболизма и анаболизма, катализируемых и управляемых ферментами. Катаболизм белков осуществляется через ряд стадий. На первой стадии белки деградируют до свободных аминокислот. Этот процесс может осуществляться в желудочно-кишечном тракте (ЖКТ), внутриклеточно (в лизосомах и протеосомах) и внеклеточно. На следующем этапе (внутриклеточно) аминокислоты превращаются в промежуточные продукты цикла Кребса и окисляются в этом метаболическом пути, а протоны и электроны от восстановленных в цикле коферментов поступают в дыхательную цепь, где как конечный продукт образуется вода. Параллельно, за счет энергии выделившейся в процессе переноса электронов в дыхательной цепи идет синтез АТФ (окислительное фосфорилирование). Реакции образования биогенных аминов при декарбоксилировании ряда аминокислот также относятся к реакциям катаболизма.
|
|
Анаболизм белков у человека включает в себя синтез заменимых аминокислот из предшественников, синтез белка из заменимых и незаменимых аминокислот, синтез из аминокислот специализированных продуктов (гормоны, медиаторы, нейромедиаторы, пигменты), синтез углеводов, липидов и нуклеиновых кислот из углеродных скелетов аминокислот.
В сутки у взрослого человека массой 70 кг разрушается до 400 г эндогенных белков. Большая часть образовавшихся аминокислот используется на ресинтез разрушенных белков, а оставшаяся часть (около 100 г) идет на другие нужды организма. Таким образом, утерянная часть белка должна восполняться за счет поступления с пищей. Это количество и есть норма белка в питании. Однако с учетом того, что часть заменимых аминокислот может синтезироваться из небелковых предшественников, то эта норма может быть ниже (около 50 г).
Постоянное обновление белков и их ресинтез необходимы для бесперебойной работы клеточных систем. В течение своей жизни белки подвергаются различным ферментативным и спонтанным химическим модификациям, вследствие чего со временем утрачивают свои функции. Период жизни белков колеблется от нескольких десятков секунд до нескольких лет. Наиболее короткий срок жизни у пептидных гормонов, а наиболее продолжительный у некоторых нейрональных белков и белков эмали зубов.
|
|
Протеиногенные аминокислоты (участвуют в биосинтезе белка), образованные при деградации экзогенных (пищевых) и эндогенных белков, используются, в первую очередь, на ресинтез белков организма. В отличие от углеводов и нейтральных жиров белки у человека не откладываются про запас. Однако при длительном голодании организм может использовать наиболее массовые белки (белки мышц, печени и крови – 25 г/сутки) как энергетический субстрат или строительный материал. Аминокислоты, образующиеся при деградации белков (при голодании) используются на синтез глюкозы необходимой для энергообеспечения мозга и эритроцитов и ресинтез минорных белков, без которых организм не может обойтись.
Пополнение утраченных белков осуществляется за счет пищи. Пищевые белки не равноценны по своей значимости для организма. Ценность белков для человека определяется наличием полного спектра незаменимых аминокислот (не могут синтезироваться) в необходимых организму количествах, доступностью белков действию протеолитических ферментов ЖКТ. Некоторые пищевые белки (например, кератины) недоступны для действия пищеварительных ферментов и поэтому не гидролизуются до аминокислот. Животные белки кератины не расщепляются вследствие особенностей их структуры. Растительные белки усваиваются хуже, чем животные. Это связано с тем, что в организме человека отсутствует фермент целлюлаза, необходимый для разрушения целлюлозной оболочки растительной клетки, что делает внутриклеточные белки недоступными для ферментов желудочно-кишечного тракта (ЖКТ), хуже усваиваются растительные белки при потреблении сырых овощей. В процессе варки растительной пищи образующийся в клетках водяной пар разрывает целлюлозные оболочки, и доступность белков для ферментов ЖКТ возрастает.
Классификация протеиногенных аминокислот по их заменимости отражена в таблице 1.
Таблица 1
Степень заменимости протеиногенных аминокислот
| Незаменимые | Частично заменимые | Условно заменимые | Заменимые |
| Валин Изолейцин Лейцин Лизин Метионин Треонин Триптофан Фенилаланин | Гистидин Аргинин | Тирозин Цистеин | α-Аланин Аспарагин Аспарагиновая кислота Глицин Глутамин Глутаминовая кислота Пролин Серин |
|
|
Заменимые аминокислоты синтезируются из других аминокислот или иных метаболитов. Незаменимые аминокислоты не синтезируются в организме. Необходимы пояснения по частично заменимым и условно заменимым аминокислотам. Гистидин и аргинин синтезируются в достаточном количестве у взрослых, однако, для детей необходимо поступление этих аминокислот с пищей – это частично заменимые аминокислоты. Для синтеза тирозина и цистеина необходимы незаменимые аминокислоты (фенилаланин и метионин соответственно), поэтому их относят к условно заменимым.
С обменом белков связано такое понятие, как азотистый баланс (разница между количеством азота поступающего с пищей и количеством выделяемого азота). Основными азотсодержащими соединениями нашего организма являются белки. Азот белков выводится из организма, главным образом, в составе мочевины и солей аммония. Небольшая доля азота (несколько %) выводится в составе мочевой кислоты (продукт катаболизма пуринов), креатинина (продукт катаболизма креатинфосфата) и других продуктов. Для взрослого человека, как правило, при умеренной физической нагрузке количество поступившего в организм азота равно количеству выводимого (азотистое равновесие). Положительный азотистый баланс имеет место у беременных, кормящих матерей и детей (количество поступающего в организм азота выше, чем выводимого). Отрицательный азотистый баланс (количество выводимого из организма азота выше, чем вводимого) возникает при раковой кахексии, голодании, сахарном диабете, старении.
Вопросы к разделу «ВВЕДЕНИЕ»
1. Дайте определение простых белков.
2. Охарактеризуйте этапы катаболизма белков.
3. Охарактеризуйте этапы анаболизма белков.
4. Какое количество белка в сутки деградирует и сколько ресинтезируется у взрослого человека средней массы при умеренной физической нагрузке?
5. Норма белка в питании.
6. Чем определяется ценность пищевых белков?
7. Заменимые, незаменимые и частично заменимые аминокислоты.
|
|
8. Дайте определение понятию азотистый баланс. При каких состояниях азотистый баланс положительный, и при каких состояниях он отрицательный?
Пространстве
Протеолиз белков в клетках различных тканей и органов осуществляется, в основном, в лизосомах и протеасомах, но может осуществляться и в других клеточных компартментах.
Лизосомы – внутриклеточные органеллы окруженные одинарной мембраной, содержат различные гидролитические ферменты с оптимумом рН в кислой области (4,5-5,0). Низкие значения рН создаются и поддерживаются АТФ зависимой протонной помпой, локализованной в мембране, которая перекачивает протоны из цитозоля в лизосому в обмен на ион натрия. В лизосомах деградируют бактерии, клеточные органеллы (митохондрии), клеточные белки, имеющие на N-конце сигнальную последовательность (Лиз-Фен-Глу-Арг-Глн), поступающие из внеклеточного пространства путем эндоцитоза или пиноцитоза, липопротеины, пептидные гормоны. Свободные белки и содержащиеся в составе полимолекулярных комплексов, гидролизуются лизосомальными протеазами (катепсины) до свободных аминокислот. Небелковые компоненты сложных белков расщепляются другими кислыми гидролазами.
Протеасомы представлены РНК - белковым комплексом в форме бочонка с коэффициентом седиментации 20 S. С торцов бочонок запирается белковыми 19 S-частицами. В протеасомах деградируют «состарившиеся» внутриклеточные белки, участвующие в регуляторных процессах, а также белки образованные в результате неправильной транскрипции. Такие белки метятся путем образования ковалентного комплекса с низкомолекулярным белком убиквитином. Убиквитин присоединяется к остатку лизина на N-конце белка при участии фермента убиквитинлигазы. Комплекс убиквитин-белок узнается 19 S-частицей (с потреблением АТФ) и поступает внутрь протеасомы, где белок подвергается гидролизу с участием ферментов образующих тело бочонка. Убиквитин не гидролизуется и после активации может использоваться снова.
Избирательный протеолиз осуществляется и в других клеточных компартментах. Например, в процессе синтеза белка на рибосоме сначала образуется первичный полипептид несущий на N-конце сигнальную последовательность, определяющую адрес его доставки. Далее сигнальная последовательность удаляется после гидролиза протеиназой. Избирательный протеолиз используется при образовании пептидных гормонов из более длинных молекул предшественниц.
Ещё одним местом использования избирательного протеолиза является кровь. Белковые факторы свертывания крови являются неактивными формами протеолитических ферментов. При запускании механизма свертывания крови идет последовательное активирование факторов свертывания по механизму цепных реакций.
|
|
Протеолиз используется для реализации программируемой смерти клеток – апоптоза. В осуществлении этой программы участвует каскад сериновых протеаз – каспаз. Эти ферменты расположены в различных частях клетки. До запуска программы апоптоза эти белки существуют в виде неактивных предшественников – прокаспаз. Каспазы расщепляют различные клеточные белки (прокаспазы, антиапоптозные белки, ингибитор ДНК-азы и другие) после остатка аспартата.
Деградация белков внеклеточного матрикса и базальных мембран (коллаген, ламинин, фибронектин, протеогликаны и другие) осуществляется Zn-зависимыми металлопротеиназами (коллагеназы, желатиназы, стромелизины, металлоэластаза и другие). Эти ферменты, разрушая макромолекулы внеклеточного матрикса, участвуют в ремоделировании тканей сопровождающем различные физиологические и патологические процессы.
Вопросы к разделу «Протеолиз белков в клетке и
внеклеточном пространстве»
1. Где (в клетке) осуществляется полный протеолиз белков?
2. Оптимальный рН для катепсинов, механизмы его создания и поддержания.
3. Механизмы протеасомального гидролиза белков.
4. Опишите роль убиквитина в протеолизе внутриклеточных белков.
5. Охарактеризуйте роль каспаз в клетке.
6. Назовите ферменты, участвующие в деградации белков внеклеточного матрикса?
Гниение белков в ЖКТ
Некоторые пищевые белки не гидролизуются ферментами ЖКТ, либо вследствие особенности их структуры (кератин волос), либо из-за плохой доступности (белки растительных клеток) для ферментов ЖКТ. Такие белки поступают в толстый кишечник, где частично утилизируются содержащейся там микрофлорой. В толстый кишечник могут поступать и свободные аминокислоты (при усиленной перистальтике кишечника аминокислоты не успевают реабсорбироваться). В результате микробного воздействия на белки и аминокислоты образуются различные метаболиты, в том числе и токсичные для организма человека продукты гниения. Так при декарбоксилировании лизина образуется кадаверин, а при декарбоксилировании орнитина – путресцин.
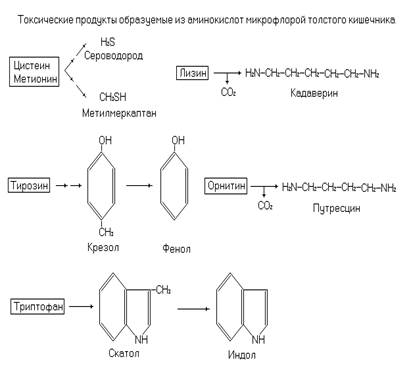
Рис. 2. Токсические продукты, образующиеся из аминокислот с участием микрофлоры кишечника.
Тирозин декарбоксилируется в тирамин. В результате распада серосодержащих аминокислот (цистеин, метионин) образуется сероводород Н2S и метилмеркаптан CH3SH. Из тирозина образуются крезол и фенол, а из триптофана скатол и индол. Продукты гниения, образовавшиеся в этих процессах, частично всасываются в кровь и через воротную вену поступают в печень.
Печень – главное место обезвреживания токсичных веществ, в том числе и продуктов гниения белков в кишечнике. Детоксикация в печени осуществляется путем образования коньюгатов: с глицином, серной и глюкуроновой кислотами или через микросомальное окисление системой цитохрома P 450. Индол окисляется в индоксил, а затем взаимодействует с 3¢-фосфоаденозин-5¢-фосфосульфатом (ФАФС), образуя индоксилсерную кислоту. Глюкуроновая кислота участвует в реакциях коньюгации в активной форме – УДФ-глюкуроновой кислоты.
Вопросы к разделу «Гниение белков в ЖКТ»
1. Какие токсические продукты, и из каких аминокислот образуются под действием микрофлоры толстого кишечника?
2. Где и как осуществляется детоксикация продуктов гниения аминокислот?
3. Напишите реакцию образования индоксилсерной кислоты.
Вопросы к разделу
«Трансаминирование и дезаминирование аминокислот»
1. Напишите реакцию окислительного дезаминирования глутаминовой кислоты. Объясните роль этой реакции в обмене аминокислот.
2. Реакции трансаминирования, коллекторная функция a- кетоглутарата, механизм реакций. Медицинское значение определения активности трансаминаз.
3. Напишите аспартатаминотрансферазную реакцию. Назовите патологии, при которых активность аспартатаминотрансферазы в крови возрастает.
4. Напишите аланинаминотрансферазную реакцию. Назовите патологии, вызывающие повышение активности аланинаминотрансферазы в крови.
5. Причины токсичности аммиака для организма? Обезвреживание аммиака в нервной ткани.
6. Обезвреживание аммиака в мышцах – глюкозо-аланиновый цикл.
7. Особенности обезвреживания аммиака в почке.
В организме
Только небольшая часть азота организма (менее 10%) выводится из него в виде аммиака (через ЖКТ), солей аммония (в составе мочи) и низкомолекулярных соединений (мочевая кислота, креатинин и др.). Свыше 90% выводимого азота организма человека и других млекопитающих трансформируется в мочевину. По этому признаку млекопитающие относят к уреотелическим организмам.
У птиц, рептилий и амфибий основным конечным продуктом азотистого обмена является мочевая кислота. Это урикотелические организмы.
Рыбы относятся к аммониотелическим организмам, так как конечным продуктом азотистого обмена у них является аммиак.
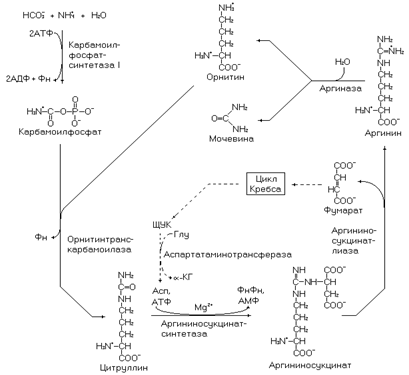
Рис. 5. Орнитиновый цикл.
Окончательное обезвреживание аммиака в организме человека осуществляется в орнитиновом цикле – в печени. В печень поступает аммиак реабсорбированный из ЖКТ, крови и в составе аминогрупп аминокислот. Как отмечалось выше, азот аминокислот (в реакциях трансаминирования) включается в a-кетокислоты. Коллекторную функцию по сбору аминогрупп большинства аминокислот выполняет a-кетоглутарат, присоединяя аминогруппу от аминокислоты он превращается в глутамат. Глутамат (в печени) дезаминируется глутаматдегидрогеназой до a-кетоглутарата и аммиака. Эта реакция происходит в матриксе митохондрий, далее аммиак вступает на путь синтеза мочевины – орнитиновый цикл. Основная часть мочевины организма (95%) синтезируется в печени, остальная образуется в корковом веществе почки.
Первые две реакции орнитинового цикла происходят в митохондриях, последующие в цитозоле. Высокая активность митохондриальных ферментов цикла характерна для гепатоцитов. Для действия карбамоилфосфатсинтетазы 1 – фермента катализирующего первую реакцию пути необходим в качестве активатора N-ацетилглутамат. В клетках почки активность митохондриальных ферментов синтеза мочевины несущественна и, следовательно, процесс образования мочевины в этих структурах линейный (идет в присутствии цитруллина или аргинина). Энергетические затраты на синтез одной молекулы мочевины составляют 4 АТФ (при использовании всех реакций орнитинового цикла) и 2 АТФ если осуществляются только реакции протекающие в цитозоле.
Через фумарат орнитиновый цикл связан с циклом Кребса. Фумарат (в цикле Кребса) преобразуется до ЩУК, который превращается в аспарагиновую кислоту в реакции трансаминирования с глутаматом (на рисунке 5 эти реакции отмечены штрихом). Таким образом, осуществляется ресинтез аспарагиновой кислоты, участвующей в орнитиновом цикле. Следовательно, можно считать, что синтезированная в цикле мочевина содержит два атома азота из глутамата и карбонильную группу, происходящую из бикарбоната.
Недостаточная активность ферментов (генетический дефект) орнитинового цикла приводит к нескольким видам патологии.
Гипераммониемия типа 1 связана с дефектом фермента карбамоилфосфатсинтетазы 1. При этом дефекте новорожденный погибает в первые сутки жизни вследствие отравления аммиаком.
Активность карбамоилфосфатсинтетазы 1 снижается при гриппе и ряде вирусных респираторных заболеваний.
Чаще встречается гипераммониемия типа 2. При этой форме заболевания дефектен фермент орнитинкарбомоилтрансфераза. В крови возрастает содержание аммиака, глутамина и аланина, в моче появляется оротовая кислота. Заболевание сопровождается снижением толерантности к белкам и гипотонии.
Существуют ещё три типа наследственных патологий: цитруллинемия, аргининосукцинатурия, и гипераргинемия (соответственно дефектны аргининосукцинатсинтетаза, аргининосукцинатлиаза и аргиназа).
Вопросы к разделу «Окончательное обезвреживание аммиака в организме»
1. Топография орнитинового цикла в организме и клетке. Напишите реакции орнитинового цикла характерные для коркового вещества почки. Подсчитайте биоэнергетику процесса.
2. Докажите, происхождение обоих атомов азота мочевины из глутамата.
3. Ресинтезируйте аспартат из фумаровой кислоты образованной в орнитиновом цикле. Объясните значение этого процесса для организма.
В цикле Кребса
Окисление безазотистых остатков аминокислот происходит в цикле Кребса, после их преобразования в тот или иной промежуточный интермедиат этого метаболического пути. Дезаминирование аспартата и глутамата осуществляется в одну реакцию, для других аминокислот, через несколько реакций.
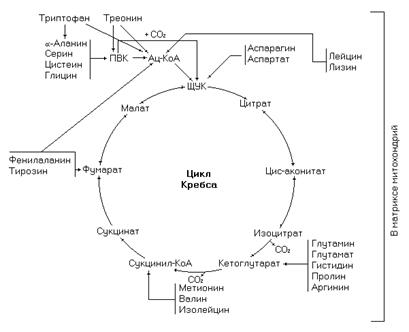
Рис. 6. Поступление продуктов катаболизма протеиногенных аминокислот в цикл Кребса.
Большинство аминокислот поступает в цикл Кребса в виде одного продукта, но есть и такие, углеродный скелет которых поступает в цикл в виде двух продуктов: треонин, фенилаланин, тирозин, триптофан.
Метаболические пути, в результате работы которых аминокислоты превращаются в промежуточные продукты цикла Кребса, описаны в обменах отдельных аминокислот (см. далее).
В процессе окисления безазотистых остатков аминокислот в цикле Кребса образуются восстановленные формы коферментов (НАДН + Н+ и ФАДН2, восстановительные эквиваленты), отдающих электроны и протоны в дыхательную цепь (цепь переноса электронов – ЦПЭ). Электроны и протоны переносятся на молекулярный кислород с образованием молекулы воды, а часть выделившейся при этом энергии расходуется на синтез АТФ (окислительное фосфорилирование).
Восстановленные коферменты, отдавая электроны и протоны в ЦПЭ, переходят в окисленные формы и могут снова участвовать в реакциях цикла Кребса. На 1 моль НАДН + Н+, поступивших в дыхательную цепь синтезируется 2,5 моль АТФ, а на 1 моль ФАДН2 – 1,5 моль АТФ [7, 15]. Гидролиз нуклеозидтрифосфатов (участвующих в катаболизме аминокислоты) может идти до нуклеозиддифосфата и фосфорильной группы (1 АТФ) или до нуклеозидмонофосфата и пирофосфата - 2 АТФ (связано с утратой 2 макроэргических связей). Биоэнергетика окисления аминокислот подсчитывается как алгебраическая сумма молекул приравненных к АТФ (участвующих в процессе окисления аминокислоты). Подсчитанная энергия составляет только часть полученной или затраченной в процессе катаболизма аминокислоты.
Таблица 2
Основные конечные продукты катаболизма аминокислот
| Конечный продукт катаболизма | Место образования | Метаболический путь или реакция |
| Мочевина Н2О СО2 NН4+ | Печень, почки - митохондрии, цитозоль Клетки всех органов Клетки всех органов – матрикс митохондрий Клетки вех органов – цитозоль, митохондрии | Орнитиновый цикл Дыхательная цепь Цикл Кребса, декарбоксилирование аминокислот Реакции дезаминирования |
Конечными продуктами окисления большинства аминокислот являются: СО2, Н2О, аммиак, мочевина. Кроме перечисленных соединений некоторые аминокислоты образуют сульфаты (цистеин и метионин) и фосфаты (фосфосерин, фосфотреонин, фосфотирозин).
В ряде случаев аминокислоты деградируют только частично. В частности гистидин может окисляться до гидантоин-5-пропионовой кислоты (удаляется с мочой).
Таким образом, полное окисление молекулы аминокислоты до конечных продуктов обмена включает в себя:
1. Потерю аминогруппы
2. Преобразование безазотистого остатка аминокислоты в промежуточный продукт цикла Кребса
3. Окисление промежуточного продукта в цикле Кребса.
4. Поступление восстановительных эквивалентов из цикла Кребса в дыхательную цепь, образование воды и АТФ.
Вопросы к разделу «Окисление углеродных скелетов аминокислот в цикле Кребса»
1. Назовите аминокислоты, которые превращаются в пировиноградную кислоту, а в цикл Кребса поступают в форме ацетил-КоА или оксалоацетата.
2. Назовите аминокислоты, поступающие в цикл Кребса в форме двух продуктов.
3. Назовите аминокислоты, поступающие в цикл Кребса в виде a-кетоглутарата.
4. Каким образом энергия окисления углеродных скелетов аминокислот в цикле Кребса трансформируется в энергию связей в АТФ.
5. Назовите основные, конечные продукты окисления аминокислот, места их образования.
6. Назовите минорные, конечные продукты окисления аминокислот.
АНАБОЛИЗМ АМИНОКИСЛОТ
Задания к разделу «Глюконеогенез из аминокислот»
Задание 1
Основные места синтеза глюкозы – это печень и почки. В мышцах присутствуют почти все ферменты синтеза глюкозы кроме одного.
1. Назовите фермент глюконеогенеза отсутствующий в мышцах.
2. Какой углевод синтезируется в мышце с участием имеющихся там ферментов глюконеогенеза и дополнительных. Синтезируйте этот углевод из промежуточного продукта катаболизма серина. Подсчитайте биоэнергетику процесса.
Задание 2
Прежде чем вступить в глюконеогенез безазотистые остатки гликогенных аминокислот поступают в цикл Кребса.
1. Зачем углеродные скелеты аминокислот поступают в цикл Кребса?
2. Какой продукт цикла Кребса транспортируется из митохондрий в цитозоль для дальнейшего участия в глюконеогенезе?
Задание 3
Регуляция синтеза глюкозы осуществляется на метаболическом уровне и нейро-гуморально. Назовите ключевой фермент глюконеогенеза, и эффекторы, участвующие в регуляции его активности. Назовите гормоны, косвенно стимулирующие вхождение углеродных скелетов аминокислот в глюконеогенез. Опишите механизм действия этих гормонов.
Задание 4
Одним из нарушений обмена веществ сопутствующих сахарному диабету является усиление глюконеогенеза из аминокислот.
1. Почему происходит усиление глюконеогенеза при сахарном диабете?
2. Содержание, какого не углеводного продукта в крови увеличивается при интенсификации глюконеогенеза из аминокислот?
Обмен a -аланина
a-Аланин – гликогенная, заменимая аминокислота с гидрофобным радикалом.
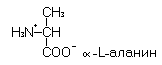
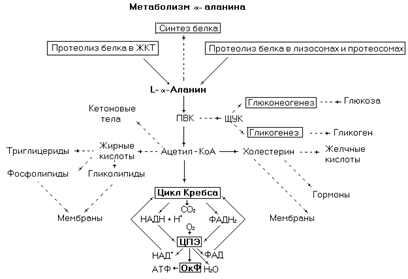
Рис. 10. Метаболические превращения a-аланина в организме человека.
По распространенности в белках эта аминокислота уступает только глицину. В организм человека a-аланин поступает с пищей, образуется в процессе протеолиза эндогенных белков, синтезируется из пировиноградной кислоты при трансаминировании с глутаматом.
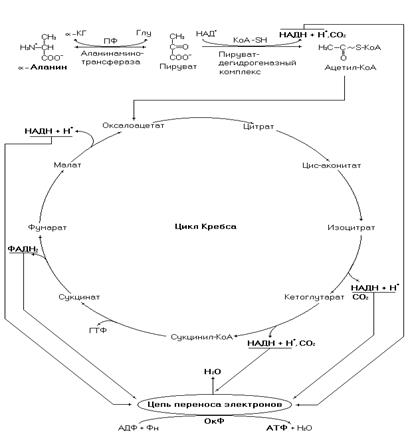
Рис. 11. Катаболизм a-аланина.
Биоэнергетика полного окисления a-аланина составит 8,5 молекул АТФ (с учетом затрат на нейтрализацию аммиака в орнитиновом цикле).
В метаболическом отношении по сравнению с другими аминокислотами a-аланин относительно инертен. Он участвует в синтезе белков и биологически активных пептидов, но в реакциях вторичных метаболических путей участвует плохо. Однако, вследствие высокого содержания этой аминокислоты в организме и белках пищи, часто используется её углеродный скелет. Основной промежуточный продукт её катаболизма – пируват, который может окисляться до конечных продуктов, участвовать в синтезе углеводов, а после деградации до ацетил-КоА в синтезе липидов.
Синтез a-аланина осуществляется из пировиноградной кислоты (промежуточный продукт катаболизма углеводов, белков и глицерина) за счет обращения реакции катализируемой аланинаминотрансферазой.
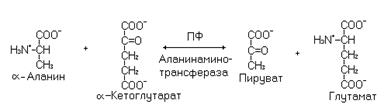
a-Аланин участвует во временном обезвреживании аммиака в мышечной ткани (глюкозо-аланиновый цикл). Эта аминокислота образуется в мышцах в результате трансаминирования пирувата с глутаматом. Источником пирувата в этом случае, главным образом, являются углеводы.
Задания к разделу «Обмен a-аланина»
Задание 1
В мышцах a-аланин участвует в работе глюкозо-аланинового цикла. Напишите реакции этого цикла (схема) и объясните его биологическую роль.
Задание 2
Назовите небелковые источники углеродных атомов для синтеза a-аланина. Напишите реакции синтеза аминокислоты из продукта, образующегося при гидролизе нейтральных жиров. Подсчитайте биоэнергетику процесса.
Задание 3
Получите b-аланин из a-аланина. Подсказка – синтез пойдет через образование аминокислоты содержащей 4 углеродных атома.
Обмен глицина
Глицин – гликогенная, заменимая аминокислота. В виду отсутствия хирального центра не образует оптических изомеров.
 Глицин
Глицин
Одна из простейших аминокислот, в значительных количествах содержится в составе белков. В коллагене его содержание составляет до 30% от остальных аминокислот. В этом белке глицин входит в состав повторяющейся последовательности Гли – X – Y, где Х чаще всего пролин или гидроксипролин, а Y - a-аланин или другая аминокислота. Глицин образуется при гидролизе пищевых белков в ЖКТ, внутриклеточном протеолизе эндогенных белков, из серина, треонина и в глицинсинтазной реакции. Основным направлением использования глицина является синтез белка.
В головном мозге глицин выполняет функцию нейромедиатора. Вместе с глутаминовой кислотой и цистеином принимает участие в синтезе биологически активного пептида – глутатиона.
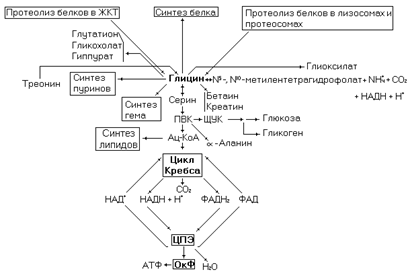
Рис. 12. Метаболические превращения глицина.
Основной путь катаболизма глицина происходит через глицинсинтазную обратимую реакцию (через эту реакцию осуществляется и синтез глицина).
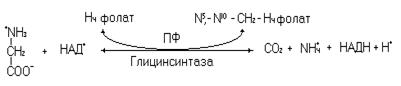
Приведенная выше реакция осуществляется мультиферментным комплексом в митохондриях. Меньшая часть глицина метаболизирует через превращение в серин и далее до ацетил-КоА, в виде которого углеродный скелет аминокислоты поступает в цикл Кребса для дальнейшего окисления.
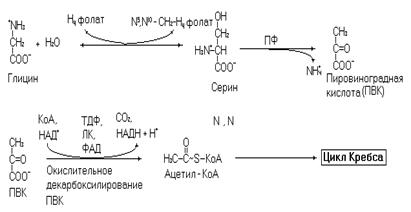
Рис. 13. Катаболизм глицина через серин.
Биоэнергетика окисления глицина по этому пути составит 8,5 молекул АТФ (с учетом затрат на нейтрализацию аммиака через орнитиновый цикл).
Пировиноградная кислота, образующаяся в приведенной последовательности реакций, может использоваться в реакциях анаболизма, в частности, синтезе глюкозы (глюконеогенез) и её производных (уроновые кислоты, аминосахара, гексозы, гликопротеиды, гликолипиды, гликозоаминогликаны) синтезе гликогена (гликогенез) и a-аланина.
Через глюкозу обмен глицина может сопрягаться (через пентозофосфатный путь) с обменом нуклеотидов и нуклеиновых кислот.
Карбоксилирование пирувата ферментом пируваткарбоксилазой приводит к образованию ЩУК, а из неё образуются аспартат и аспарагин. Ацетил-КоА (образуется при окислительном декарбоксилировании ПВК в митохондриях) может вступать на путь синтеза жирных кислот, кетоновых тел, холестерола, а также их производных. Глицерофосфолипиды и холестерол используются на построение клеточных мембран, синтез гормонов (стероидные гормоны), органических осмолитов (глицерофосфохолин), желчных кислот (холевая, таурохолевая, гликохолевая), вторичных мессенджеров (диацилглицерол) и других продуктов.
Глицин участвует в работе сукцинат-глицинового цикла.
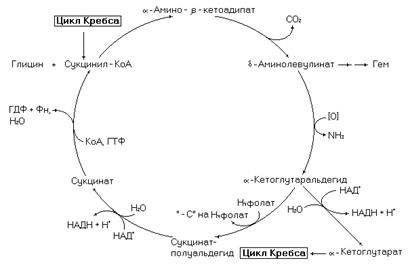
Рис. 14. Сукцинат-глициновый цикл.
Этот метаболический путь связан с циклом Кребса и необходим для синтеза гема. Реакции цикла начинаются с конденсации глицина с сукцинил-КоА и завершаются образованием сукцинил-КоА. Процесс становится линейным в случае использования d-аминолевулината (промежуточный продукт цикла) в синтезе гема. С циклом Кребса этот метаболический путь связан через такие промежуточные продукты как сукцинил-КоА и a-кетоглутарат.
Глицин участвует в нейтрализации некоторых соединений путем образования коньюгатов.
Коньюгация глицина с холевой кислотой в печени приводит к образованию гликохолата участвующего в эмульгировании жиров в ЖКТ и всасывании продуктов гидролиза. Другая парная

Рис. 16. Синтез гиппуровой кислоты.
желчная кислота – таурохолевая синтезируется из таурина (продукт превращения глицина).
Глицин участвует в синтезе креатинфосфата. Креатинфосфат – макроэргический фосфат, участвует в транспорте фосфорильной группы в миофибриллы и рефосфорилировании АДФ до АТФ. Синтез креатинфосфата осуществляется в почках и печени, а используется и деградирует он в мышцах. В мышцах креатинфосфат может спонтанно дегидратироваться и дефосфорилироваться без участия ферментов, превращаясь в креатинин. Креатинин выделяется из организма с мочой, и его концентрация в ней зависит от мышечной массы человека и интенсивности физической работы.
Глицин участвует в нейтрализации некоторых соединений путем образования коньюгатов. В частности коньюгация глицина с активной формой бензойной кислоты приводит к образованию гиппуровой кислоты.
Важным направлением метаболизма глицина является его участие в синтезе пуриновых азотистых оснований.
При нарушении обмена глицина развивается глицинурия и первичная гипероксалурия. При глицинурии уровень глицина в плазме крови нормальный, а экскреция глицина с мочой может
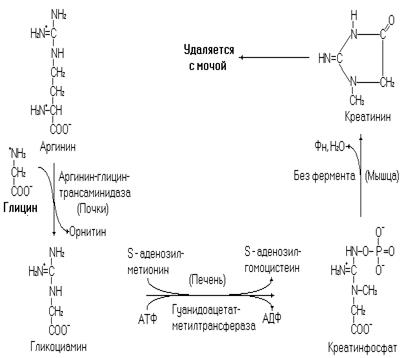
Рис. 15. Синтез креатинфосфата.
достигать 1 г в сутки. Предположительно дефект связан с нарушением реабсорбции аминокислоты в нефронах.
Первичная гипероксалурия характеризуется повышенным выделением с мочой щавелевой кислоты (оксалата) независимо от поступления оксалата с пищей. При этом заболевании отмечается отложение оксалатных камней в мочевыводящих путях, развивается нефрокальциноз и рецидивирующая инфекция мочевыводящих путей. Возникающая далее почечная недостаточность и гипертония приводят к смерти в раннем возрасте. При этом заболевании нарушена активность глицинтрансаминазы и нарушено окисление глиоксилата в формиат. Глиоксилат образуется при дезаминировании глицина, в дальнейшем глиоксилат окисляется в оксалат, избыток которого и приводит к поражению почек (мочекаменная болезнь).
Задания к разделу «Обмен глицина»
Задание 1
Напишите реакцию, катализируемую глицинсинтазой. Напишите схему утилизации аммиака и углекислого газа, образующихся в этой реакции.
Задание 2
Напишите реакции синтеза креатинфосфата с участием глицина. Охарактеризуйте роль креатинфосфата в организме. В виде какого конечного продукта удаляется из организма креатинфосфат?
Задание 3
Глицин участвует в синтезе биологически активного трипептида. Напишите структуру этого трипептида, объясните его роль в эритроцитах.
Задание 4
Какая патология обмена глицина сопровождается повышенной экскрецией глицина с мочой при нормальном его содержании в крови? Назовите возможную причину возникновения данной патологии.
Задание 5
Сукцинат-глициновый цикл начинается с конденсации глицина с сукцинил-КоА в реакции катализируемой d-аминолевулинатсинтазой. Напишите эту реакцию. Сколько углеродных атомов глицина поступит в состав d-аминолевулината.
Задание 6
Напишите процессы обезвреживания токсичных для организма продуктов с участием глицина. Назовите пути удаления глициновых коньюгатов.
Обмен серина
Серин – заменимая гликогенная аминокислота, по свойствам радикала относящаяся к группе аминокислот с полярными, незаряженными радикалами.
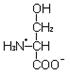 L-серин
L-серин
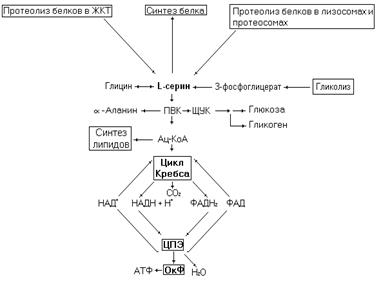
Рис. 17. Метаболические превращения серина.
Серин поступает в обменный пул в результате гидролиза экзогенных и эндогенных белков, синт
|
|
|

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!