

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
Топ:
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Кипением называется процесс образования пузырьков пара по всему объёму жидкости. При повышении температуры жидкости происходит повышение давления пара над ней. Процесс кипения начинается при достижении давлением пара над жидкостью атмосферного давления.
В процессе кипения чистых жидкостей температура остаётся постоянной. При температуре кипения чистая жидкость полностью переходит в газообразное состояние.
Температура кипения жидких смесей зависит от состава смеси, она не остаётся постоянной в процессе кипения.
Зависимость температуры кипения бинарных жидких смесей от состава смеси описывается диаграммами кипения. В основе диаграмм лежит ось составов, на которой откладывается мольная (или массовая) доля одного из компонентов смеси:
Диаграмма кипения состоит из двух линий (Рис. 2.1.). Нижняя линия (I) соответствует температурам кипения жидкости, а верхняя (II) – составу газовой фазы.
Область диаграммы ниже кривой кипения соответствует гомогенному жидкому состоянию системы.
Область выше кривой давления пара – гомогенному газообразному.
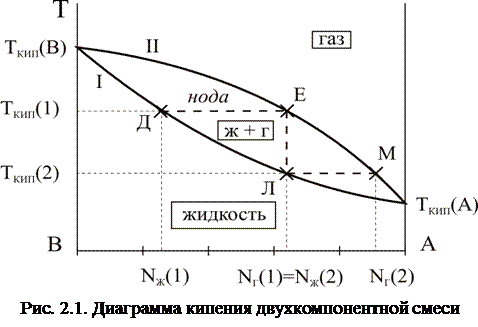
Область между кривыми соответствует гетерогенному состоянию системы при котором в равновесии находятся жидкая и газообразная фазы.
Точки диаграммы на осях чистых компонентов соответствуют температурам их кипения.
Кипение смеси состава NЖ(1) начинается при температуре TКИП(1) (точка Д).
Для определения состава газовой фазы в этой точке нужно провести горизонтальную линию (ноду) до пересечения с линией состава газовой фазы (точка Е).
Нодой называется горизонтальная линия, пересекающая ближайшие линии диаграммы. Точки пересечения ноды с линиями диаграммы соответствуют составам жидкой и газообразной фаз (Рис. 2.1.).
|
|
Как видно из рисунка, составы жидкой и газовой фаз при одной и той же температуре различны, причём газовая фаза оказывается обогащена более летучим компонентом (TКИП(A) < TКИП(B)).
Если газ состава NГ(1) сконденсировать, то получится жидкость того же состава (точка Л) NГ(1) = NЖ(2).
Эта жидкость будет кипеть при температуре TКИП(2) (точка М), а равновесная с ней газовая фаза снова обогатиться более летучим компонентом A (NГ(2) > NЖ(2)).
Таким образом, при последовательных закипаниях и конденсациях происходит все большее и большее обогащение газовой фазы более летучим компонентом вплоть до получения его в чистом виде. Состав жидкой фазы при этом постепенно обогащается менее летучим компонентом, а температура её кипения повышается.
Описанный принцип лежит в основе разделения жидкостей методом фракционной перегонки. В результате фракционной перегонки весь легколетучий компонент переходит в газовую фазу и затем конденсируется, а труднолетучий компонент в чистом виде остаётся в жидкой фазе.
Принцип фракционной перегонки лежит в основе работы ректификационных колон в которых температура газовой смеси постепенно понижается по мере продвижения вверх колоны благодаря чему достигается непрерывное обогащение газовой фазы более летучим компонентом.
В случае значительных отклонений от идеальности на диаграммах кипения появляются минимумы (в случае положительных отклонений от закона Рауля) (Рис. 2.2.) и максимумы (в случае отрицательных отклонений) (Рис. 2.3.).
 | |||
 | |||
Точки соприкосновения нижних и верхних кривых называются азеотропными точками, а состав смеси, соответствующий этим точкам – азеотропным составом.
В азеотропных точках составы жидкой и газообразной фаз одинаковы, поэтому азеотропные смеси ведут себя как индивидуальные жидкости т.е. кипят при постоянной температуре.
Компоненты азеотропных смесей не могут быть разделены методом перегонки. Для их разделения требуется химическое связывание одного из компонентов смеси. Так, например, этиловый спирт образует с водой азеотропную смесь с содержанием этанола 95,57%, концентрация которой не может быть повышена путём перегонки.
|
|
Метод перегонки широко применяется для разделения и очистки жидкостей в нефтехимической, химической и пищевой промышленности. В частности при получении этилового спирта, уксусной кислоты, подсолнечного масла.
Наряду с обычной фракционной перегонкой применяются другие разновидности этого процесса:
Перегонка под вакуумом. При понижении давления происходит снижение температур кипения всех жидкостей, поэтому их перегонка может осуществляться при гораздо более низких температурах. Перегонка под вакуумом требует намного меньшего расхода энергии, кроме того, применение этого способа необходимо при перегонке термически неустойчивых продуктов. Основным недостатком перегонки под вакуумом является необходимость применения специального герметичного вакуумного оборудования. Разновидностью перегонки под вакуумом является вакуумная сушка.
Этот способ перегонки применяется при производстве сгущенного молока и сливок, сахара, растворимого кофе и чая.
Перегонка с водяным паром осуществляется путём пропускания горячего водяного пара через слой несмешивающейся с водой жидкости. При этом в газовой фазе оказываются как пары воды, так и перегоняемой жидкости. После конденсации жидкости снова расслаиваются. Сущность метода заключается в том, что температура кипения жидкости в присутствии воды значительно понижается, что позволяет проводить перегонку при более низких температурах, с меньшим расходом энергии и без риска термического разложения перегоняемого вещества.
Перегонку с водяным паром используют для очистки высококипящих несмешивающихся с водой жидкостей.
Рефрактометрический метод
 Рефрактометрический метод основан на изучении явления преломления света.
Рефрактометрический метод основан на изучении явления преломления света.
Преломлением называется изменение угла падения света при прохождении им границы раздела двух оптически прозрачных сред (Рис. 2.4.).
Причиной преломления является то, что электромагнитное поле, носителем которого является свет, вызывает смещение электронных оболочек молекул веществ относительно ядер атомов, что приводит к поляризации молекул.
|
|
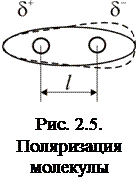 Поляризацией называется смещение центра отрицательного заряда молекулы, относительно центра её положительного заряда. В результате поляризации неполярные молекулы становятся полярными (превращается в диполь – приобретают дипольный момент), а для полярных – происходит увеличение дипольного момента. На Рис. 2.5. показана схема поляризации неполярной молекулы (пунктиром показано смещение электронной плотности в результате поляризации).
Поляризацией называется смещение центра отрицательного заряда молекулы, относительно центра её положительного заряда. В результате поляризации неполярные молекулы становятся полярными (превращается в диполь – приобретают дипольный момент), а для полярных – происходит увеличение дипольного момента. На Рис. 2.5. показана схема поляризации неполярной молекулы (пунктиром показано смещение электронной плотности в результате поляризации).
Диполем называется полярная молекула.
Дипольным моментом называется произведение длины диполя l на величину его эффективного заряда d+ = d–.
Количественно степень поляризации характеризуется величиной рефракции.
Рефракцией называется электронная поляризация молекулы.
Показатель преломления называется отношение синуса угла падения a к синусу угла преломления b: 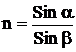 . Величина показателя преломления зависит от длины волны падающего света и от температуры.
. Величина показателя преломления зависит от длины волны падающего света и от температуры.
Величина рефракции связана с величиной показателя преломления соотношением: 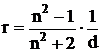 где r – удельная (рассчитанная на единицу массы вещества) рефракция, d – плотность вещества.
где r – удельная (рассчитанная на единицу массы вещества) рефракция, d – плотность вещества.
Удельная рефракция является величиной аддитивной, т.е. рефракция системы, состоящей из нескольких компонентов равна сумме рефракций всех компонентов.
Если система состоит из компонентов A и B то:
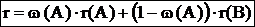
где: w(A) – массовая доля компонента A, r(A) – удельная рефракция чистого компонента A, r(B) – удельная рефракция чистого компонента B.
Таким образом, если известны удельные рефракции (показатели преломления), входящих в смесь компонентов и экспериментально определена рефракция смеси, то можно рассчитать массовую долю компонентов в смеси.
Таким образом, метод рефрактометрии может быть использован для определения концентраций компонентов в растворе.
На практике обычно используют не расчётное уравнение, а справочные таблицы зависимости показателя преломления смеси от её состава. Это связано с тем, что взаимодействие молекул компонентов смеси может привести к существенным отклонениям от правила аддитивности и, соответственно, к нарушению линейности зависимости r = f(w(A)).
|
|
Рефрактометр Аббе
 Основными рабочими частями рефрактометра Аббе (Рис. 2.6.) являются осветительная (1) и измерительная (3) призмы. Между призмами помещается тонкий слой, анализируемой жидкости (2).
Основными рабочими частями рефрактометра Аббе (Рис. 2.6.) являются осветительная (1) и измерительная (3) призмы. Между призмами помещается тонкий слой, анализируемой жидкости (2).
Осветительная призма позволяет выделить из всего спектра желтую линия спектра натрия для которой и проводятся измерения.
После прохождения призм и слоя анализируемой жидкости, луч попадает в анализатор (4) в котором по положению границы света и тени определяется величина показателя преломления.
Для проведения измерений при постоянной температуре, призмы снабжены водяной рубашкой, через которую прокачивается вода из термостата, и термометром.
Рефрактометрический метод является одним из наиболее распространённых физико-химических методов определения концентраций растворов органических веществ. Его основными достоинствами являются невысокая стоимость оборудования, простота и высокая скорость измерений, минимальный расход анализируемого вещества. Недостатком метода является невозможность определения концентраций при содержании в смеси трёх и большего количества компонентов.
На производствах пищевой промышленности рефрактометрический метод применяется для определения концентрации сахарозы и глюкозы в растворе, состава смесей этанол-вода, глицерин-вода и др.
|
|
|

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!