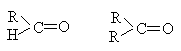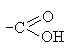Пространственное строение органических соединений. Конфигурация и конформация – важнейшие понятия стереохимии. Способы изображения пространственного строения молекул, молекулярные молекулы и формулы. D, L и R, S – системы номенклатуры.
Пространственная изомерия или стереоизомерия – это вид изомерии, при котором изомеры или стереоизомеры отличаются друг от друга пространственным расположением атомов или групп атомов в молекуле.
Стереоизомерия делится на следующие виды:
1) конформационная;
2) энантиомерия (оптическая изомерия);
3) диастереомерия (геометрическая изомерия). Она, в свою очередь, подразделяется на:
а) δ (сигма)-диастереомерию;
б) π(пи)-диастереомерию.
Для описания пространственных различий используют два важнейших понятия: конфигурация и конформация молекул.
Конфигурация – определенное пространственное расположение атомов в молекуле, без учета различий, возникающих вследствие вращения вокруг одинарных связей.
В основе пространственного строения лежит предположение Вант-Гоффа (1874 г) о тетраэдрической конфигурации атома углерода, которое впоследствии было полностью подтверждено. Если у атома углерода все четыре заместителя одинаковые, то пространственная модель - тетраэдр, валентный угол – 109,50. Если заместители разные, то угол несколько отличается от нормального. На плоскости обычно изображают атом углерода и две связи. Связь, направленную к наблюдателю показывают жирной чертой, от наблюдателя за плоскостью — пунктирной или заштрихованной линией.
Давно было выдвинуто предположение о свободном вращении атомов вокруг простых одинарных связей, так возникло представление о конформациях – динамических изомерах (конформерах), отличающихся друг от друга пространственным расположением атомов в одной и той же конфигурации. Взаимные переходы конформеров могут осуществляться только в итоге вращения связей, но не их разрыва.
Термин конформация был предложен в 1929 году Хеуорсом, В широком смысле его используют в тех случаях, когда необходимо обозначить одно из бесчисленного множества моментальных расположений атомов в пространстве, которые возникают в результате вращения вокруг одинарных связей,
Конформации молекулы представляют собой различные ее геометрические формы, возникающие в результате вращения вокруг одинарных связей.
D. L-Система обозначения конфигурации. В начале ХХ в. была предложена система классификации энантиомеров для относительно простых (с позиций стереоизомерии) молекул, таких, как α-аминокислоты, α-гидроксикислоты и им подобные. За конфигурационный стандарт был принят глицериновый альдегид. Его левовращающему энантиомеру была произвольно приписана формула (I). Такая конфигурация атома углерода была обозначена буквой L (от лат. laevus - левый). Правовращающему энантиомеру соответственно была приписана формула (II), а конфигурация обозначена буквой D (от лат. dexter - правый).

d, l-Система в настоящее время применяется для α-аминокислот, гидроксикислот и (с некоторыми дополнениями) для углеводов
R, S-Система обозначения конфигурации. d, L-Система имеет весьма ограниченное применение, так как часто невозможно соотнести конфигурацию какого-либо соединения с глицериновым альдегидом. Универсальной системой обозначения конфигурации центров хиральности является R, S-система (от лат. rectus - прямой, sinister - левый). В ее основе лежит правило последовательности, основанное на старшинстве заместителей, связанных с центром хиральности.
Для определения конфигурации тетраэдрическую модель соединения располагают в пространстве так, чтобы самый младший заместитель (в большинстве случаев это атом водорода) был наиболее удален от наблюдателя. Если старшинство трех остальных заместителей убывает по часовой стрелке, то центру хиральности приписывают R-конфигурацию (рис. 7.4, а), если против часовой стрелки - S -конфигурацию (см. рис. 7.4, б), как это видно водителю, находящемуся за рулем.
Для обозначения конфигурации по RS-системе можно применить проекции Фишера. Для этого проекцию преобразуют так, чтобы младший заместитель разместился на одной из вертикальных связей, что соответствует его положению за плоскостью чертежа. Если после преобразования проекции старшинство остальных трех заместителей убывает по часовой стрелке, то асимметрический атом имеет R-конфигурацию, и наоборот.
Между d, l - и RS-системами отсутствует корреляция: это два разных подхода к обозначению конфигурации хиральных центров. Если в d, L-системе сходные по конфигурации соединения образуют стерео- химические ряды, то в RS-системе хиральные центры в соединениях, например, l-ряда, могут иметь как R -, так и S-конфигурацию.
Диастереомерию
σ—диастереомерия
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ и π-диастереомеры. σ-диастериомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастериомеры являются (+)-винная кислота и мезовинная кислота, D-глюкоза и D-манноза, например:
Для некоторых типов диастереомерия введены специальные обозначения, например трео- и эритроизомеры — это диастереомерия с двумя асимметрическим атомами углерода и пространств, расположением заместителей у этих атомов, напоминающим соотвующую треозу (родственные заместители находятся по разные стороны в проекционных формулах Фишера) и эритрозу (заместители — по одну сторону):
Эритроизомеры, которых асимметрические атомы связаны с одинаковыми заместителями, называются мезо-формами. Они, в отличие от остальных σ-диастереомеров, оптически неактивны из-за внутримолекулярной компенсации вкладов во вращение плоскости поляризации света двух одинаковых асимметрических центров противоположной конфигурации. Пары диастереомеров, различающиеся конфигурацией одного из нескольких асимметрических атомов, называются эпимерами, например:
Термин «аномеры» обозначает пару диастереомерных моносахаридов, различающихся конфигурацией гликозидного атома в циклической форме, например аномерны α-D- и β-D-глюкозы.
π—диастереомерия (геометрическая изомерия)
π-диастериомерами, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
В простейших случаях номенклатура геометрических изомеров не представляет затруднений: цис- формами называют геометрические изомеры, у которых одинаковые заместители лежат по одну сторону от плоскости пи-связи, транс- изомеры имеют одинаковые заместители на разных сторонах от плоскости пи-связи. В более сложных случаях применяется Z,E-номенклатура. Ее главный принцип: для обозначения конфигурации указывают цис- (Z, от немецкого Zusammen - вместе) или транс- (Е, от немецкого Entgegen - напротив) расположение старших заместителей при двойной связи.
В Z,E-системе старшими считаются заместители с большим атомным номером. Если атомы, непосредственно связанные с ненасыщенными углеродами, одинаковы, то переходят ко "второму слою", в случае необходимости - к "третьему слою" и т.д.
Рассмотрим применение правил Z,E-номенклатуры на двух примерах.

Начнем с формулы I, где все решается атомами "первого слоя". Расставив их атомные номера, получим, что старшие заместители каждой пары (бром в верхней части формулы и азот в нижней) находятся в транс -положении, отсюда следует стереохимические обозначение Е:
 Е-1-бром-1-хлор-2-нитроэтен
Е-1-бром-1-хлор-2-нитроэтен
Для определения стереохимического обозначения структуры II необходимо искать различие в "высших слоях". По первому слою группы СН3, С2Н5, С3Н7 не отличаются. Во втором слое у группы СН3 сумма атомных номеров равна трем (три атома водорода), у групп С2Н5 и С3Н7 - по 8. Значит, группа СН3 не рассматривается - она младше двух других. Таким образом, старшие группы - это С2Н5 и С3Н7, он находятся в цис -положении; стереохимические обозначение Z.
 Z-3-метилгептен-3
Z-3-метилгептен-3
Основные положения теории А. М. Бутлерова
В молекуле существует строгая последовательность химической связанности атомов, которая носит название строения.
Химические свойства вещества определяются составом и строением его молекул.
Так как в конкретных химических реакциях изменяются лишь некоторые части молекулы, то исследование строения продукта реакции помогает судить о строении исходного вещества.
Атомы и их группы в молекуле оказывают взаимное влияние друг на друга. Реакционная способность отдельных атомов молекулы изменяется при изменении их окружения.
Опираясь на положения теории Бутлеров объяснил явление изомерии, предсказал существование некоторых изомеров и некоторые из них сам же получил.
Органическая химия является одной из базовых дисциплин в системе высшего фармацевтического образования. Изучение органической химии направлено на формирование у студентов научных знаний об органическом веществе и современных методах его исследования.
Знание основ биоорганической химии необходимо будущему фармацевту для понимания процессов функционирования биологически важных молекул и лекарственных средств в живых организмах при изучении биологической химии и фармакологии.
Органическая химия является базовой дисциплиной и ставит своей целью формирование знаний теоретических основ химических и инструментальных физико-химических методов анализа веществ и умений их проведения, что необходимо для успешного изучения в дальнейшем фармацевтической химии и токсикологической химии, фармацевтической технологии.
Целью освоения дисциплины является формирование у студентов фармацевтического факультета знаний о закономерностях химического превращения органических соединений во взаимосвязи с их строением; применение данных знаний в фундаментальной и клинической фармакологии, фармхимии, лекарствоведении.
Задачи изучения дисциплины:
· Обучить студентов определять принадлежность соединения к определенным классам и группам на основании знаний классификационных признаков;
· Обучить студентов выделять в молекуле реакционные центры, прогнозировать свойства органического соединения и его поведение в конкретных условиях, исходя из структуры соединения и знания теоретических основ органической химии и типичной реакционной способности функциональных групп.
· Научить прогнозировать возможные пути и условия преобразования функциональных групп в важнейших классах органических соединений.
2.Классификация органических соединений. Функциональная группа и строение углеродного скелета как классификационные признаки органических соединений. Основные классы органических соединений.
Органические соединения классифицируют по двум основным признакам: строению углеродного скелета и функциональным группам.
По строению углеродного скелета различают ациклические, карбоциклические и гетероциклические соединения.
Ациклические соединения – содержат открытую цепь атомов углерода.
Карбоциклические соединения – содержат замкнутую цепь углеродных атомов и подразделяются на алициклические и ароматические. К алициклическим относятся все карбоциклические соединения, кроме ароматических. Ароматические соединения содержат циклогексатриеновый фрагмент (бензольное ядро).
Гетероциклические соединения - содержат циклы, включающие наряду с атомами углерода один или несколько гетероатомов.
По природе функциональных групп органические соединения делят на классы.
Таблица 1. Основные классы органических соединений.
| Функциональная группа
| Класс соединений
| Общая формула
|
| Отсутствует
| Углеводороды
| R-H
|
| Галоген
-F, -Cl, -Br, -I (–Hal)
| Галогенпроизводные
| R-Hal
|
| Гидроксильная
-ОН
| Спирты и фенолы
| R-OH
Ar-OH
|
| Алкоксильная
-OR
| Простые эфиры
| R-OR
|
| Амино
-NH2, >NH, >N-
| Амины
| RNH2, R2NH, R3N
|
| Нитро
-NO2
| Нитросоединения
| RNO2
|
| Карбонильная <p>>c=o <="" center="">
</p>>c=o>
| Альдегиды и кетоны
| 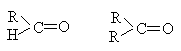
|
Карбоксильная
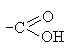
| Карбоновые кислоты
| 
|
Алкоксикарбонильная

| Сложные эфиры
| 
|
Карбоксамидная

| Амиды
карбоновых кислот
| 
|
| Тиольная
-SH
| Тиолы
| R-SH
|
| Сульфо
-SO3H
| Сульфокислоты
| R-SO3H
|
3. Номенклатура органических соединений. Основные принципы номенклатуры ИЮПАК, ЗН, РФН. Принципы построения систематических названий.
В настоящее время в органической химии общепринятой является систематическая номенклатура, разработаннаяМеждународным союзом чистой и прикладной химии (IUPAC). Наряду с ней сохранились и используются тривиальная и рациональная номенклатуры.
Тривиальная номенклатура состоит из исторически сложившихся названий, которые не отражают состава и строения вещества. Они являются случайными и отражают природный источник вещества (молочная кислота, мочевина, кофеин), характерные свойства (глицерин, гремучая кислота), способ получения (пировиноградная кислота, серный эфир), имя первооткрывателя (кетон Михлера, углеводород Чичибабина), область применения (аскорбиновая кислота). Преимуществом тривиальных названий являетсяих лаконичность, поэтому употребление некоторых из них разрешено правилами IUPAC.
Систематическая номенклатура является научной и отражает состав, химическое и пространственное строение соединения. Название соединения выражается при помощи сложного слова, составные части которого отражают определенные элементы строения молекулы вещества.
В основе правил номенклатуры IUPAC лежат принципы заместительной номенклатуры, согласно которой молекулы соединений рассматриваются как производные углеводородов, в которых атомы водорода замещены на другие атомы или группы атомов. При построении названия в молекуле соединения выделяют следующие структурные элементы.
Родоначальная структура – главная цепь углеродная цепь или циклическая структура в карбо- и гетероциклах.
Углеводородный радикал – остаток формульного обозначения углеводорода со свободными валентностями (см. таблицу 2.2).
Характеристическая группа – функциональная группа, связанная с родоначальной структурой или входящая в ее состав (см. таблицу 2.3).
При составлении названия последовательно выполняют следующие правила.
- Определяют старшую характеристическую группу и указывают ее обозначение в суффиксе (см. таблицу 2.3).
- Определяют родоначальную структуру по следующим критериям в порядке падения старшинства: а) содержит старшую характеристическую группу; б) содержит максимальное число характеристических групп; в) содержит максимальное число кратных связей; г) имеет максимальную длину. Родоначальную структуру обозначают в корне названия в соответствии с длиной цепи или размером цикла: С1 – “мет”, С2 – “эт”, С3 – “проп”, С4 – “бут”, С5 и далее – корни греческих числительных.
- Определяют степень насыщенности и отражают ее в суффиксе: “ан” – нет кратных связей, “ен” – двойная связь, “ин” – тройная связь.
- Устанавливают остальные заместители (углеводородные радикалы и младшие характеристические группы) и перечисляют их названия в префиксе в алфавитном порядке.
- Устанавливают умножающие префиксы – “ди”, “три”, “тетра”, указывающие число одинаковых структурных элементов (при перечислении заместителей в алфавитном порядке не учитываются).
- Проводят нумерацию родоначальной структуры так, чтобы старшая характеристическая группа имела наименьший порядковый номер. Локанты (цифры) ставят перед названием родоначальной структуры, перед префиксами и перед суффиксами.

Таблица 2.2. Названия алканов и алкильных радикалов, принятые систематической номенклатурой IUPAC.
| Алкан
| Название
| Алкильный радикал
| Название
|
| CH4
| Метан
| СН3-
| Метил
|
| CH3CH3
| Этан
| CH3CH2-
| Этил
|
| CH3CH2CH3
| Пропан
| CH3CH2CH2-
| Пропил
|

| Изопропил
|
| CH3CH2СН2CH3
| н-Бутан
| CH3CH2СН2CH2-
| н- Бутил
|

| втор- Бутил
|

| Изобутан
| 
| Изобутил
|

| трет- Бутил
|
| CH3CH2СН2CH2СН3
| н-Пентан
| CH3CH2СН2CH2СН2-
| н- Пентил
|

| Изопентан
| 
| Изопентил
|

| Неопентан
| 
| Неопентил
|
Таблица 2.3. Названия характеристических групп (перечислены в порядке убывания старшинства).
| Группа
| Название
|
| в префиксе
| в суффиксе
|
| -(C)OOH*
| -
| овая кислота
|
| -COOH
| карбокси
| карбоновая кислота
|
| -SO3H
| сульфо
| сульфоновая кислота
|
| -(C)HO
| оксо
| аль
|
| -CHO
| формил
| карбальдегид
|
| >(C)=O
| оксо-
| он
|
| -ОН
| гидрокси
| ол
|
| -SH
| меркапто
| тиол
|
| -NH2
| амино
| амин
|
| -OR**
| алкокси, арокси
| -
|
| -F, -Cl, -Br, -I
| фтор, хлор, бром, иод
| -
|
| -NO2
| нитро
| -
|
*Атом углерода, заключенный в скобки, входит в состав родоначальной структуры.
**Алкокси-группы и все следующие за ними перечисляются в префиксе по алфавиту и не имеют порядка старшинства.
Рациональная (радикально-функциональная) номенклатура и спользуется для названий простых моно- и бифункциональных соединений и некоторых классов природных соединений. Основу названия составляет название данного класса соединений или одного из членов гомологического ряда с указанием заместителей. В качестве локантов, как правило, используются греческие буквы.
Главное место в современной номенклатуре орг. соед. занимает заместительная номенклатура. При составлении назв. по номенклатуре ИЮПАК (как и при переводе назв. в структурную ф-лу) последовательно выполняют след. правила: 1) находят осн. характеристич. группу (см. табл.) и выбирают для нее обозначение в суффиксе.
Пространственное строение органических соединений. Конфигурация и конформация – важнейшие понятия стереохимии. Способы изображения пространственного строения молекул, молекулярные молекулы и формулы. D, L и R, S – системы номенклатуры.
Пространственная изомерия или стереоизомерия – это вид изомерии, при котором изомеры или стереоизомеры отличаются друг от друга пространственным расположением атомов или групп атомов в молекуле.
Стереоизомерия делится на следующие виды:
1) конформационная;
2) энантиомерия (оптическая изомерия);
3) диастереомерия (геометрическая изомерия). Она, в свою очередь, подразделяется на:
а) δ (сигма)-диастереомерию;
б) π(пи)-диастереомерию.
Для описания пространственных различий используют два важнейших понятия: конфигурация и конформация молекул.
Конфигурация – определенное пространственное расположение атомов в молекуле, без учета различий, возникающих вследствие вращения вокруг одинарных связей.
В основе пространственного строения лежит предположение Вант-Гоффа (1874 г) о тетраэдрической конфигурации атома углерода, которое впоследствии было полностью подтверждено. Если у атома углерода все четыре заместителя одинаковые, то пространственная модель - тетраэдр, валентный угол – 109,50. Если заместители разные, то угол несколько отличается от нормального. На плоскости обычно изображают атом углерода и две связи. Связь, направленную к наблюдателю показывают жирной чертой, от наблюдателя за плоскостью — пунктирной или заштрихованной линией.
Давно было выдвинуто предположение о свободном вращении атомов вокруг простых одинарных связей, так возникло представление о конформациях – динамических изомерах (конформерах), отличающихся друг от друга пространственным расположением атомов в одной и той же конфигурации. Взаимные переходы конформеров могут осуществляться только в итоге вращения связей, но не их разрыва.
Термин конформация был предложен в 1929 году Хеуорсом, В широком смысле его используют в тех случаях, когда необходимо обозначить одно из бесчисленного множества моментальных расположений атомов в пространстве, которые возникают в результате вращения вокруг одинарных связей,
Конформации молекулы представляют собой различные ее геометрические формы, возникающие в результате вращения вокруг одинарных связей.
D. L-Система обозначения конфигурации. В начале ХХ в. была предложена система классификации энантиомеров для относительно простых (с позиций стереоизомерии) молекул, таких, как α-аминокислоты, α-гидроксикислоты и им подобные. За конфигурационный стандарт был принят глицериновый альдегид. Его левовращающему энантиомеру была произвольно приписана формула (I). Такая конфигурация атома углерода была обозначена буквой L (от лат. laevus - левый). Правовращающему энантиомеру соответственно была приписана формула (II), а конфигурация обозначена буквой D (от лат. dexter - правый).

d, l-Система в настоящее время применяется для α-аминокислот, гидроксикислот и (с некоторыми дополнениями) для углеводов
R, S-Система обозначения конфигурации. d, L-Система имеет весьма ограниченное применение, так как часто невозможно соотнести конфигурацию какого-либо соединения с глицериновым альдегидом. Универсальной системой обозначения конфигурации центров хиральности является R, S-система (от лат. rectus - прямой, sinister - левый). В ее основе лежит правило последовательности, основанное на старшинстве заместителей, связанных с центром хиральности.
Для определения конфигурации тетраэдрическую модель соединения располагают в пространстве так, чтобы самый младший заместитель (в большинстве случаев это атом водорода) был наиболее удален от наблюдателя. Если старшинство трех остальных заместителей убывает по часовой стрелке, то центру хиральности приписывают R-конфигурацию (рис. 7.4, а), если против часовой стрелки - S -конфигурацию (см. рис. 7.4, б), как это видно водителю, находящемуся за рулем.
Для обозначения конфигурации по RS-системе можно применить проекции Фишера. Для этого проекцию преобразуют так, чтобы младший заместитель разместился на одной из вертикальных связей, что соответствует его положению за плоскостью чертежа. Если после преобразования проекции старшинство остальных трех заместителей убывает по часовой стрелке, то асимметрический атом имеет R-конфигурацию, и наоборот.
Между d, l - и RS-системами отсутствует корреляция: это два разных подхода к обозначению конфигурации хиральных центров. Если в d, L-системе сходные по конфигурации соединения образуют стерео- химические ряды, то в RS-системе хиральные центры в соединениях, например, l-ряда, могут иметь как R -, так и S-конфигурацию.







 Е-1-бром-1-хлор-2-нитроэтен
Е-1-бром-1-хлор-2-нитроэтен Z-3-метилгептен-3
Z-3-метилгептен-3