Кроме исследования спектральных свойств в растворах, были исследованы также спектры поглощения и ФЛ изучаемых соединений в твердом состоянии. Такие исследования приближали нас к изучению электролюминесценции.
Немаловажной проблемой при формировании покрытий является образование цепочечных агрегатов, что приводит к возникновению дополнительных полос в красной области спектра ФЛ [303-305]. Кроме того, наличие агрегатов, рассматривается как фактор снижения эффективности люминесценции из–за межцепочечного взаимодействия [306]. Мы полагали, что разветвленная структура исследуемых нами ариленовых циклотримеров и разветвленных полифениленов, как раз и будет препятствовать формированию агрегатов и сближению групп люминофора в твердом состоянии.
Покрытия толщиной 30–40 нм были получены на кварцевых пластинах из растворов в CHCl3 с концентрацией 10 мг/мл при скорости вращения центрифуги 1 000 об/мин.
На Рис. 47 – 50 приведены спектры поглощения и эмиссии циклотримеров и РПФ П2.
|  1
1
|
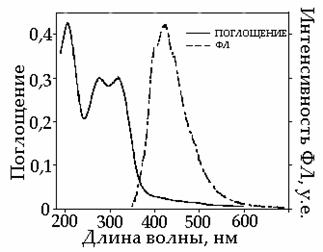
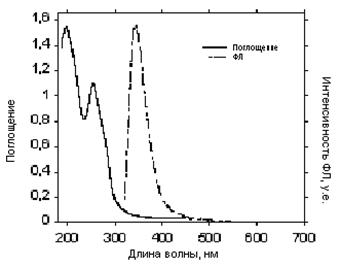
Рис. 47. Спектры поглощения и эмиссии циклотримера 1 в твердом состоянии
|  5
5
|
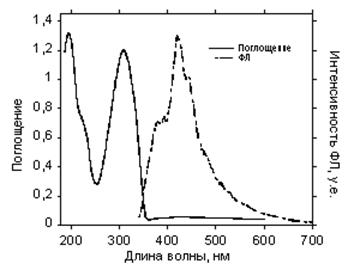
Рис. 48. Спектры поглощения и эмиссии циклотримера 5 в твердом состоянии
|  6
6
|
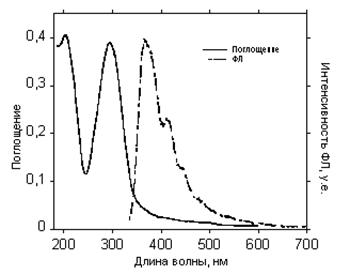
Рис. 49. Спектры поглощения и эмиссии циклотримера 6 в твердом состоянии
Рис. 50. Спектры поглощения и эмиссии полифенилена П2 в твердом состоянии
Были получены значения квантовых выходов фотолюминесценции (КВ ФЛ) [307] циклотримеров и РПФ П2 в твердом состоянии (Табл. 10). Веществом сравнения служил полифлуорен, абсолютный КВ ФЛ которого составляет 47 %.
Удивительным фактом оказалось то, что КВ ТФБ (1) оказался довольно высоким – 38 % (Табл. 10). По–видимому, это было связано с особенностями упаковки молекулы 1 в твердом состоянии.
Разветвленный полифенилен П2 имел также довольно высокий КВ ФЛ – 14%, что являлось многообещающим для дальнейшего изучения этого материала.
Таблица 10
Спектральные свойства циклотримеров и разветвленного полифеилена П2 в твердом состоянии
Как видно из рисунков 47 – 50, а также Табл. 10, максимумы поглощения для циклотримеров 1, 4, 6, 5, а также РПФ П2 в твердом состоянии, практически не сдвигаются в красную область по сравнению со спектрами, снятыми в растворах (Табл. 7), и остаются на том же уровне – 290–310 нм. Спектры фотолюминесценции для циклотримеров 1, 4, и 6 остаются практически такими же, как и в растворах, но в спектре соединений 4 и 6 появляется новая компонента при 420 нм. Эта полоса также характерна для циклотримера с ацетиленовыми группами (5). РПФ П2 хотя и имеет довольно широкий спектр фотолюминесценции, однако максимум соответствует 430 нм, что является синим излучением (Рис. 50). Следует подчеркнуть, что спектры электролюминесценции обычно совпадают со спектрами фотолюминесценции в твердом состоянии.
3.3.4. Изучение электролюминесценции
Для эффективной ЭЛ шероховатость покрытий должна быть минимальной, поскольку более гладкая поверхность, способствует большему перекрыванию π– сопряженных фрагментов, что облегчает перескок носителей заряда между полимерными цепями и увеличивает подвижность носителей заряда [308].
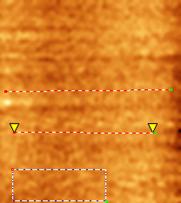
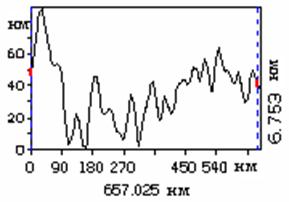
Методом атомно–силовой микроскопии было проведено изучение шероховатости поверхности покрытий циклотримеров ТФБ (1) (Рис. 51), ТДФ (6) и разветвленного полифенилена П2 (Рис. 52, Табл. 11).
При исследовании покрытий ТФБ (1) (Рис. 51) наблюдаются следующие закономерности: шероховатость покрытий существенно зависит от концентрации раствора, используемого для приготовления покрытия. При высокой концентрации – 10 мг/мл покрытия имеют высокую шероховатость, возможно из–за того, что данное соединение кристаллизуется на поверхности подложки при достаточно большой толщине покрытия. При низких концентрациях образуются более тонкие покрытия и кристаллизация, по–видимому, не происходит. Покрытия достаточно однородны, не имеют значительных выпуклостей.
Шероховатость покрытия ТДФ (6) достаточно высокая, порядка 9 нм, однако она соответствует довольно высокой концентрации образца – 2 мг/мл.
Для РПФ П2 наблюдается иная ситуация: даже при высокой скорости вращения центрифуги – 3 500 об/мин и высокой концентрации полимера – 4 мг/мл, покрытия получаются однородные и не шероховатые (Рис. 52). Общая шероховатость – 0,99 нм.
| а)

|
б)

| Рис. 52. Топография покрытия из
полифенилена П2 на подложке
а) вид в разрезе по линии на
поверхности
б) трехмерное изображение
|
Таблица 11
Изучение шероховатости покрытий
| Вещество
| Скорость вращения центрифуги, об/мин
| Концентрация, мг/мл
| Общая шероховатость, нм
| Шероховатость в выделенном «хорошем» квадрате, нм
|
| ТФБ (1)
| 1 500
| 0,05
| 1,08
| 0,91
|
|
|
| 0,10
| 1,42
| 0,89
|
|
|
| 10,00
| 20,48
| 7,40
|
|
| 3 500
| 0,05
| 1,50
| 0,69
|
|
|
| 0,10
| 1,20
| 1,04
|
| ТДФ (6)
| 3 500
| 2,00
| 9,21
| 3,86
|
| РПФ П2
| 3 500
| 4,00
| 0,99
| 0,58
|
| Подложка (стекло–ITO)
|
|
| 1,00
| 1,20
почему>1.00
|
Показано, что шероховатость поверхности с нанесенным слоем полифенилена составляет порядка 1 нм при толщине покрытия примерно 40 нм. Выявлено, что в отличие от низкомолекулярных соединений, полимер имеет более однородную и гладкую поверхность покрытия, что достигается за счет более высокой молекулярной массы.
Для реализации полимерного светодиода (ПСД), излучающего в синей области спектра, была впервые получена структура (ПСД I) [309], состоящая из последовательно сформированных на стеклянной подложке слоев нижнего прозрачного анода на основе окиси сплава индия с оловом (indium thin oxide – ITO) [310-312], активного люминесцентного фотоэлектрического слоя толщиной
30 – 40 нм на основе синтезированного разветвленного полифенилена П2, имеющего реально синее свечение (430 нм), верхнего контакта (катода) на основе Ca/Al. Снят спектр электролюминесценции (ЭЛ) данного устройства (Рис. 53).
  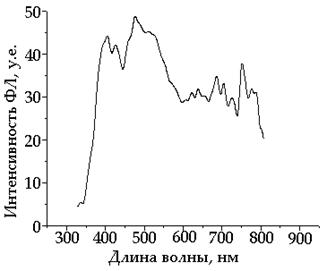
| Рис. 53. Спектр электролюминесценции ПСД I: ITO/РПФ П2/Ca/Al
|
Важно отметить, что спектр электролюминесценции однослойного ПСД I имеет синюю компоненту (указано кругом), что очень перспективно в дальнейшем для использования полимера в качестве активного слоя в ПСД.
При создании ПСД важна эффективность люминесценции будущего готового устройства. Для того чтобы электрические заряды могли рекомбинировать в люминесцентном хромофоре, важно иметь соответствующий и уравновешенный транспорт возбужденных как электронов, так и дырок [205]. Это требование сложнее всего выполнять для синих люминесцентных полимеров, имеющих большую ширину запрещенной энергетической зоны, высокий окислительный потенциал и низкое сродство к электрону. Чтобы преодолеть сложности с инжекцией заряда, желательно иметь слой инжекции/транспорта дырок, примыкающий к аноду, и слой инжекции/транспорта электронов, примыкающий к катоду. Поэтому, в целях усовершенствования полученного нами светодиода, на основе разветвленного полифенилена П2, было изготовлено двухслойное устройство (ПСД II), имеющее в своем составе дополнительно слой полимера
3,4–этилендиокситиофена (3,4–ethylene dioxithiophene – PEDOT), генерирующего дырки [313] и был также снят спектр его электролюминесценции (Рис. 54).
Спектр электролюминесценции светодиода типа ITO/PEDOT/РПФ П2 /Ca/Al демонстрирует максимум в синей области спектра (430 – 440 нм) (на Рис. 54 указано кругом).
  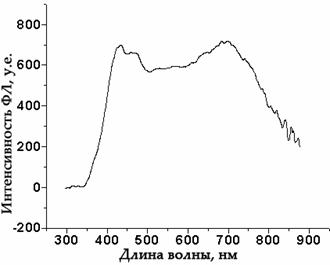
| Рис. 54. Спектр
электролюминесценции ПСД II: ITO/PEDOT/РПФ П2/Ca/Al
|
В настоящее время проводится работа в направлении повышения коэффициента преобразования электричества в свет, а для этого необходимо путем модификации РПФ и дальнейшего подбора соответствующих слоев электронной [170] и дырочной [314-317] проводимости добиться более узкого спектра излучения.
Таким образом, изучены спектральные свойства модельных соединений и разветвленных полифениленов с 1,3,5–трифенилзамещенным бензольным ядром. Показано, что с увеличением числа пара–замещенных бензольных колец в структуре возрастают квантовые выходы фотолюминесценции исследованных соединений. Установлено, что галоген тушит люминесценцию в циклотримерах и полимерах. В ведение тиофеновых групп в разветвленные циклотримеры сдвигает оптические спектры в длинноволновую область по сравнению со спектрами соединений чисто фениленового строения.
Впервые были получены полимерные светодиоды на основе разветвленного полифенилена с 1,3,5–трифенилзамещенным бензольным ядром в качестве центра ветвления и сняты спектры их электролюминесценции. Показано, что спектры электролюминесценции данных устройств имеют синюю компоненту, что делает этот полифенилен чрезвычайно привлекательным в качестве активного слоя светоизлучаемых устройств.
Следовательно, высокая эффективность эмиссии ариленовых звездообразных циклотримеров и разветвленных полифениленов в синей области видимого спектра делает их чрезвычайно привлекательными для использования в качестве активных слоев в светоизлучающих устройствах.
4. ВЫВОДЫ
1. Установлено, что выбранные в качестве модельных соединений циклотримеры с 1,3,5–трифенилзамещенным бензольным ядром являются эффективными синими эмиттерами. Они излучают свет в области 350 – 400 нм и обладают уникально высокими квантовыми выходами фотолюминесценции в растворе, достигающими 92 %.
2. С целью получения соединений, имеющих максимумы эмиссии в заданных областях видимого света (420 – 560 нм), была осуществлена функционализация модельных соединений введением тиофеновых групп в ветви циклотримеров. Установлено, что полученные соединения имеют высокие (до 50 %) квантовые выходы фотолюминесценции в растворах.
3. Выявлен ряд закономерностей, позволяющих в ряду ариленовых циклотримеров получать соединения со структурой, способной излучать свет в заданной области спектра. Это позволяет реализовать их применение в качестве активных слоев светоизлучающих диодов.
4. Изучение модельных циклотримеров легло в основу Ni0–катализируемого синтеза разветвленных растворимых полифениленов ароматической бездефектной структуры с 1,3,5–трифенилзамещенными бензольными кольцами в основной цепи в качестве центров ветвления. Установлено, что такие полимеры обладают исключительно высокими (до 96 %) квантовыми выходами фотолюминесценции в растворе и интенсивной фотолюминесценцией в твердом состоянии.
5. Впервые, на основе синтезированных полифениленов с 1,3,5–трифенилзамещенными бензольными кольцами были созданы светоизлучающие устройства, обладающие максимумом электролюминесценции в синей области видимого спектра. Это позволяет рекомендовать полученные полимеры в качестве активных слоев для нового поколения органических светодиодов.
ЛИТЕРАТУРА
1. F. E. Harper, M. I. Cohen. Properties of Si diodes prepared by alloying Al into n-type Si with heat pulses from a Nd:YAG laser. // Solid-State Electronics. 1970. V. 13. № 7. P. 1103.
2. F. Pellé, F. Auzel, J. M. Zavada, D. S. Lee, A. J. Steckl. New spectroscopic data of erbium ions in GaN thin films. // Materials Science and Engineering: B. 2003. V. 105. № 1-3. P. 126.
3. R. H. Friend, R. W. Gymer, A. B. Holmes, J. H. Burroughes, R. N. Marks, C. Talani, D. D. C. Bradley, D. A. DosSantos, J. L. Bredas, M. Logdlund, W. R. Salaneck. Electroluminescence in conjugated polymers. // Nature. 1999. V. 397. P. 121.
4. L. Chen, D. W. McBranch, H. Wang, R. Helgeson, F. Wudl, D. G. Whitten. Highly sensitive biological and chemical sensors based on reversible fluorescence quenching in a conjugated polymer. // Proc. Natl. Acad. Sci. USA. 1999. V. 96. P. 12287.
5. M. D. McGehee, A. J. Heeger. Semiconducting (Conjugated) Polymers as Materials for Solid-State Lasers. // Advanced Materials. 2000. V. 12. № 22. P. 1655.
6. S. R. Forrest, M. E. Thompson. Introduction: Organic Electronics and Optoelectronics. // Chem. Rev. 2007. V. 107. № 4. P. 923.
7. J. H. Burroughes, D. D. C. Bradley, A. R. Brown, R. N. Marks, K. Mackay, R. H. Friend, P. L. Burns, A. B. Holmes. Light-emitting diodes based on conjugated polymers. // Nature. 1990. V. 347. P. 539.
8. Z. Bao, Y. Feng, A. Dodabalapur, V. R. Raju, A. J. Lovinger. High-Performance Plastic Transistors Fabricated by Printing Techniques // Chem Mater. 1997. V. 9. № 6. P. 1299.
9. A. Holmes, A. Kraft, A. Grimsdale. Electroluminescent Conjugated Polymers - Seeing Polymers in a New Light. // Angew. Chem. Int. Ed. 1998. V. 37. № 4. P. 402.
10. E. Buhleier, W. Wehner, W. Vögtle. «Cascade»- and «nonskidchain-like» syntheses of molecular cavity topologies. // Synthesis. 1978. V. 2. P. 155.
11. D. A. Tomalia, H. Baker, J. Dewald, M. Hall, G. Kallos, S. Martin, J. Roeck, J. Ryder, P. Smith. A new class of polymers: starburst-dendritic macromolecules. // Polym. J. (Tokyo). 1985. V. 17. P. 117.
12. D. A. Tomalia, H. Baker, J. Dewald, M. Hall, G. Kallos, S. Martin, J. Roeck, J. Ryder, P. Smith. Dendritic macromolecules: synthesis of starburst dendrimers. // Macromolecules. 1986. V. 19. № 9. P. 2466.
13. G. R. Newkome, Z. Q. Yao, G. R. Baker, V. K. Gupta. Cascade molecules: a new approach to micelles, A [27]-arborol. // J. Org. Chem. 1985. V. 50. P. 2003.
14. K. Inoue. Functional dendrimers, hyperbranched and star polymers. // Prog Polym Sci. 2000. V. 25. P. 453.
15. U. Wiesler, T. Weil, K. Müllen. Nanosized Polyphenylene Dendrimers. // Current Chemistry. 2001. V. 212. P. 1.
16. M. Jikei, M. Kakimoto. Hyperbranched polymers a promising new class. // Prog Polym Sci 2001. V. 26. P. 1233.
17. H. Peng, H.-c. Dong, Y.-p. Dong, D.-m. Jia, B.-z. Tang. Syntheses and characterizations of hyperbranched polyphenylenes. // Chinese Journal of Polymer Science. 2004. V. 22. № 6. P. 501.
18. C. R. Yates, W. Hayes. Synthesis and applications of hyperbranched polymers. // European Polymer Journal. 2004. V. 40. P. 1257.
19. A. W. Bosman, H. M. Janssen, E. W. Meijer. About Dendrimers: Structure, Physical Properties, and Applications. // Chem Rev. 1999. V. 99. № 7. P. 1665.
20. D. A. Tomalia, H. D. Durst. Genealogically directed synthesis: Starburst/cascade dendrimers and hyperbranched structures. // Top. Curr. Chem. 1993. V. 165. P. 193.
21. D. A. Tomalia, A. M. Naylor, W. A. G. III. Starburst Dendrimers: Molecular-Level Control of Size, Shape, Surface Chemistry, Topology, and Flexibility from Atoms to Macroscopic Matter. // Angew. Chem. Int. Ed. Engl. 1990. V. 29. № 2. P. 138.
22. M. Maciejevski. Concepts of trapping topologically by shell molecules. // J. Macromol. Sci.- Chem. Ser. A. 1982. V. 17. № 4. P. 689.
23. C. Supritz, A. Engelmann, P. Reineker. Energy transport in dendrimers. // Journal of Luminescence. 2006. V. 119- 120. P. 337.
24. C. Supritz, A. Engelmann, P. Reineker. Optical absorption in compact and extended dendrimers. // Journal of Luminescence. 2005. V. 111. P. 367.
25. M. Venturi, P. Ceroni. Dendrimers with electroactive units in the core or in each branching centre. // C. R. Chimie. 2003. V. 6. P. 935.
26. J. F. G. A. Jansen, E. M. M. d. B.-v. d. Berg, E. W. Meijer. Encapsulation of Guest Molecules into a Dendritic Box. // Science. 1994. V. 266. P. 1226.
27. A. P. H. J. Schenning, E. Peeters, E. W. Meijer. Energy Transfer in Supramolecular Assemblies of Oligo(p-phenylene vinylene)s Terminated Poly(propylene imine) Dendrimers. // J. Am. Chem. Soc. 2000. V. 122. P. 4489.
28. G. Pistolis, A. Malliaris, D. Tsiourvas, C. M. Paleos. Poly(propyleneimine) Dendrimers as pH-Sensitive Controlled-Release Systems. // Chem. Eur. J. 1999. V. 5. № 5. P. 1440.
29. V. Chechik, M. Zhao, R. M. Crooks. Self-Assembled Inverted Micelles Prepared from a Dendrimer Template: Phase Transfer of Encapsulated Guests. // J. Am. Chem. Soc. 1999. V. 121. № 20. P. 4910.
30. V. Balzani, P. Ceroni, S. Gestermann, M. Gorka, C. Kauffmann, M. Maestri, F. Vögtle. Eosin Molecules Hosted into a Dendrimer Which Carries Thirty-Two Dansyl Units in the Periphery: A Photophysical Study. // ChemPhysChem. 2000. V. 1. № 4. P. 224.
31. U. Hahn, M. Gorka, F. Vögtle, V. Vicinelli, P. Ceroni, M. Maestri, V. Balzani. Light-Harvesting Dendrimers: Efficient Intra- and Intermolecular Energy-Transfer Processes in a Species Containing 65 Chromophoric Groups of Four Different Types. // Angew. Chem. Int. Ed. Engl. 2002. V. 41. № 19. P. 3595.
32. D. Ben-Avraham, L. S. Dchulman, S. H. Bossmann, C. Turro, N. J. Turro. Luminescence Quenching of Ruthenium(II)-Tris(phenanthroline) by Cobalt(III)-Tris(phenanthroline) Bound to the Surface of Starburst Dendrimers // J. Phys. Chem. B. 1998. V. 102. № 26. P. 5088.
33. F. Köhn, J. Hofkens, R. Gronheid, M. Cotlet, K. Müllen, M. V. d. Auweraer, F. C. D. Schryver. Excitation Energy Transfer in Dendritic Host-Guest Donor-Acceptor Systems. // ChemPhysChem. 2002. V. 3. № 12. P. 1005.
34. K. L. Wooley, C. J. Hawker, J. M. Pochan, J.M.J.Frechet. Physical properties of dendritic macromolecules: a study of glass transition temperature. // Macromolecules. 1993. V. 26. № 7. P. 1514.
35. М. С. Раджадураи, З. Б. Шифрина, Н. В. Кучкина, А. Л. Русанов, К. Мюллен. Жесткоцепные ароматические дендримеры. // Успехи химии. 2007. Т. 76. № 8. С. 821.
36. C. J. Hawker, J. M. J. Frechet. Preparation of polymers with controlled molecular architecture. A new convergent approach to dendritic macromolecules. // J. Am. Chem. Soc. 1990. V. 112. № 21. P. 7638.
37. T. M. Miller, E. W. Kwock, T. X. Neenan. Synthesis of four generations of monodisperse aryl ester dendrimers based on 1,3,5-benzenetricarboxylic acid. // Macromolecules. 1992. V. 25. № 12. P. 3143.
38. P. M. Bayliff, W. J. Feast, D. Parcer. The synthesis and properties of a series of aromatic dendritic polyamides. // Polym. Bull. 1992. V. 29. № 3-4. P. 265.
39. T. M. Miller, T. X. Neenan, R. Zayas, H. E. Bair. Synthesis and characterization of a series of monodisperse, 1,3,5-phenylene-based hydrocarbon dendrimers including C276H186 and their fluorinated analogs. // J. Am. Chem. Soc. 1992. V. 114. № 3. P. 1018.
40. А. М. Музафаров, Е. А. Ребров, В. С. Папков. Объемнорастущие полиорганосилоксаны. Возможности молекулярного конструирования в высокофункциональных системах. // Успехи химии. 1991. Т. 60. № 7. С. 1596.
41. A. Morikawa, M. Kakimoto, Y. Imai. Convergent synthesis of starburst poly(ether ketone) dendrons. // Macromolecules. 1993. V. 26. № 24. P. 6324.
42. А. М. Музафаров, О. Б. Горбацевич, Е. А. Ребров, Г. М. Игнатьева, Т. Б. Ченская, В. Д. Мякушев, А. Ф. Булкин, В.С.Папков. Кремнийорганические дендримеры. Объемнорастущие полиаллилкарбосиланы. // Высокомол. Соедин., Сер. А. 1993. Т. 35. № 11. С. 1867.
43. L. L. Zhou, J. Roovers. Synthesis of novel carbosilane dendritic macromolecules. // Macromolecules. 1993. V. 26. № 5. P. 963.
44. C. J. Hawker, K. L. Wooley, P. T. I. O. B.-O. C. J.M.J. Frechet // Unimolecular micelles and globular amphiphiles: dendritic macromolecules as novel recyclable solubilization agents. // J. Chem. Soc., Perkin Trans. 1. 1993. V. 12. P. 1287.
45. K. L. Wooley, C. J. Hawker, J. M. J. Frechet. Unsymmetrical three-dimensional macromolecules: preparation and characterization of strongly dipolar dendritic macromolecules. // J.Am.Chem.Soc. 1993. V. 115. № 24. P. 11496.
46. R. G. Denkewalter, J. Kolc, W. J. Lukasavage. Macromolecular highly branched homogeneous compound based on lysine units. U. S. Pat. 4,-289,872, Sept. 15, 1981.
47. R. G. Denkewalter, J. Kolc, W. J. Lukasavage. Preparation of lysine based macromolecular highly branched homogeneous compound. U. S. Pat. 4,-360,646, Nov. 23, 1982.
48. R. G. Denkewalter, J. Kolc, W. J. Lukasavage. Macromolecular highly branched homogeneous compound. U. S. Pat. 4,- 410,688, Oct. 18, 1983.
49. S. M. Aharoni, C. R. Crosby, E. K. Walsh. Size and solution properties of globular tert-butyloxycarbonyl-poly(α,ε-L-lysine). // Macromolecules. 1982. V. 15. № 4. P. 1093.
50. C. Wörner, R. Mülhaupt. Polynitrile- and Polyamine-Functional Poly(trimethylene imine) Dendrimers. // Angew. Chem., Int. Ed. Engl. 1993. V. 32. № 9. P. 1306.
51. E. M. M. D. B.-v. d. Berg, E. W. Meijer. Poly(propylene imine) Dendrimers: Large-Scale Synthesis by Hetereogeneously Catalyzed Hydrogenations. // Angew. Chem., Int. Ed. Engl. 1993. V. 32. № 9. P. 1308.
52. C. J. Hawker, J. M. J. Frechet. A new convergent approach to monodisperse dendritic macromolecules. // J. Chem. Soc., Chem. Commun. 1990. V. 15. P. 1010.
53. J. S. Moore, Z. Xu. Synthesis of rigid dendritic macromolecules: enlarging the repeat unit size as a function of generation, permitting growth to continue. // Macromolecules. 1991. V. 24. № 21. P. 5893.
54. J. S. Moore. Shape-Persistent Molecular Architectures of Nanoscale Dimension. // Acc. Chem. Res. 1997. V. 30. № 10. P. 402.
55. G. R. Newkome, C. N. Moorefield, F. Vogtle, Dendritic Molecules: Concepts, Syntheses and Perspectives. VCH ed.: Weinheim, Germany, 1996.
56. D. A. Tomalia, A. Padias, H. Hall. Starburst Polyether Dendrimers. // Polym. Prepr. 1989. V. 30. P. 119.
57. H. K. J. Hall, D. W. Polis. “Starburst” polyarylamines and their semiconducting complexes as potentially electroactive materials. // Polym. Bull. 1987. V. 17. № 5. P. 409.
58. H. Uchida, Y. Kabe, K. Yoshino, A. Kawamata, T. Tsumuraya, S. Masamune. General strategy for the systematic synthesis of oligosiloxanes. Silicone dendrimers. // J. Am. Chem. Soc. 1990. V. 112. № 19. P. 7077.
59. T. M. Miller, T. X. Neenan. Convergent synthesis of monodisperse dendrimers based upon 1,3,5-trisubstituted benzenes. // Chem. Mater. 1990. V. 2. № 4.
60. J. M. J. Frechet, C. J. Hawker, K. L. Wooley. The Convergent Route to Globular Dendritic Macromolecules: a versatileapproach to precisely functionalized threedimensional polymersand novel block copolymers. // J.M.S. - Pure Appl. Chem. Ser. A. 1994. V. 31. № 11. P. 1627.
61. K. L. Wooley, C. J. Hawker, J. M. J. Frèchet. Unsymmetrical Three-dimensional Macromolecules: Preparation and Characterization of Strongly Dipolar Dendritic Macromolecules. // J. Am. Chem. Soc. 1993. V. 115. № 24. P. 11496.
62. H. Stutz. The glass temperature of dendritic polymers. // J. Polym. Sci., Part B: Polym. Phys. 1995. V. 33. P. 333.
63. H.-F. Chow, C.-F. Leung, Guo-XinWang, Yu-YingYang. Dendritic effects in functional dendrimer molecules. // C. R. Chimie. 2003. V. 6. P. 735.
64. M. E. Mackay. Dendrimers, nanodevices to create unique phenomena. // C. R. Chimie. 2003. V. 6. P. 747.
65. K. L. Wooley, J. M. J. Frechet, C. Hawker. Influence of shape on the reactivity and properties of dendritic, hyperbranched and linear aromatic polyesters. // J. Polymer. 1994. V. 35. № 21. P. 4489.
66. A.-M. Caminade, R. Laurent, J.-P. Majoral. Characterization of dendrimers. // Advanced Drug Delivery Reviews. 2005. V. 57. P. 2130.
67. S. Rosenfeldta, N. Dingenoutsb, D. Potschkeb, M. Ballauffa, A. J. Berresheimc, K. Mullenc, P. Lindnerd, K. Saalwachter. Analysis of the spatial structure of rigid polyphenylene dendrimers by small-angle neutron scattering. // Journal of Luminescence. 2005. V. 111. P. 225.
68. D. J. Pesak, J. S. Moore, T. E. Wheat. Synthesis and Characterization of Water-Soluble Dendritic Macromolecules with a Stiff, Hydrocarbon Interior. // Macromolecules. 1997. V. 30. № 21. P. 6467.
69. B. Baytekin, N. Werner, F. Luppertz, M. Engeser, J. Bruggemannb, S. Bitter, R. Henkel, T. Felder, C. A. Schalley. How useful is mass spectrometry for the characterization of dendrimers? “Fake defects” in the ESI and MALDI mass spectra of dendritic compounds. // International Journal of Mass Spectrometry. 2006. V. 249-250. P. 138.
70. V. Balzani, P. Ceroni, S. Gestermann, M. Gorka, C. Kauffmann, F. Vögtle. Fluorescent guests hosted in fluorescent dendrimers. // Tetrahedron Letters. 2002. V. 58. № 4. P. 629.
71. V. Balzani, F. Vögtle. Dendrimers as luminescent hosts for metal cations and organic molecules. // C. R. Chimie. 2003. V. 6. P. 867.
72. F. Aulenta, W. Hayes, S. Rannard. Dendrimers: a new class of nanoscopic containers and delivery devices. // European Polymer Journal. 2003. V. 39. P. 1741.
73. P. Kolhe, E. Misra, R. M. Kannana, S. Kannan, M. Lieh-Lai. Drug complexation, in vitro release and cellular entry of dendrimers and hyperbranched polymers. // International Journal of Pharmaceutics. 2003 V. 259. P. 143.
74. F. N. Crespilho, F. Huguenin, V. Zucolotto, P. Olivi, F. C. Nart, O. N. O. Jr. Dendrimers as nanoreactors to produce platinum nanoparticles embedded in layer-by-layer films for methanol-tolerant cathodes. // Electrochemistry Communications. 2006. V. 8. P. 348.
75. Y.-M. Chung, H.-K. Rhee. Dendrimer-templated Ag-Pd bimetallic nanoparticles. // Journal of Colloid and Interface Science. 2004. V. 271. P. 131.
76. B. Singh, A. T. Florence. Hydrophobic dendrimer-derived nanoparticles. // International Journal of Pharmaceutics. 2005. V. 298. P. 348.
77. J. N. H. Reek, S. Arevalo, R. Heerbeek, P. C. J. Kamer, P. W. N. M. Leeuwen. Dendrimers in catalysis. // Adv. Catal. 2006. V. 49. P. 71.
78. D. Mery, D. Astruc. Dendritic catalysis: Major concepts and recent progress. // Coordination Chemistry Reviews. 2006. V. 250. P. 1965.
79. C. D. Haen, L. Gozzini, M. Muttoni. Use of dendrimeric-type macromolecules as catalysts or coadjuvants in phase transfer catalysis reactions. U. S. Patent 5705667, January 6, 1998.
80. S. R. Puniredd, Y. K. Wai, N. Satyanarayana, S. K. Sinha, M. P. Srinivasan. Tribological Properties of Nanoparticle-Laden Ultrathin Films Formed by Covalent Molecular Assembly. // Langmuir. 2007. V. 23. № 16. P. 8299.
81. В. П. Шибаев. Жидкокристаллические полимеры. // Соросовский Образовательный Журнал. 1997. № 6. С. 40.
82. V. Percec, M. Kawasumi. Synthesis and characterization of a thermotropic nematic liquid crystalline dendrimeric polymer. // Macromolecules. 1992. V. 25. P. 3843.
83. С. А. Пономаренко, Е. А. Ребров, Н. И. Бойко, Н. Г. Василенко, А. М. Музафаров, Я. С. Фрейдзон, В. П. Шибаев. Синтез холестеринсодержащих полиорганосолокановых дендримеров. // Высокомолекуляр. соединения. 1994. Т. 36. № 7. С. 1086.
84. J. P. Collman, L. Fu, A. Zingp, F. Diederrich. Dioxygen and carbon monoxide binding in dendritic iron(ii)porphyrins. // Chem. Communs. 1997. V. 2. P. 193.
85. А. Ф. Пожарский. Гетероциклические соединения в биологии и медицине. // Соросовский Образовательный Журнал. 1996. № 6. С. 25.
86. А. Н. Улахович. Комплексы металлов в живых организмах. // Соросовский образовательный журнал. 1997. № 8. С. 27.
87. C. W. Tang, S. A. Van-Slyke. Organic electroluminescent diodes. // Appl. Phys. Lett. 1987. V. 51. P. 913.
88. A. Kraft, A. C. Grimsdale, A. B. Holmes. Electroluminescent Conjugated Polymers - Seeing Polymers in a New Light. // Angew. Chem. Int. Ed. 1998. V. 37. № 4. P. 402.
89. M. Halim, J. N. G. Pillow, I. D. W. Samuel, P. L. Burn. Conjugated Dendrimers for Light-Emitting Diodes: Effect of Generation. // Adv. Mater. 1999. V. 11. № 5. P. 371.
90. J. M. Lupton, L. R. Hemingway, I. D. W. Samuel, P. L. Burn. Electroluminescence from a new distyrylbenzene based triazine dendrimer. // J. Mater. Chem. 2000. V. 10. P. 867.
91. P.-W. Wang, Y.-J. Liu, C. Devadoss, P. Bharathi, J. S. Moore. Electroluminescent diodes from a single component emitting layer of dendritic macromolecules. // Adv. Mater. 1996. V. 8. № 3. P. 237.
92. S.-C. Lo, P. L. Burn. Development of Dendrimers: Macromolecules for Use in Organic Light-Emitting Diodes and Solar Cells. // Chem. Rev. 2007. V. 107. № 4. P. 1097.
93. V. Balzani, P. Ceroni, M. Maestri, V. Vicinelli. Light-harvesting dendrimers. // Current Opinion in Chemical Biology. 2003. V. 7. P. 657.
94. C. Devadoss, P. Bharathi, J. S. Moore. Energy Transfer in Dendritic Macromolecules: Molecular Size Effects and the Role of an Energy Gradient. // J. Am. Chem. Soc. 1996. V. 118. № 40. P. 9635.
95. D.-L. Jiang, T. Aida. Morphology-Dependent Photochemical Events in Aryl Ether Dendrimer Porphyrins: Cooperation of Dendron Subunits for Singlet Energy Transduction. // J. Am. Chem. Soc. 1998. V. 120. № 42. P. 10895.
96. P. Ceroni, V. Vicinelli, M. Maestri, V. Balzani, S.-k. Lee, J. v. Heyst, M. Gorka, F. Vogtle. Luminescent dendrimers as ligands for metal ions. // Journal of Organometallic Chemistry. 2004. V. 689. P. 4375.
97. J. M. Lupton, I. D. W. Samuel, R. Beavington, P. L. Burn, H. Bassler. Nanoengineering of organic semiconductors for light-emitting diodes: control of charge transport. // Synthetic Metals. 2001. V. 116. P. 357.
98. J. Luo, H. Ma, A. K.-Y. Jen. Nanostructured functional dendrimers and polymers for photonics. // C. R. Chimie. 2003. V. 6. P. 895.
99. O. A. Matthews, A. N. Shripway, J. F. Stoddart. Dendrimers—Branching out from curiosities into new technologies. // Prog Polym Sci. 1998. V. 23. № 1. P. 1.
100. F. Zeng, S. C. Zimmerman. Dendrimers in Supramolecular Chemistry: From Molecular Recognition to Self-Assembly. // Chem Rev. 1997. V. 97. № 5. P. 1681.
101. M. A. Hearshaw, J. R. Moss. Organometallic and related metal-containing dendrimers. // Chem Commun. 1999. V. 1. P. 1.
102. E. C. Constable. Metallodendrimers: metal ions as supramolecular glue. // Chem Commun. 1997. V. 12. P. 1073.
103. P. J. Flory. Molecular Size Distribution in Three Dimensional Polymers. VI. Branched Polymers Containing A-R-Bf-1 Type Units. // J Am Chem Soc. 1952. V. 74. № 11. P. 2718.
104. B. Voit. New developments in hyperbranched polymers. // J Polym Sci Part A Polym Chem. 2000. V. 38. № 14. P. 2505.
105. H. Y. Kim, O. W. Webster. Water soluble hyperbranched polyphenylene: "a unimolecular micelle?" // J Am Chem Soc. 1990. V. 112. № 11. P. 4592.
106. C. J. Hawker, R. Lee, J. M. J. Frechet. One-step synthesis of hyperbranched dendritic polyesters. // J Am Chem Soc. 1991. V. 113. № 11. P. 4583.
107. L. J. Hobson, W. J. Feast. Poly(amidoamine) hyperbranched systems: synthesis, structure and characterization. // Polymer. 1999. V. 40. № 5. P. 1279.
108. D. Holter, A. Burgath, H. Frey. Degree of branching in hyperbranched polymers. // Acta Polym. 1997. V. 48. № 1-2. P. 30.
109. Y. H. Kim. Hyperbranched polymers 10 years after. // J Polym Sci Part A Polym Chem. 1998. V. 36. № 11. P. 1685.
110. P. Kambouris, C. J. Hawker. A versatile new method for structure determination in hyperbranched macromolecules. // J. Chem. Soc., Perkin Trans. 1. 1993. № 22. P. 2717.
111. D. H. Bolton, K. L. Wooley. Synthesis and Characterization of Hyperbranched Polycarbonates. // Macromolecules. 1997. V. 30. № 7. P. 1890.
112. J. M. J. Fréchet, M. Henmi, I. Gitsov, S. Aoshima, M. R. Leduc, R. B. Grubbs. Self-Condensing Vinyl Polymerization: An Approach to Dendritic Materials. // Science. 1995. V. 269. № 5227. P. 1080.
113. C. J. Hawker, F. Chu. Hyperbranched Poly(ether ketones): Manipulation of Structure and Physical Properties. // Macromolecules. 1996. V. 29. № 12. P. 4370.
114. J. F. Miravet, J. M. J. Fréchet. New Hyperbranched Poly(siloxysilanes): Variation of the Branching Pattern and End-Functionalization. // Macromolecules. 1998. V. 31. № 11. P. 3461.
115. C. Cameron, A. H. Fawcett, C. R. Hetherington, R. A. W. Mee, F. V. McBride. Cycles frustrating fractal formation in an AB2 step growth polymerization. // Chem. Commun. 1997. № 18. P. 1801.
116. W. J. Feast, A. J. Keeney, A. M. Kenwright, D. Parker. Synthesis, structure and cyclics content of hyperbranched polyesters. // Chem. Commun. 1997. № 18. P. 1749.
117. J. K. Gooden, M. L. Gross, A. Mueller, A. D. Stefanescu, K. L. Wooley. Cyclization in Hyperbranched Polymer Syntheses: Characterization by MALDI-TOF Mass Spectrometry. // J. Am. Chem. Soc. 1998. V. 120. № 39. P. 10180.
118. M. Suzuki, A. Ii, T. Saegusa. Multibranching polymerization: palladium-catalyzed ring-opening polymerization of cyclic carbamate to produce hyperbranched dendritic polyamine. // Macromolecules. 1992. V. 25. № 25. P. 7071.
119. Y. H. Kim, O. W. Webster. Hyperbranched polyphenylenes. // Macromolecules. 1992. V. 25. № 21. P. 5561.
120. Y. H. Kim, O. W. Webster. Hyperbranched polyphenylenes. // Polym Prepr. 1988. V. 29. № 2. P. 310.
121. В. В. Коршак, М. М. Тепляков, В. А. Сергеев. Новый метод синтеза полимеров полифениленового типа с использование полициклоконденсации диацетилароматических соединений. // Докл. АН СССР. 1973. 208. № 6. С. 1360.
122. В. В. Коршак, М. М. Тепляков, В. А. Сергеев. Полициклоконденсация ацетилароматических соединений как новый метод синтеза полимеров полифениленового типа. // Высокомолек. соед. 1972. Б14. № 11. С. 800.
123. В. В. Коршак, М. М. Тепляков, Р. А. Дворикова. Исследование реакции полициклоконденсации ацетильных соединений. // Высокомолек. соед. 1982. А23. № 2. С. 277.
124. М. М. Тепляков. Тримеризационная полициклоконденсация ацетилароматических соединений и их кеталей. // Успехи химии. 1979. № 2. С. 344.
125. Y. H. Kim, R. Beckerbauer. Role of End Groups on the Glass Transition of Hyperbranched Polyphenylene and Triphenylbenzene Derivatives. // Macromolecules. 1994. V. 27. № 7. P. 1968.
126. F. Morgenroth, K. Müllen. Dendritic and hyperbranched polyphenylenes via a simple Diels-Alder route. // Tetrahedron Lett. 1997. V. 53. № 45. P. 15349.
127. A. J. Berresheim, M. Müller, K. Müllen. Polyphenylene Nanostructures. // Chem. Rev. 1999. V. 99. № 7. P. 1747.
128. T. H. Mourey, S. R. Turner, M. Rubinstein, J. M. J. Frechet, C. J. Hawker, K. L. Wooley. Unique behavior of dendritic macromolecules: intrinsic viscosity of polyether dendrimers. // Macromolecules. 1992. V. 25. № 9. P. 2401.
129. S. R. Turner, B. I. Voit, T. H. Mourey. All-aromatic hyperbranched polyesters with phenol and acetate end groups: synthesis and characterization. // Macromolecules. 1993. V. 26. № 17. P. 4617.
130. S. R. Turner, F. Walter, B. I. Voit, T. H. Mourey. Hyperbranched Aromatic Polyesters with Carboxylic Acid Terminal Groups. // Macromolecules. 1994. V. 27. № 6. P. 1611.
131. E. Malmström, A. J. Hult. Hyperbranched polymers: A review. // Macromol Sci-Rev Macromol Chem Phys. 1997. № 37. P. 555.
132. M. Jikei, Z. Hu, M.-a. Kakimoto, Y. Imai. Synthesis of Hyperbranched Poly(phenylene sulfide) via a Poly(sulfonium cation) Precursor. // Macromolecules. 1996. V. 29. № 3. P. 1062.
133. V. Percec, P. Chu, M. Kawasumi. Toward "Willowlike" Thermotropic Dendrimers. // Macromolecules. 1994. V. 27. № 16. P. 4441.
134. S.-W. Hahn, Y.-K. Yun, J.-I. Jin. Thermotropic Hyperbranched Polyesters Prepared from 2-[(10-(4-Hydroxyphenoxy)decyl)oxy]terephthalic Acid and 2-[(10-((4'-Hydroxy-1,1'-biphenyl-4-yl)oxy)decyl)oxy]terephthalic Acid. // Macromolecules. 1998. V. 31. № 19. P. 6417.
135. S. Bauer, H. Ringsdorf, H. Fischer. Highly Branched Liquid Crystalline Polymers with Chiral Terminal Groups. // Angewandte Chemie International Edition in English. 1993. V. 32. № 11. P. 1589.
136. A. Sunder, M.-F. Quincy, R. Mülhaupt, H. Frey. Hyperbranched Polyether Polyols with Liquid Crystalline Properties. // Angewandte Chemie International Edition. 1999. V. 38. № 19. P. 2928.
137. H. R. Kricheldorf, T. Stukenbrock, C. Friedrich. New polymer syntheses. XCVII. Hyperbranched LC-polyesters based on -(4-hydroxyphenyl)propionic acid and 4-hydroxybenzoic acid. // Journal of Polymer Science Part A: Polymer Chemistry. 1998. V. 36. № 9. P. 1397.
138. A. Reina, A. Gerken, U. Zemann, H. R. Kricheldorf. New polymer syntheses, 101. Liquid-crystalline hyperbranched and potentially biodegradable polyesters based on phloretic acid and gallic acid. // Macromolecular Chemistry and Physics. 1999. V. 200. № 7. P. 1784.
139. Y. H. Kim. Lyotropic liquid crystalline hyperbranched aromatic polyamides. // J. Am. Chem. Soc. 1992. V. 114. № 12. P. 4947.
140. D. H. Bolton, K. L. Wooley. Hyperbranched aryl polycarbonates derived from A2B monomers versus AB2 monomers. // Journal of Polymer Science Part A: Polymer Chemistry. 2002. V. 40. № 7. P. 823.
141. R. A. Jacobson. Polymers from benzyl chloride and related compounds. // J. Am. Chem. Soc. 1932. V. 54. № 4. P. 1513.
142. W. H. Hunter, G. H. Woollett. A catalytic decomposition of certain phenol silver salts. IV. The constitution of the amorphous oxides. // J. Am. Chem. Soc. 1921. V. 43. № 1. P. 135.
143. D. A. Tomalia, V. Berry, M. Hall, D. M. Hedstrand. Starburst dendrimers. 4. Covalently fixed unimolecular assemblages reiminiscent of spheroidal micelles. // Macromolecules. 1987. V. 20. № 5. P. 1164.
144. G. R. Newkome, Z. Yao, G. R. Baker, V. K. Gupta, P. S. Russo, M. J. Saunders. Chemistry of micelles series. Part 2. Cascade molecules. Synthesis and characterization of a benzene[9]3-arborol. // J. Am. Chem. Soc. 1986. V. 108. № 4. P. 849.
145. G. R. Newkome, G. R. Baker, M. J. Saunders, P. S. Russo, V. K. Gupta, Z.-q. Yao, J. E. Miller, K. Bouillion. Two-directional cascade molecules: synthesis and characterization of [9]-n-[9] arborols. // J. Chem. Soc., Chem. Commun. 1986. № 10. P. 752.
146. C. Nguyen, C. J. Hawker, R. D. Miller, E. Huang, J. L. Hedrick, R. Gauderon, J. G. Hilborn. Hyperbranched Polyesters as Nanoporosity Templating Agents for Organosilicates. // Macromolecules. 2000. V. 33. № 11. P. 4281.
147. B. Romagnoli, W. Hayes. Chiral dendrimers-from architecturally interesting hyperbranched macromolecules to functional materials. // Mater. Chem. 2002. V. 12. № 4. P. 767.
148. И. А. Хотина, Н. С. Кушакова, Д. А. Рудь, С. С. Ловков, И. И. Пономарев, П. М. Валецкий. Новые макролиганды на основе полифениленов для Pd-содержащих катализаторов. // Доклады Академии Наук. 2006. 409. № 3. С. 362.
149. H. Meier, M. Lehmann. Stilbenoid Dendrimers. // Angewandte Chemie International Edition. 1998. V. 37. № 5. P. 643.
150. A. Sunder, M. Krämer, R. Hanselmann, R. Mülhaupt, H. Frey. Molecular Nanocapsules Based on Amphiphilic Hyperbranched Polyglycerols. // Angewandte Chemie International Edition. 1999. V. 38. № 23. P. 3552.
151. D. J. Massa, K. A. Shriner, S. R. Turner, B. I. Voit. Novel Blends of Hyperbranched Polyesters and Linear Polymers. // Macromolecules. 1995. V. 28. № 9. P. 3214.
152. D. Schmaljohann, P. Pötschke, R. Hässler, B. I. Voit. Blends of Amphiphilic, Hyperbranched Polyesters and Different Polyolefins. // Macromolecules. 1999. V. 32. № 19. P. 6333.
153. M. Johansson, E. Malmström, A. Hult. Synthesis, characterization, and curing of hyperbranched allyl ether-maleate functional ester resins. // Journal of Polymer Science Part A: Polymer Chemistry. 1993. V. 31. № 3. P. 619.
154. M. Johansson, A. Hult. Synthesis, characterization, and UV curing of acrylate functional hyperbranched polyester resins. // J of Coat Tech. 1995. V. 67. P. 35.
155. Y. Zhang, L. Wang, T. Wada, H. Sasabe. Synthesis and characterization of novel hyperbranched polymer with dipole carbazole moieties for multifunctional materials. // Journal of Polymer Science Part A: Polymer Chemistry. 1996. V. 34. № 7. P. 1359.
156. Y. Zhang, L. Wang, T. Wada, H. Sasabe. One-pot synthesis of a new hyperbranched polyester containing 3,6-di-acceptor-substituted carbazole chromophores for nonlinear optics. // Macromolecular Chemistry and Physics. 1996. V. 197. № 2. P. 667.
157. Y. Zhang, T. Wada, H. Sasabe. A new hyperbranched polymer with polar chromophores for nonlinear optics. // Polymer. 1997. V. 38. № 12. P. 2893.
158. H. Nishide, M. Nanbo, E. Tsuchida. // Polym Preprints Jpn. 1998. V. 47. P. 1670.
159. C. Chauvierre, L. Leclerc, D. Labarre, M. Appel, M. C. Marden, P. Couvreur, C. Vauthier. Enhancing the tolerance of poly(isobutylcyanoacrylate) nanoparticles with a modular surface design. // International Journal of Pharmaceutics. 2007. V. 338. № 1-2. P. 327.
160. R. Haag, F. Kratz. Polymer Therapeutics: Concepts and Applications. // Angewandte Chemie International Edition. 2006. V. 45. № 8. P. 1198.
161. J. Jagur-Grodzinski. Polymers for tissue engineering, medical devices, and regenerative medicine. Concise general review of recent studies. Review. // Polymers for Advanced Technologies. 2006. V. 17. № 6. P. 395.
162. S. Venkatachalam, S. Agilan, D. Mangalaraj, S. K. Narayandass. Optoelectronic properties of ZnSe thin films. // Materials Science in Semiconductor Processing. 2007.
163. G. D. Sharma, V. S. Choudhary, M. S. Roy. Electrical and photovoltaic properties of devices based on PbPc-TiO2 thin films. // Solar Energy Materials and Solar Cells. 2007. V. 91. № 12. P. 1087.
164. K. Y. Law. Organic photoconductive materials: recent trends and developments. // Chem. Rev. 1993. V. 93. P. 449.
165. K. Ozga. Oligoetheracrylate polymers as new promising materials for photooperated transparency. // Optical Materials. 2007. V. 29. № 11. P. 1510.
166. G. Maier. Low dielectric constant polymers for microelectronics. // Progress in Polymer Science. 2001. V. 26. № 1. P. 3.
167. D. S. Soane, Z. Martynenko. Polymers in microelectronics fundamentals and applications. // Microelectronics and Reliability. 1990. V. 30. № 1. P. 181.
168. F. Carpi, D. D. Rossi. Colours from electroactive polymers: Electrochromic, electroluminescent and laser devices based on organic materials. // Optics & Laser Technology. 2006. V. 38. № 4-6. P. 292.
169. S. Chen, X. Xu, Y. Liu, W. Qiu, G. Yu, H. Wang, D. Zhu. New Organic Light-Emitting Materials: Synthesis, Thermal, Photophysical, Electrochemical, and Electroluminescent Properties. // J. Phys. Chem. C. 2007. V. 111. № 2. P. 1029.
170. A. P. Kulkarni, C. J. Tonzola, A. Babel, S. A. Jenekhe. Electron Transport Materials for Organic Light-Emitting Diodes. // Chem. Mater. 2004. V. 16. № 23. P. 4556.
171. В. Говард. Органические дисплеи. // В мире науки. 2004. № 5. С. 68.
172. S. Tsoi, B. Szeto, M. D. Fleischauer, J. G. C. Veinot, M. J. Brett. Control of Alq3 Wetting Layer Thickness via Substrate Surface Functionalization. // Langmuir. 2007. V. 23. № 12. P. 6498.
173. A. Uddin, C. B. Lee, X. Hu, T. K. S. Wong, X. W. Sun. Effect of doping on optical and transport properties of charge carriers in Alq3. // Journal of Crystal Growth. 2006. V. 288. № 1. P. 115.
174. S.-H. Oh, S.-I. Na, Y.-C. Nah, D. Vak, S.-S. Kim, D.-Y. Kim. Novel cationic water-soluble polyfluorene derivatives with ion-transporting side groups for efficient electron injection in PLEDs. // Organic Electronics. 2007.
175. L. Akcelrud. Electroluminescent polymers. // Progress in Polymer Science. 2003. V. 28. № 6. P. 875.
176. J. J. M. Halls, D. R. Baigent, F. Cacialli, N. C. Greenham, R. H. Friend, S. C. Moratti, A. B. Holmes. Light-emitting and photoconductive diodes fabricated with conjugated polymers. // Thin Solid Films. 1996. V. 276. № 1-2. P. 13.
177. J. L. Br´edas, C. Adant, D. Beljonne, F. Meyers, Z. Shuai. Influence of molecular architecture and chain length on the nonlinear optical response of conjugated oligomers and polymers. // Synth. Met. 1993. V. 57. № 1. P. 3933.
178. N. Tessler, G. J. Denton, R. H. Friend. Lasing from conjugated-polymer microcavities // Nature. 1996. V. 382. № 6593. P. 695.
179. I. D. W. Samuel, G. A. Turnbull. Organic Semiconductor Lasers. // Chem. Rev. 2007. V. 107. № 4. P. 1272.
180. C. D. Dimitrakopoulos, P. R. L. Malenfant. Organic Thin Film Transistors for Large Area Electronics. // Adv Mater. 2002. V. 14. № 2. P. 99.
181. N. S. Sariciftci, D. Braun, C. Zhang, V. I. Srdanov, A. J. Heeger, G. Stucky. Semiconducting polymer-buckminsterfullerene heterojunctions: Diodes, photodiodes, and photovoltaic cells. // Appl Phys Lett. 1993. V. 62. № 6. P. 585.
182. S. Günes, H. Neugebauer, N. S. Sariciftci. Conjugated Polymer-Based Organic Solar Cells. // Chem. Rev. 2007. V. 107. № 4. P. 1324.
183. G. E. Wnek, J. C. W. Chien, F. E. Karasz, C. P. Lillya. Electrically conducting derivative of poly(p-phenylene vinylene). // Polymer. 1979. V. 20. № 12. P. 1441.
184. S.-J. Jung, Y.-R. Cho, S.-H. Jin, S.-C. Kim, W. S. Shin, J. W. Lee, Y.-S. Gal. Synthesis and characterization of PPV-based light-emitting copolymer with alkylsilylphenyloxy pendant group for light-emitting diode applications. // Current Applied Physics. 2007. V. 7. № 4. P. 375.
185. M. Fukuda, K. Sawada, K. Yoshino. Fusible Conducting Poly(9-alkylfluorene) and Poly(9,9-dialkylfluorene) and Their Characteristics // Jpn J Appl Phys. 1989. V. 28. № 8. P. 1433.
186. A. d. Cuendias, M. Urien, S. Lecommandoux, G. Wantz, E. Cloutet, H. Cramail. Novel EDOT and fluorene-based electroluminescent “bricks” as materials for OLEDs. // Organic Electronics. 2006. V. 7. № 6. P. 576.
187. J. J. Langer. Conformations of aniline black (polyaniline) molecules. // Synth Met. 1987. V. 20. № 1. P. 35.
188. Y. Zhu, D. Hu, M. X. Wan, L. Jiang, Y. Wei. Conducting and Superhydrophobic Rambutan-like Hollow Spheres of Polyaniline. // Adv. Mater. 2007. V. 16.
189. G. Tourillon, F. Garnier. Morphology of conducting organic polymers: Polythiophene and poly(3-methyl thiophene). // J. Polym. Sci., Part B: Polym. Phys. 1983. V. 22. № 1. P. 33.
190. V. Promarak, A. Punkvuang, S. Jungsuttiwong, S. Saengsuwan, T. Sudyoadsuk, T. Keawin. Synthesis, optical, electrochemical, and thermal properties of α,α′-bis(9,9-bis-n-hexylfluorenyl)-substituted oligothiophenes. // Tetrahedron Letters. 2007. V. 48. № 21. P. 3661.
191. A. Pietrangelo, M. J. MacLachlan, M. O. Wolf, B. O. Patrick. Synthesis and Structures of Novel Luminescent Bent Acenedithiophenes. // Org. Lett. 2007.
192. J. Cremerand, C. A. Briehn. Novel Highly Fluorescent Triphenylamine-Based Oligothiophenes. // Chem. Mater. 2007.
193. Y. Zhang, C. Zhao, J. Yang, M. Kapiamba, O. Haze, L. J. Rothberg, M.-K. Ng. Synthesis, Optical, and Electrochemical Properties of a New Family of Dendritic Oligothiophenes. // J. Org. Chem. 2006. V. 71. № 25. P. 9475.
194. H. Peng. Syntheses and characterizations of hyperbranched polyphenylenes. // Chinese Journal of Polymer Science. 2004. V. 22(6). P. 50 J.
195. I. A. Khotina, L. S. Lepnev, N. S. Burenkova, P. M. Valetsky, A. G. Vitukhnovsky. Phenylene Dendrimers and Novel Hyperbranched Polyphenylenes as Light Emissive Materials for Blue OLEDs. // J. Luminescence. 2004. V. 110. № 4. P. 232.
196. W. S. Jenks, T. Wolff, Advances in Photochemistry. John Wiley & Sons, Inc.: Hoboken, NJ., 2007; Vol. 29, p 384.
197. H. Peng, J.-Y. Lam, J. Chen, Y. Zheng, J. Luo, K. Xu, B. Z. Tang. Hyperbranched polyphenylenes containing biphenyl moieties: Synthesis, light emission, and optical limiting. // Polym. Prep. 2002. V. 43. № 2. P. 1318.
198. H. Sirringhaus, N. Tessler, R. H. Friend. Integrated Optoelectronic Devices Based on Conjugated Polymers // Science. 1998. V. 280. № 5370. P. 1741.
199. A. Satrijo, S. C. J. Meskers, T. M. Swager. Probing a Conjugated Polymer's Transfer of Organization-Dependent Properties from Solutions to Films. // J. Am. Chem. Soc. 2006. V. 128. № 28. P. 9030.
200. T. Fukushima, K. Takachi, K. Tsuchihara. Optically Active Poly(phenylacetylene) Film: Simultaneous Change of Color and Helical Structure. // Macromolecules. 2006. V. 39. № 9. P. 3103.
201. J. M. Shaw, P. F. Seidler. Organic electronics: Introduction. // IBM J Res Dev. 2001. V. 45. № 1. P. 3.
202. A. G. MacDiarmid. Synthetic Metals: A Novel Role for Organic Polymers. // Angew Chem. 2001. V. 40. № 14. P. 2581.
203.
|
|
|




 1
1

 5
5

 6
6