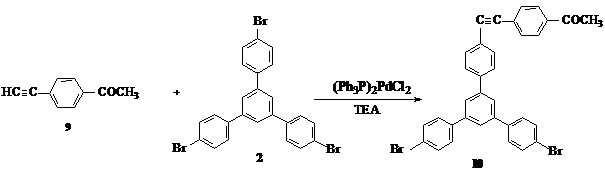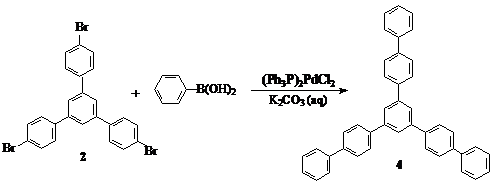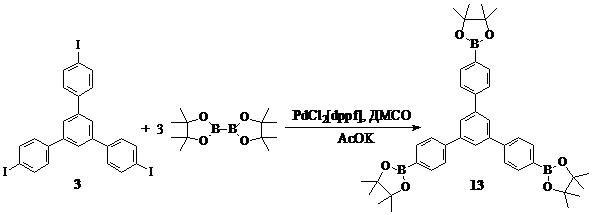Функционализируя п -положения периферийных бензольных колец при 1,3,5–трифенилзамещенном бензольном ядре, можно получать как циклотримеры с более протяженными ветвями, так и соединения, содержащие на периферии группы, способные придать всей структуре определенные спектральные и электронные свойства. В дальнейшем этот подход был нами применен при синтезе полимеров.
Для синтеза звездообразных соединений с протяженными ветвями с 1,3,5–трифенилзамещенным бензольным ядром, содержащих ацетиленовые группы, был использован метод Pd–катализируемого кросс–сочетания по типу реакции Соногашира [288]. Основой для синтеза таких соединений послужил циклотример 2 (1,3,5–три(п –бромфенил)бензол).
Вначале была предпринята попытка замещения одного атома брома соединения 2. Для этого по реакции Соногашира, взаимодействием п –бромацетофенона с триметилсилилацетиленом с последующим гидролизом кремнийсодержащей группы, было синтезировано соединение 9 – п –этинилацетофенон.

Свойства полученного соединения 9 представлены в Табл. 2.
Функционализация соединения 2 по Соногашира при помощи соединения 9 представлялась возможной, поскольку в этой реакции не нужно было вводить защиту ацетильной группы, и, кроме того, при наличии полярной ацетильной группы, выделение индивидуальных продуктов реакции на хроматографической колонне было вполне реальным.
Взаимодействием 9 с соединением 2 получали замещенный циклотример 10:
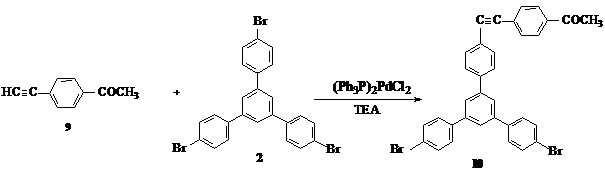
Соединение охарактеризовано с помощью масс– и ИК–спектроскопии (Рис. 31), данные элементного анализа представлены в Табл. 2.
Таблица 2
Свойства соединений 9 и 1 0
| Соединение
| Тпл, ºС
| MS: m/z
| Элементный анализ,
найдено/вычислено, %
|
| С
| Н
| Br
|
| 9
| 66–68
(лит. 67–68,5 [273])
| 144
| 83,14
83,30
| 5,51
5,56
| –
|
| 10
| 248–250 [274]
| 606
| 67,33
65,84
| 3,63
3,55
| 26,40
27,57
|
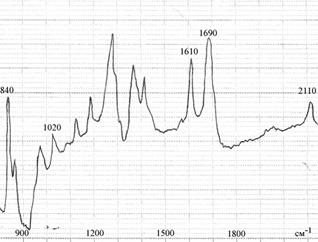
| Рис. 31. ИК–спектр соединения 10
|
В ИК–спектре соединения 10 (Рис. 31) присутствует полоса при 2 110 см–1, относящаяся к ацетиленовым группам, полосы при 840, 1 020 и 1 610 см–1, характерные для замещенного бензольного кольца и полоса при 1 690 см–1, относящаяся к ацетильной группе.
Предполагалось, что после циклоконденсации соединения 10 и образования разветвленного циклотримера, атомы брома могли быть замещены фенилацетиленом, также по реакции Соногашира.
Однако оказалось, что в результате синтеза, по данным тонкослойной хроматографии, в продуктах реакции кроме исходного соединения 2 были обнаружены моно–, ди– и тризамещенные продукты, что подтвердилось данными масс–спектра. Выделение циклотримера 10 не привело к получению достаточного количества чистого продукта. Несмотря на трехкратную очистку на хроматографической колонне с последующей перекристаллизацией в нем содержалось до 10 % примесей.
Предположив, что терминальные ацетиленовые группы при 1,3,5–трифенилзамещенном бензольном ядре будут более реакционноспособными в реакциях Соногашира с различными ароматическими моно–бромидами, по Соногашира был осуществлен синтез 1,3,5–три(п –этинилфенил)бензола на основе соединения 2. В дальнейшем предполагался синтез ацетиленсодержащих звездообразных циклотримеров, при условии параллельного синтеза монозамещенных (этинильных) производных соединения 2. На первой стадии получали соединение 11 – продукт взаимодействия соединения 2 с триметилсилилацетиленом по Соногашира:

Соединение 11 выделяли с помощью колоночной хроматографии на силикагеле (элюент – хлороформ) под контролем тонкослойной хроматографии. Содержание кремния по данным элементного анализа практически соответствовало рассчитанному (Табл. 3).
Таблица 3
Данные элементного анализа соединения 11
| Соединение
| Элементный анализ, найдено/вычислено, %
|
| C
| H
| Si
|
| 11
| 78,84
78,78
| 8,26
7,08
| 12,90
14,14
|
Гидролиз 11 должен был привести к получению соединения 12, однако, несмотря на наличие в масс–спектрограмме молекулярного иона соединения 12, выделить данное соединение из смеси продуктов реакции не представлялось возможным. По–видимому, это происходило из–за высокой реакционной способности 12 и его самоконденсации в процессе очистки на хроматографической колонне.
Для дальнейшей функционализации производных 1,3,5–трифенилбензола на основе соединения 2 была использована реакция Сузуки, т.е. взаимодействие ароматических борных кислот или из эфиров с ароматическими галоидами в присутствии палладиевых катализаторов [289].
Попытки синтезировать производное борной кислоты (или ее эфиров) на основе соединения 2 – 1,3,5–три(п –бромфенил)бензола не привели к положительному результату, так как получить необходимое для этого Li–производное или MgBr–производное ТФБ не удавалось, вероятно из–за низкой реакционной способности брома, что уже обсуждалось ранее. Однако мы провели реакцию взаимодействия 2 с фенилборной кислотой, чтобы оценить возможность проведения такой реакции:
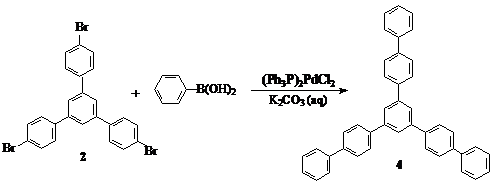
Жесткие условия реакции – 48 часов при 95оС и низкий выход целевого продукта (~ 10 %), еще раз убедили нас в том, что трибромпроизводное 1,3,5–трифенилбензола недостаточно реакционноспособно в реакциях кросс–сочетания с ароматическими борными кислотами по Сузуки.
Недавно было опубликовано несколько работ [290-293], связанных с получением пинаколборатных производных ароматических соединений, взаимодействием их бромидов или йодидов с пинаколборатом или бис–пинаколборатом, и дальнейшее их успешное использование в реакциях Сузуки.
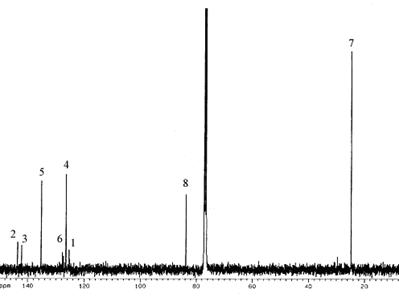
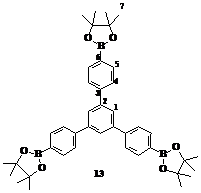
Поскольку по реакционной способности уходящих групп в в Pd–катализируемых реакциях кросс–сочетания йод значительно превосходит бром, использование йод–производных в данных условиях приводит к получению соединений с большим выходом. Поэтому для проведения реакции Сузуки нами было выбрано соединение 3 – 1,3,5–три(п –йодфенил)бензол, и была проведена реакция его взаимодействия с бис–пинаколборатом в присутствии специфического для этой реакции катализатора – ферроценильного комплекса палладия. Соединение 13 охарактеризовано масс– и ЯМР 13С спектроскопией (Рис. 32), данные элементного анализа представлены в Табл. 4.
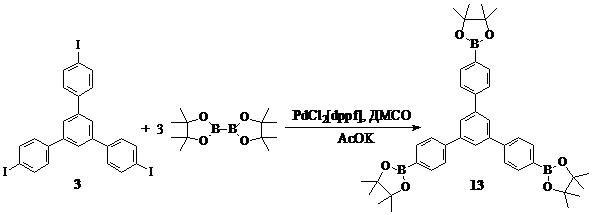
| PdCl2[dppf] =
[1,1′–Бис(дифенилфосфино)ферроцен]
дихлоропалладий(II) комплекс с CH2Cl2
| 
|
Оказалось, что соединение 13 обладает исключительной активностью и способно к автоконденсации. При выделении его на колонне, образовывались многочисленные продукты конденсации. Поэтому пришлось использовать его в дальнейших реакциях in situ и непосредственно после взаимодействия 3 с бис–пиноколборатом. Для свежеприготовленного соединения 13 по данным элементного анализа, содержание бора хорошо соответствует рассчитанному (Табл. 4).
Таблица 4
Свойства соединения 13
| Соединение
| MS: m/z
| Элементный анализ,
найдено/вычислено, %
|
| С
| Н
| B
|
| 13
| 684
| 73,21
73,68
| 7,76
7,46
| 4,72
4,82
|
В спектре ЯМР 13С соединения 13 (Рис. 32) сигнал при 135,8 м.д. относится к третичным атомам углерода центрального бензольного кольца. Сигналы при 143,8 м.д. и 142,1 м.д. относятся к четвертичным атомам углерода соответственно центрального и 1,4–замещенного бензольных колец. Остальные атомы углерода 1,4–замещенного бензольного кольца характеризуется сигналами при 127,8 м.д. (м –положение), 126,7 м.д. (п –положение) и 125,8 м.д. (о –положение бензольного кольца).
| 
|
| Рис. 32. ЯМР 13С спектр соединения 13
|
Соединение 13 – 1,3,5–три(фенилпинаколборат–ил–4)бензол, в дальнейшем использовалось для синтеза разветвленных полифениленов с контролируемой молекулярной массой по реакции Сузуки.