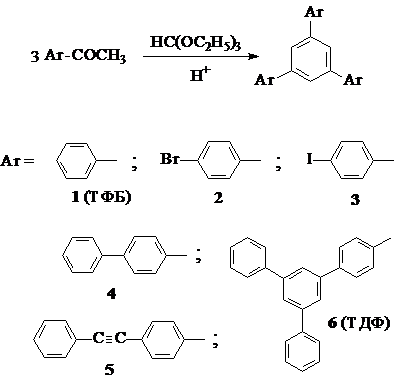
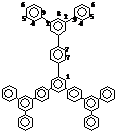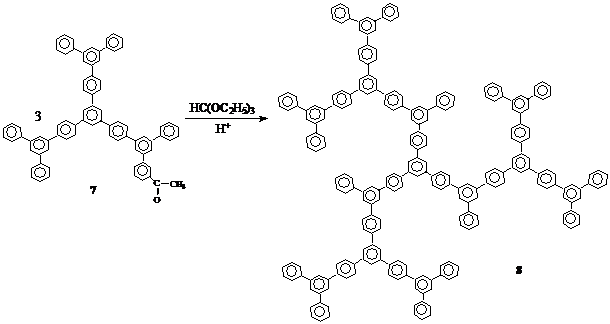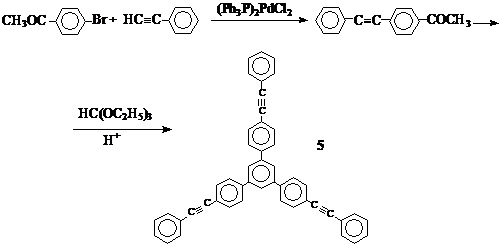Циклоконденсация моноацетилароматических соединений – наиболее простой и надежный способ синтеза разветвленных циклотримеров [124]. В результате этой реакции генерируется новое 1,3,5–трифенилзамещенное бензольное ядро. Семейство ариленовых циклотримеров (1 – 6) было получено циклоконденсацией соответствующих моноацетилароматических соединений с триэтилортоформиатом в бензоле или в другом подходящем растворителе, в присутствии газообразного сухого хлористого водорода [195]. Хлористый водород получали непосредственно в ходе реакции прикапыванием серной кислоты на сухой хлорид натрия.
Свойства полученных соединений приведены в Табл. 1.
Таблица 1
Свойства соединений 1 – 6
| 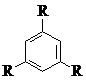
| Тпл, оС
| MS: m / z
| Элементный анализ,
найдено/вычислено, %
|
| С
| Н
| Br
| I
|
|
R–
| 1 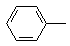
| 175
(лит. 175–176 [270])
| 306
| 94,21
94,12
| 5,76
5,88
| –
| –
|
2 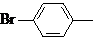
| 267–270
(лит. 262 [271])
| 543
| 53,48
53,04
| 3,08
2,76
| 43,48
44,20
| –
|
3 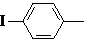
| 269–271
(лит. 270–271 [269])
| 684
| 42,27
42,11
| 2,45
2,19
| –
| 55,34
55,70
|
4 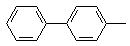
| 240–242
(лит. 241 [272])
| 534
| 94,43
94,38
| 5,57
5,62
| –
| –
|
5 
| 112–113
(лит. 113–114 [268])
| 606
| 95,17
95,05
| 4,83
4,95
| –
| –
|
6 
| 318 [195]
| 990
| 94,73
94,55
| 5,22
5,45
| –
| –
|
На Рис. 22 приведен типичный ИК–спектр фениленового циклотримера. В ИК–спектре обнаружены интенсивные полосы при 1 610 см–1 и 845 см–1, что соответствует ароматическому углеводороду (колебания кольца) и полоса при 880 см–1, характеризующая 1,3,5–тризамещенное бензольное кольцо.
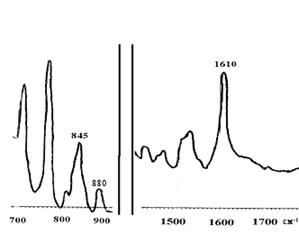
| Рис. 22. ИК–спектр соединения 1
|
Масс–спектр соединения 2 (M/Z = 543) представлен на Рис. 23.

| Рис. 23. Масс–спектр
соединения 2
|
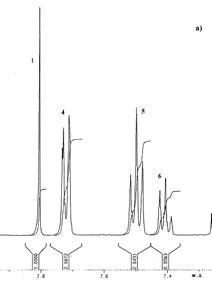
Для характеристики получаемых в дальнейшем разветвленных полифениленов был проведен анализ 1H и 13С ЯМР спектров модельных циклотримеров. Для 1,3,5–трифенилбензола (ТФБ) (1) ЯМР спектры 1Н и 13С были изучены ранее [283]. Спектры, приведенные на Рис. 24 и отнесение сигналов, хорошо согласуются с данными, приведенными в [283].
| 
| 
|
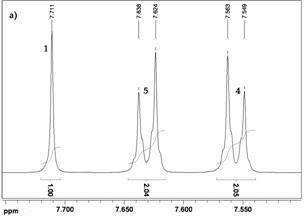
| Рис. 24. Спектры 1Н ЯМР (а) и 13С ЯМР (б) соединения 1
|
| | | |
В спектре ПМР ТФБ (1) (Рис. 24 а) можно четко отнести сигналы протонов центрального бензольного кольца (синглет при 7,81 м.д.), а также сигналы, характеризующие внешнее бензольное кольцо: дублет при 7,70 – 7,74 м.д. (о –положение), триплет при 7,48–7,52 м.д. (м –положение) и триплет в области 7,39 – 7,42 м.д. (п –положение).
В спектре ЯМР 13С соединения 1 (Рис. 24 б) сигнал при 125,1 м.д. относится к третичным атомам углерода центрального бензольного кольца. Сигналы при 142,3 м.д. и 141,1 м.д. относятся к четвертичным атомам углерода соответственно центрального и периферийного бензольных колец. Замещенные атомы углерода внешнего бензольного кольца характеризуется сигналами при 128,7 м.д. (м –положение), 127,4 м.д. (п –положение) и 127,3 м.д. (о –положение бензольного кольца).
В ЯМР 13С спектре соединения 2 (Рис. 25 б), где в п –положении внешнего кольца появляются атомы брома, положения сигналов этого кольца изменяются.
| 
| 
|
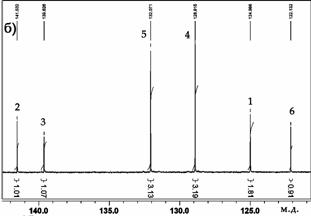
| Рис. 25. Спектры 1Н ЯМР (а) и 13С ЯМР (б)
соединения 2
|
| | | |
В спектре ПМР 2 (Рис. 25 а) можно четко отнести сигналы протонов центрального бензольного кольца (синглет при 7,71 м.д.), а также сигналы, характеризующие 1,4–замещенное бензольное кольцо: дублет при 7,54 – 7,57 м.д. (о –положение) и дуплет при 7,62–7,65 м.д. (м –положение).
В спектре ЯМР 13С соединения 2 (Рис. 25 б) сигнал при 125,1 м.д. относится к третичным атомам углерода центрального бензольного кольца. Сигналы при 141,9 м.д. и 139,9 м.д. относятся к четвертичным атомам углерода соответственно центрального и 1,4–замещенного бензольных колец. Остальные атомы углерода 1,4–замещенного бензольного кольца характеризуется сигналами при 132,1 м.д. (м –положение), 122,2 м.д. (п –положение) и 128,9 м.д. (о –положение бензольного кольца).
Сравнительный анализ спектров ЯМР соединения 2, являющегося мономером в синтезе полимеров методом Pd– или Ni–катализируемой поликонденсации, был очень важен для дальнейшей оценки положений сигналов атомов углерода при концевых атомах брома, а также оценки их количества.
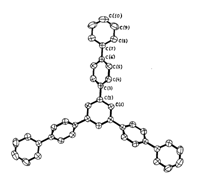
Представитель второй генерации фениленовых дендримеров, относительно 1,3,5–трифенилбензола ТФБ (1)– дендримера первой генерации, тридекафенил (ТДФ) (6) (циклотример с 13 бензольными кольцами), был синтезирован последовательными реакциями моноацилирования ТФБ хлористым ацетилом по Фриделю–Крафтсу с последующей циклоконденсацией полученного [1–(4–ацетилфенил)–3,5–дифенил]бензола. Особенностью этой реакции было проведение ацилирования в нитробензоле, поскольку в другом любом растворителе оно приводило к ацилированию не в периферийное, а в центральное бензольное кольцо.
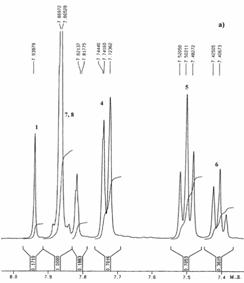
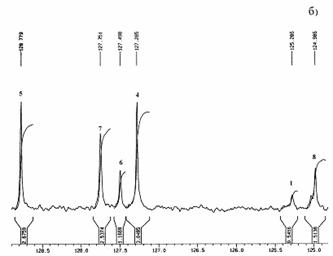
В спектре ПМР ТДФ (6) (Рис. 26 а) можно четко отнести сигналы протонов центрального бензольного кольца (синглет при 7,94 м.д.), а также сигналы, характеризующие внешнее бензольное кольцо: дублет при 7,72 – 7,82 м.д. (о –положение), триплет при 7,48–7,52 м.д. (м –положение) и триплет в области 7,40 – 7,42 м.д. (п –положение). Сигналы в области 7,80 – 7,87 м.д. относятся к остальным протонам молекулы 6 и они накладываются друг на друга.
На Рис. 26 б приведен спектр ЯМР 13С соединения 6, где можно более четко отнести сигналы ароматической области. Сигнал при 125,3 м.д. относится к третичным атомам углерода центрального бензольного кольца. Сигнал при 125,0 м.д. относится к третичным атомам углерода 1,3,5–замещенного периферийного бензольного кольца. Сигналы при 127,7 м.д. относятся к атомам углерода (о – и м –положения) 1,4–замещенного бензольного кольца. Атомы углерода внешних бензольных колец характеризуется сигналами при 128,8 м.д. (м –положение), 127,5 м.д. (п –положение) и 127,3 м.д. (о –положение бензольного кольца).
| 
| 
|
| Рис. 26. Спектры 1H ЯМР (а) и 13С ЯМР (б)
соединения 6
|
| | | |
Нами были предприняты попытки получить дендример третьей генерации, используя конвергентный подход, т.е. выращивание дендронов и объединение их под одним общим центром. Для этого было получено моноацетилпроизводное тридекафенила (7) ацилированием соединения 6 (дендримера второй генерации) по Фриделю–Крафтсу:

В ИК–спектре соединения 7 (Рис. 27) обнаружены интенсивные полосы при 1 600 см–1, соответствующая ароматическому углеводороду (колебания кольца) и при 1660 см–1, относящаяся к карбонильной группе.
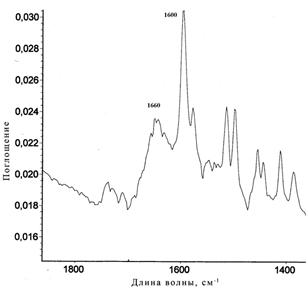
| Рис. 27. ИК–спектр соединения 7
|
Последующей тримеризационной циклоконденсацией соединения 7 получали дендример третьей генерации 8.
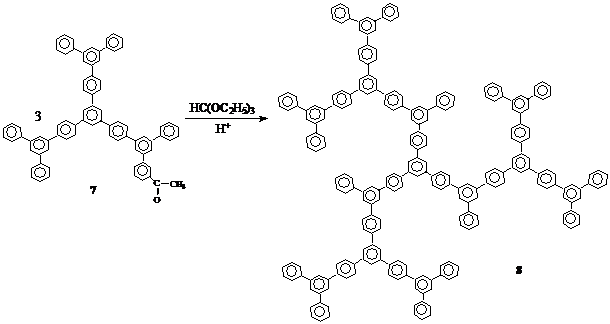
Из–за стерических затруднений и трудоемкости процесса получение количественного выхода данного соединения не представлялось возможным, а дальнейшие попытки выделить готовый продукт не увенчались успехом.
Таким образом, получение дендримера третьей генерации конвергентным методом не привело к положительным результатам, поскольку при достижении больших молекулярных масс дендронов реакционный центр становится менее доступным для формирования макромолекулы, что означает возможность использования данной схемы только для синтеза дендримеров с относительно небольшой молекулярной массой. Для получения соединений с более протяженными ветвями в дальнейшем был использован иной подход, связанный с синтезом разветвленных полимеров с контролируемой молекулярной массой.
Дж. Муром (J. Moore) и сотрудниками [53] описан ряд дендримеров с ацетиленовыми группами, получаемых конвергентным методом вплоть до четвертой генерации. В синтезированных дендримерах группа люминофора содержалась в одном из звеньев, а поскольку разветвляющим звеном был нелюминесцирующий 1,3,5–замещенный бензол, сама структура не рассматривалась как флюорофор, а лишь играла роль антенны.
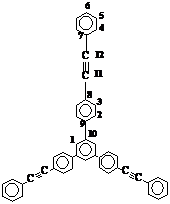
Мы попытались получить ряд звездообразных соединений с ацетиленовыми группами и с разветвляющим звеном – 1,3,5–трифенилбензолом. Первым модельным циклотримером являлось соединение 5. Одним из наиболее распространенных способов получения соединения 5 является ацилирование дифенилацетиленгексакарбонил дикобальта по Фриделю–Крафтсу с последующим разрушением комплекса [284]. Нами был выбран более простой метод – циклотримеризация моноацетилароматического соединения – 4–ацетилтолана (4–ацетил–4’–этинилбензола). Исходный 4–ацетилтолан получали по реакции палладий–катализируемого кросс–сочетания [285] между 4–бромацетофеноном и фенилацетиленом в присутствии PPh3, CuI и амина, а также палладиевого катализатора – дихлоро–бис(трифенилфосфин)палладия (II):
| (Ph3P)2PdCl2 =
| 
|
Этот катализатор был использован нами и в дальнейшем при проведении реакций кросс–сочетания:
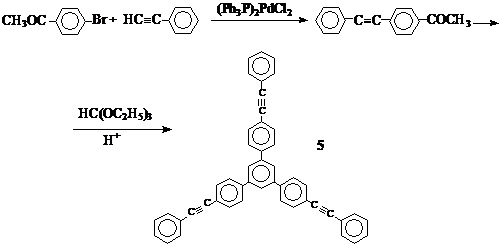
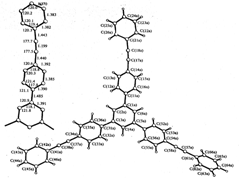
Строение молекулы оказывает значительное влияние на спектральные свойства соединений. По известным данным рентгеноструктурного анализа (РСА) соединения 5 [268] можно сказать, что в кристалле существуют две симметрически независимые молекулы – 1А и 1В, имеющие сходную конформацию и геометрию, близкую к стандартной (Рис. 28 а). В обеих молекулах центральный 1,3,5–трифенилзамещенный бензольный фрагмент имеет не вполне плоскую и несимметричную конформацию: двугранные углы между плоскостями 1,3,5–замещенного центрального и примыкающих к нему 1,4–замещенных бензольных циклов варьируют в пределах 20,9 – 37,5°, причем одно из 1,4–замещенных фениленовых колец в каждой молекуле повернуто в направлении, противоположном наклону двух других 1,4–замещенных фениленовых колец.
Взаимная ориентация бензольных циклов в каждом из остатков толана (дифенилацетилена) варьирует в более широких пределах: двугранные углы между плоскостями циклов, связанных ацетиленовыми группами, находятся в интервале 0,8 – 47,3°.
Рис. 28. Строение молекул (5) (а) и (4) (б) в проекции на их среднюю плоскость с нумерацией атомов
Строение кристаллов 5 (Рис. 29) характеризуется существенной «гетерогенностью»: с одной стороны, молекулы 5 упакованы в довольно компактные стопки вдоль оси Х, а с другой стороны, взаимное расположение этих стопок весьма рыхлое — между ними существуют “каналы“ (также вдоль оси Х), заполненные сольватными молекулами. Очевидно, такой способ упаковки обусловлен существенной анизометрией и конформационной жесткостью молекул 5 [268].
Сравнительная конформационная жесткость боковых цепей молекулы 5 все же затрудняет взаимную пространственную подстройку друг к другу реакционноспособных ацетиленовых групп, это ведет к разрыхлению плотной упаковки циклотримера и оказывает положительное влияние на спектральные свойства данного соединения.
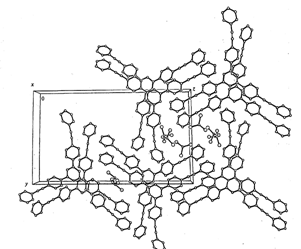
| Рис. 29. Проекция кристаллической
структуры 5 вдоль оси Х
|
По данным рентгеноструктурного анализа (РСА) циклотримера 4, содержащего на периферии бифенильные фрагменты, можно считать, что бензольные кольца в молекуле 4 относительно планарны (Рис. 28 б) [286]. В кристалле молекулы 4 бифенильные фрагменты относительно центрального кольца имеют конформацию пропеллера (поворот 1,4–замещенных бензольных колец относительно центрального и терминальных колец составляет 47,2º и 35,9º соответственно). Длины связей центрального бензольного кольца молекул 4 (1,395(3) Å) соответствуют стандартной длине ароматической связи (1,394(5) Å). Однако в 1,4–замещенных фениленовых фрагментах С–С связи уже слегка укорочены. Длины связей СPh – CPh равны 1,480 Å [286]. Эти величины близки по длине или чуть короче тех же связей в 1,3,5–трифенилбензоле (1) (1,487 Å) [287].
Замечено, что длины связей в терминальных группах, также как и длины связей между терминальным ядром и предыдущим ядром несколько короче стандартных величин, вероятно благодаря термическому движению молекулы. В целом, для молекулы 4 большинство длин связей и углов близко к их низкомолекулярным аналогам, т.е. геометрические параметры не изменяются с увеличением размера молекулы.
Таким образом, рентгеноструктурный анализ циклотримеров показал, что центральное 1,3,5–трифенилзамещенное бензольное кольцо всех соединений является достаточно планарным по отношению к соседним бензольным кольцам.
| 
| 
|
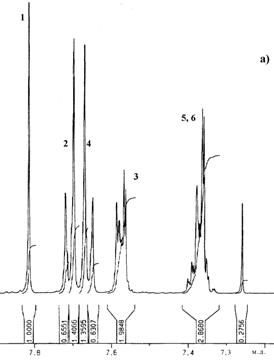
| Рис. 30. Спектры 1Н ЯМР (а) и 13С ЯМР (б) соединения 5
|
| | | |
В спектре ПМР 5 (Рис. 30 а) можно четко отнести сигналы протонов центрального бензольного кольца (синглет при 7,81 м.д.), а также сигналы, характеризующие 1,4–замещенное бензольное кольцо: дублет при 7,69 – 7,74 м.д. (о –положение) и дуплет при 7,56–7,59 м.д. (м –положение). Сигналы в области 7,63 – 7,68 м.д. характеризуют внешнее бензольное кольцо (о –положение), а в области 7,33 – 7,42 м.д. относятся к остальным протонам внешнего бензольного кольцаи накладываются друг на друга.
В спектре ЯМР 13С соединения 5 (Рис. 30 б) сигнал при 125,1 м.д. относится к третичным атомам углерода центрального бензольного кольца. Сигналы при 141,6 м.д. и 140,5 м.д. относятся к четвертичным атомам углерода соответственно центрального и 1,4–замещенного бензольных колец. Сигнал при 127,1 м.д. относится к замещенным атомам углерода (о –положение) 1,4–замещенного бензольного кольца. Атомы углерода внешнего бензольного кольца характеризуются сигналами при 128,2 м.д. (м –положение) и 128,1 м.д. (п –положение). Сигналы при 122,8 м.д. (п –положение) и 123,2 м.д. относятся к четвертичным атомам углерода соответственно 1,4–замещенного и периферийного бензольных колец. Сигналы углеродов при тройной ацетиленовой связи находятся в области 89–91 м.д.