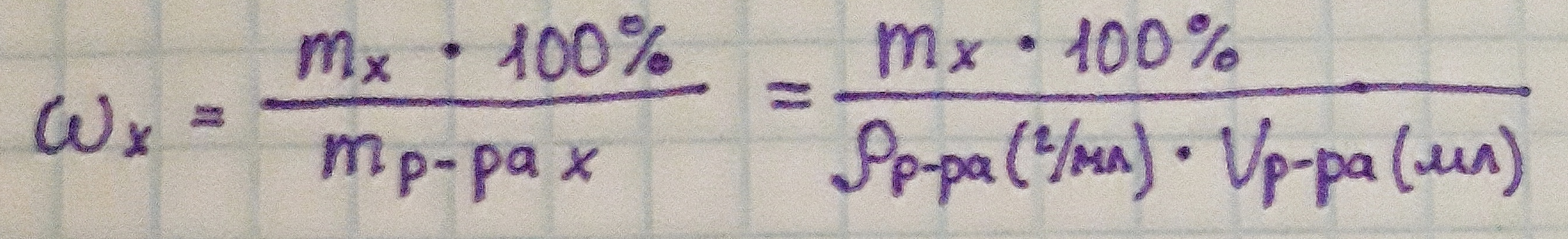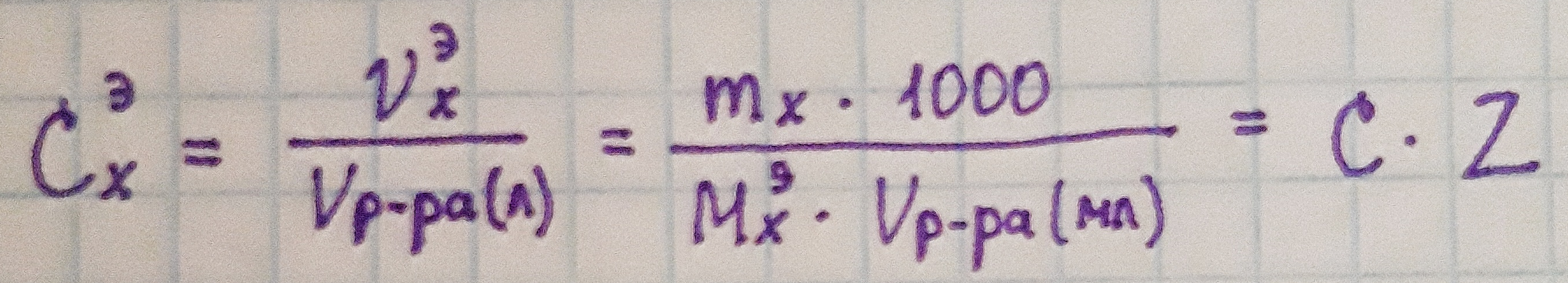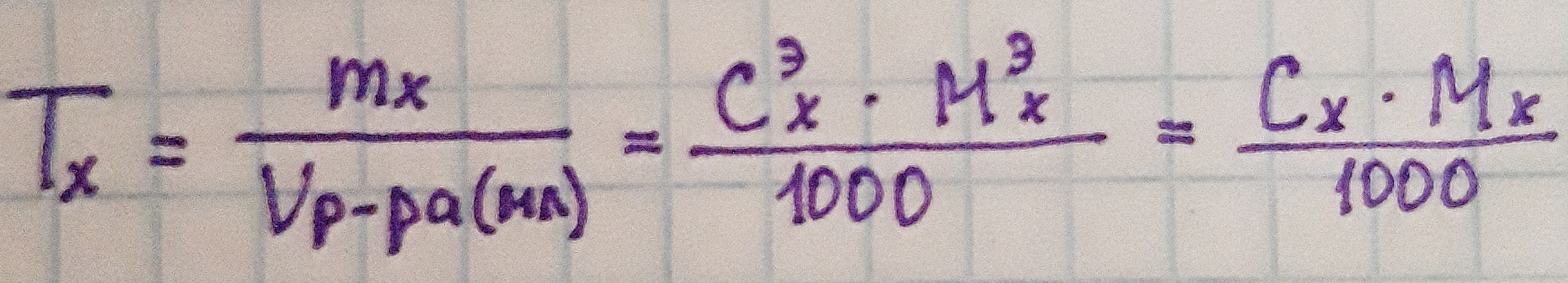Ый тип: компоненты смеси не реагируют друг с другом
| Смесь
| Пример
| Расчет рН
|
| 1. Две сильные кислоты
| HCl (C1,V1) и HBr (C2,V2)
| pH= -lg 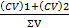
|
| 2. Сильная + слабая кислота
| HCl (C1,V1) иCH3COOH (C2,V2)
Диссоциация слабой кислоты не учитывается
| pH= -lg 
|
| 3. Два сильных основания
| NaOH (C1,V1) и KOH (C2,V2)
| pOH= -lg 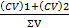
|
| 4. Сильное и слабое основание
| NaOH (C1,V1) иNH3*H2O (C2,V2)
Диссоциация слабого основания не учитывается
| pOH= -lg 
|
| 5. Буферная система I типа: слабая кислота + её соль
| NaHCO3 иNa2CO3
(кислотаHCO3-)
H3PO4 иKH2PO4
(кислотаH3PO4)
KH2PO4 иK2HPO4
(кислотаH2PO4-)
K2HPO4 иK3PO4
(кислотаHPO42-)
| pH= pKa+lg 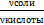 или
pH= pK+lg
или
pH= pK+lg 
|
| 6. Буферная система II типа: слабое основание + его соль
| NH3*H2Oи NH4+Cl-
(основание NH3)
CH3NH2*H2OиCH3NH2 + Cl-
(основание CH3NH2)
| pOH= pKb+lg  или
pOH= pKb+lg
или
pOH= pKb+lg 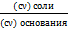
|
Ой тип: компоненты смеси реагируют друг с другом
а) Смесь сильной кислоты HCl (C 1, V 1) и сильного основания NaOH (C 2, V 2)
HCl + NaOH → NaCl + H2O
| 1) C1*V1=C2*V2
В растворе только соль, гидролиза нет
| рН=7,00
|
| 2) C1*V1>C2*V2
В растворе избыток сильной кислоты
| С изб. кислоты =  рН = -lgCизб.кисл.
рН = -lgCизб.кисл.
|
| 3) C1*V1<C2*V2
В растворе избыток сильного основания
| С изб. кислоты = 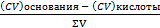 рOН = -lgCизб.осн.
рOН = -lgCизб.осн.
|
б) Смесь слабой кислоты и сильного основания
Ch3COOH (C1,V1) + NaOH (C2,V2)
| 1) C1*V1=C2*V2
В растворе только соль, гидролиз по аниону
| рН=7+1/2*(рК посл. ступень + lgC соли)
С соли = 
|
| 2) C1*V1>C2*V2
В растворе избыток слабой кислоты
| pH= pKa+lg 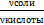 ν соли = (СV)1
νкислоты = (СV)1-(CV)2
ν соли = (СV)1
νкислоты = (СV)1-(CV)2
|
| 3) C1*V1<C2*V2
В растворе избыток сильного основания
| С изб. кислоты = 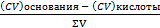 рOН = -lgCизб.осн.
рOН = -lgCизб.осн.
|
в) Смесь сильной кислоты и слабого основания
NH 3* H 2 O (C 1, V 1)и HCl (C 2, V 2)
NH 3* H 2 O + HCl → NH 4 Cl + H 2 O
| 1) C1*V1=C2*V2
В растворе только соль, гидролиз по катиону
| рН=7-1/2*(рКb посл. ступень + lgC соли)
С соли = 
|
| 2) C1*V1>C2*V2
В растворе избыток слабого основания
| pOH= pKb+lg  ν соли = (СV)2
νкислоты = (СV)1-(CV)2
ν соли = (СV)2
νкислоты = (СV)1-(CV)2
|
| 3) C1*V1<C2*V2
В растворе избыток сильной кислоты
| рН=7,00
|
Классификация количественных методов анализа
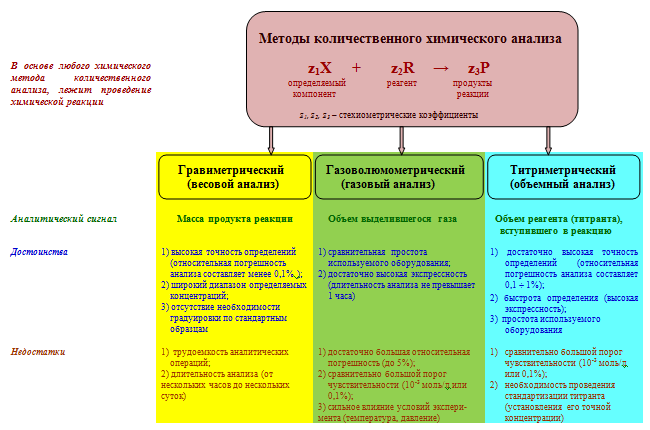
Классификация титриметрических методов анализа
| Метод
| Реакция, лежащая в основе метода
| Разновидности метода
| Титрант
|
| 1. КОТ
| H+ + OH- → H2O
| Ацидиметрия
| Сильная кислота HCl и др.
|
| Алкалиметрия
| Сильное основание NaOH и др.
|
| 2. НТ
| Протол. реакция
| Ацидиметрия
| HClO4 в безв.CH3COOH
|
| Алкалиметрия
| CH3ONaв безв. CH3OH
|
| 3. ОСТ
| X + R → ↓ + …
| Аргентометрия
| AgNO3
|
| Тиоцианометрия (роданометрия)
| KSCN, NH4SCN
|
| Меркурометрия
| Hg(NO3)2
|
| Гексацианоферратометрия
| K4[Fe(CN)6]
|
| 4. ОВТ
| ОВР
| Перманганатометрия
| KMnO4
|
| Дихроматометрия
| K2Cr2O7
|
| Йодометрия
а) прямое тирование;
б) заместительное
| I2, Na2S2O3
|
| Броматометрия, Цериметрия, Ванадометрия
| KBrO3, Ce(SO4)2, NH4VO3
|
| 5. КТ
| Реакция комплексообразованияMex++ nLy- → [MeLn]x-ny
| Трилонометрия
| Трилон Б = динатриевая соль этилендиаминтетрауксусной кислоты = ЭДТА = Na2H2Y
|
Способы выражения концентрации растворов в титриметрии: массовая доля, молярная концентрация, молярная концентрация эквивалента, титр, титр рабочего раствора по определяемому веществу.
| Конц. Ед. изм.
| Расчет
|
| Массовая доля (%)
| 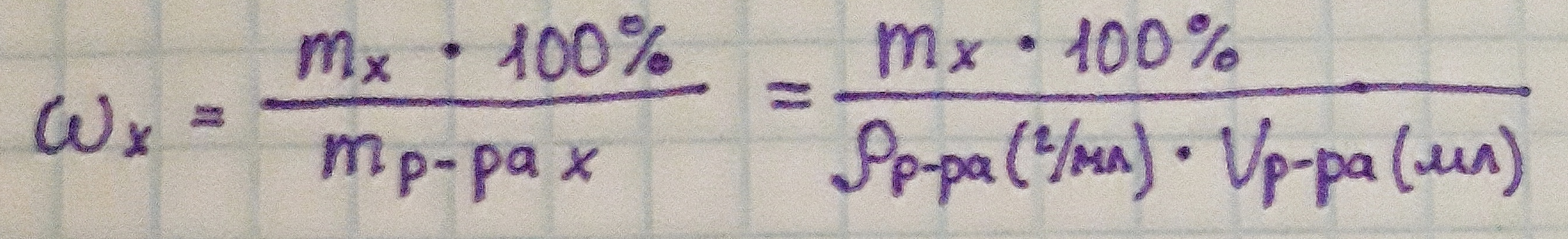
|
| Молярная концентрация (моль/л; М)
| 
|
| Молярная концентрация эквивалента (моль-экв/л; н)
| 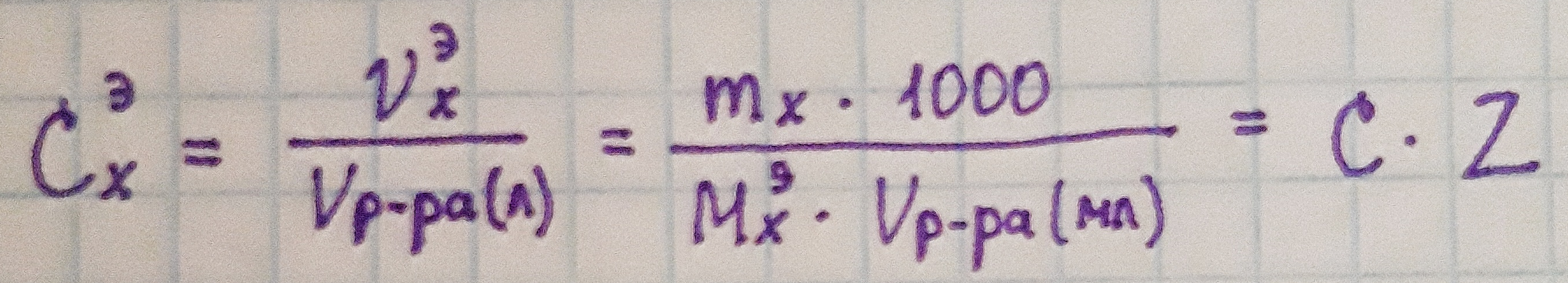
|
| Титр (г/мл)
| 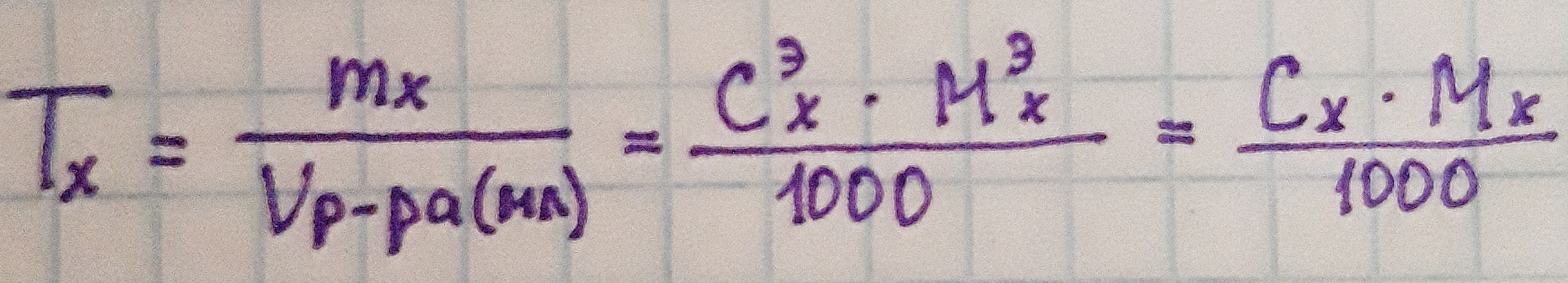
|
| Титр титранта R по определяемому веществу Х (г- Х/мл - R)
| Это не концентрация, а коэффициент соответствия: показывает, сколько г вещества Х эквивалентно 1 мл титрантаR

|



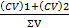

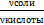 или
pH= pK+lg
или
pH= pK+lg 
 или
pOH= pKb+lg
или
pOH= pKb+lg 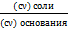
 рН = -lgCизб.кисл.
рН = -lgCизб.кисл.
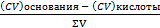 рOН = -lgCизб.осн.
рOН = -lgCизб.осн.