сущность метода; приготовление и стандартизация раствора KMnO4; особенности метода перманганатометрии в разных средах; способы увеличения скорости реакций с участием KMnO4; создание кислой среды для перманганатометрического титрования; примеры использования смеси Рейнгарда-Циммермана; определение С2О42–, Fe2+, Са2+, СаСО3, нитритов, сульфитов, пероксидов, органических веществ.
Перманганатометрия – метод анализа, в котором титрантом служит раствор перманганата калия.
Перманганат калия является сильным окислителем, однако окислительная способность его зависит от рН среды, что видно из значений потенциалов полуреакций:
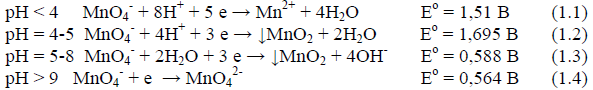
Приготовление раствора перманганата калия. Раствор является вторичным стандартом, так как он всегда загрязнен некоторым количеством оксида марганца (4). Растворы KMnO4 неустойчивы, поскольку ион MnO4- способен окислять воду:
2MnO4– + 2H2O ↔ MnO2↓ + 3O2 + 4OH–
Этот процесс значительно ускоряется при образовании оксида марганца (IV) в связи с его катализирующим действием.
Для приготовления раствора KMnO4 используют дистиллированную деионизированную воду, т.к. даже «следовые» количества Mn2+ увеличивают скорость разложения раствора KMnO4.
Обычно свежеприготовленный раствор KMnO4 нагревают до кипения, фильтруют и оставляют раствор при комнатной температуре в течение нескольких дней. После чего отфильтровывают через стеклянный фильтр. Приготовленный раствор хранят в сосудах из темного стекла. Перед использованием проводят стандартизацию раствора.
Стандартизация
В качестве первичных стандартов для определения точной концентрации КМnО4 чаще всего используются оксалат натрия (Na2C2O4) и щавелевая кислота (Н2С2О4 ∙ 2Н2О).
По щавелевой кислоте. Уравнение реакции между щавелевой кислотой и перманганатом калия:

Особенностью этой реакции является малая ее скорость в начале реакции. Поэтому перманганатом калия титруют горячий раствор щавелевой кислоты (t = 60 – 70°С).
Порядок работы: 1. Промываем и заполняем бюретку раствором KMnO4.
2. В колбу для титрования цилиндром добавляем H2SO4и дистиллированную воду. Далее колбу нагреваем до 70-80°С. Чистую пипетку ополаскиваем раствором Н2С2О4, после чего, отмеряем ею точный объем раствора Н2С2О4и переносим его в колбу для титрования с нагретым раствором H2SO4.
3. Титруем горячий раствор Н2С2О4перманганатом калия. Прибавление первого миллилитра перманганата нужно проводить очень медленно. После того как образовались ионы Mn2+, скорость реакции увеличивается, титрование можно вести быстрее, прибавляя КМnО4 маленькими порциями и сильно перемешивая раствор в колбе.
4. Титрование повторить до получения 2-3 сходящихся результатов. Вычисляем среднее значение объема КМnО4.
По оксалату натрия. 1. Промываем и заполняем бюретку раствором KMnO4.
2. В колбу для титрования отбирают пипеткой 10,0 мл приготовленного стандартного раствора Na2C2O4, приливают H2SO4.
3. Смесь нагревают до 70-80°С и титруют.
4. титрование прекращают, когда одна капля KMnO4окрасит весь раствор в бледно-розовый цвет.
5. Титрование повторяют 2-3 раза.
Особенности:
· Титрование можно проводить без использования индикаторов.
· Титрование осуществляется в кислой (чаще неорганические) и щелочной (органические) средах.
· Для кислой среды необходим дополнительный реагент
| Реакция протекает медленно, так как процесс стадийный. Всего – 4 стадии, четвертая – лимитированная и самая медленная
|
Скорость реакции можно увеличить:
- повышением температуры;
- изменением рН раствора;
- применением катализатора (MnSO4).
Для создания кислой среды при перманганатометрии обычно используют H2SO4, так как НСl (Cl-) иHNO3 могут окисляться перманганатом калия.
Смесь Рейнгарда-Циммермана используется для определения Fe2+ в сильнокислой среде с помощью перманганата калия. Назначение: убрать побочную реакцию, увеличить скорость, облегчить определение КТТ.
H2SO4 – сильнокислая среда;
MnSO4 – катализатор, уменьшает ЕMnO4- / Mn2+;
Н3РО4 – связывает Fe3+ в бесцветный комплекс.
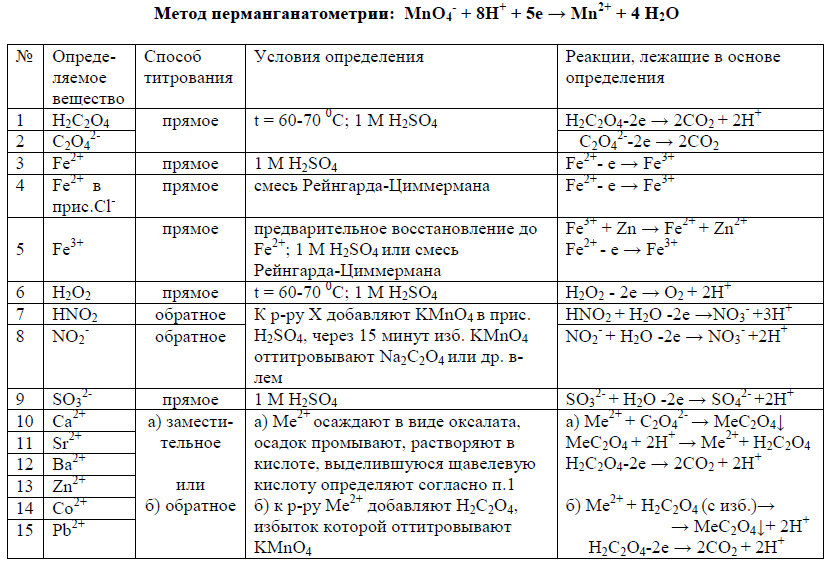
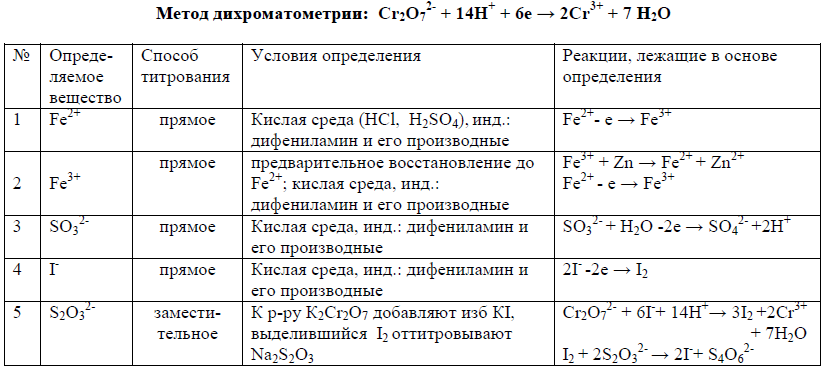
14. Дихроматометрическое титрование: сущность метода; особенности метода; фиксирование КТТ; приготовление стандартного раствора K2Cr2O7; определение Fe2+, Н2О2, KI, Na2S2О3, KAsO2.
Дихроматометрия – метод определения веществ, основанный на реакции их окисления дихромат-ионами.


Приготовление стандартного раствора K2Cr2O7.
1. Расчет массы навески K2Cr2O7 для приготовления 100,0 мл стандартного раствора с молярной концентрацией эквивалента 0,05 моль-экв/л.
2. Взяв на аналитических весах точную навеску соли, количественно перенесите её в мерную колбу. 3. Растворить навеску в 30-40 мл воды, довести объем раствора до метки и тщательно перемешать. Если масса навески несколько отличается от рассчитанной, уточнить концентрацию дихромата калия.
15. Иодометрическое титрование: сущность метода; особенности метода; примеры прямого и заместительного иодометрического титрования; фиксирование КТТ; приготовление и стандартизация раствора I2; стандартизация раствора Na2S2О3 методом заместительного титрования по дихромату калия; прямое йодометрическое определение восстановителей; заместительное йодометрическое определение окислителей K2Cr2O7, KMnO4, Cu2+, Fe3+.
Йодометрия – метод ОВТ, основанный на реакциях, связанных с окислением восстановителей свободным йодом или с восстановлением окислителей йодидом калия.
I2 + 2e ↔ 2I-
Особенности метода:
1.Большая точность по сравнению с другими методами ОВТ.
2. Растворы йода окрашены, и титрование можно проводить без индикатора.
3. Йод хорошо растворяется в органических растворителях, поэтому метод широко применяется для титрования в неводных средах.
4. Титрование проводят на холоду и по возможности быстро.
5. Йодометрическое титрование нельзя проводить в щелочной среде вследствие диспропорционирования йода.




Стандартизация раствора тиосульфата натрия по раствору K2Cr2O7
1. Получаем раствор тиосульфата натрия.
2. Стандартизацию проводят в нескольких параллелях: в колбу для титрования отбираем раствор K2Cr2O7, H2SO4 и 10% KI, закрываем стеклом и выдерживаем в темном месте 5 минут.
3. Далее титруем раствором тиосульфата натрия, добавляя крахмал после достижения светло-желтой окраски.

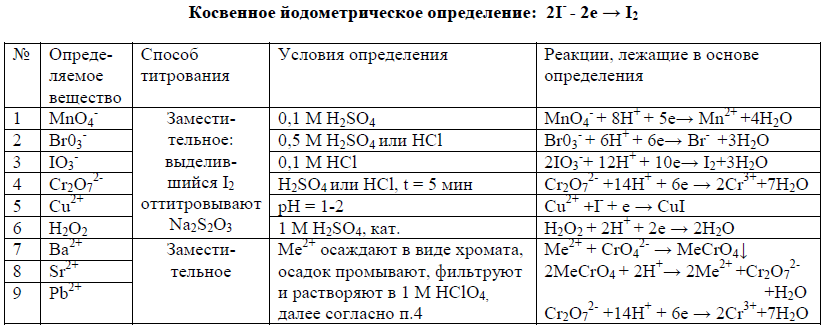
16.Цериметрическое титрование: сущность метода; особенности метода; примеры использования титрантаCe(SO4)2. Определение соли Мора.
Цериметрическое титрование – титриметрический метод анализа, в котором титрантом является соль Ce (+4), обычно Ce(SO4)2.
В процессе цериметрического титрования происходит восстановление Се(4) до Се(3):
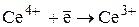 E0 = +1,74 В
E0 = +1,74 В
Гидратированные ионы церия, особенно Ce4+, обладают выраженными кислотными свойствами и образуют малорастворимые гидроксокомплексы, поэтому цериметрическое титрование проводится в сильнокислой среде.
· Стандартизацию сернокислого раствора проводят йодометрически
· ЦТ проводят в присутствии редокс-индикаторов (дифениламин, ферроин и др.)
· Возможность проведения титрования, в присутствии хлорид-ионов.
· ЦТ непригодно для титрования нейтральных и щелочных растворов.
В цериметрическом титровании обычно используют серную кислоту. Растворы Ce4+ в HNO3 и HClO4 при хранении менее устойчивы, потому что Ce4+ в таких растворах является более сильным окислителем и может окислять воду. Растворы церия Ce4+ в HCl также недостаточно устойчивы вследствие возможного окисления хлорид-ионов.
Стандартный раствор Ce(SO4)2 готовят из Ce(SO4)2×4H2O или Ce(SO4)2×2(NH4)2SO4×2H2O путём растворения навески в 1 М серной кислоте. Стандартный раствор Ce(SO4)2 обычно является вторичным. Для его стандартизации используют Na2C2O4, соль Мора, заместительное иодометрическое титрование и т.д.
Обнаружение конечной точки цериметрического титрования может проводиться по собственной окраске титранта (гидратированный ион Ce4+ - жёлтый, а Ce3+ - бесцветный). Однако чаще для этой цели используют окислительно-восстановительные индикаторы - дифениламин, ферроин и др.
Прямое цериметрическое титрование используется для определения различных восстановителей: как неорганических (Fe2+, H2O2, SO32- и др.), так и органических.
В случае обратного цериметрического титрования вторым стандартным раствором обычно является раствор Fe2+. Известны методики цериметрического титрования, в которых проводится титрование заместителя. Таким образом определяют сильные восстановители, легко окисляющиеся кислородом воздуха. Цериметрическое титрование может быть использовано и для определения некоторых окислителей, например, персульфат-ионов. К исследуемому раствору вначале добавляют избыток стандартного раствора Fe2+, а затем титруют избыток Fe2+ стандартным раствором Ce(SO4)2.



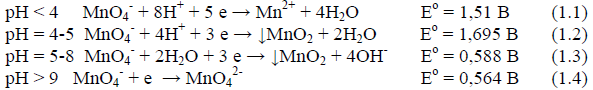












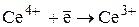 E0 = +1,74 В
E0 = +1,74 В


