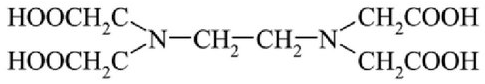Пример – индикатор Фольгарда NH4Fe3+(SO4)2▪10H2O(раствор железо-аммонийных квасцов) для роданометрического определения серебра

Условия применения индикатора Мора:
1) Ограничение рН ≤2 для предотвращения гидролиза ионов Fe3+;
2) Оптимальная концентрации индикатора – 0,015 моль/л
Адсорбционные индикаторы – это индикаторы, адсорбция и десорбция которых на осадке сопровождается изменением окраски осадкаю

Пример: аргентометрическое титрование Cl - в присутствии флуоресцеина.
Аналитическая реакция: Cl- + Ag+ → AgCl↓
Флуоресцеин – слабая органическая кислота: HInd ↔ H + + Ind -
· До ТЭ в избытке Cl-, ионы Cl- адсорбируются на поверхности осадка AgCl, поверхность осадка заряжается «-». Частицы Ind- не адсорбируются.
Раствор – желто-зеленый. Осадок – белый (желтоватый).
· После ТЭ в избытке Ag+, ионы Ag+ адсорбируются на поверхности осадка AgCl, поверхность осадка заряжается «+». Частицы Ind- адсорбируются на осадке вторым слоем (как противоионы).
От первой избыточной капли титранта осадок окрашивается в розовый цвет.
Условия применения адсорбционного индикатора:

4) Адсорбционная способность индикатора должна быть небольшой: Индикатор должен адсорбироваться на осадке только после ТЭ.

Комплексоны. Комплексные соединения, используемые в методе комплексонометрии.
Комплексоны – это полидентантные органические лиганды, имеющие и кислотные и основные центры, которые расположены таким образом, чтобы при взаимодействии с катионом Меn+замыкалось не менее 2 циклов.
Образующиеся комплексные соединения относят к классу хелатов.
Нитрилтриуксусная кислота, комплексон А.

· Белое кристаллическое вещество, плохо растворимое в горячей воде, кислотах, хорошо растворимое в щелочах.
· Одна молекула комплексона может образовывать с катионом металла 4 связи, служит тетрадентантнымлигандом.
Этилендиаминтетрауксусная кислота (ЭДТА), Комплексон 2, H 4 Y
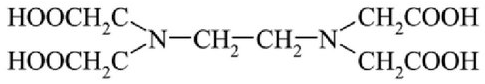
· Белое кристаллическое вещество, плохо растворимое в горячей воде, кислотах, хорошо растворимое в щелочах.
· Одна молекула комплексона может образовывать с катионом металла 4или 6 связей, служит тетра(гекса)дентантнымлигандом.
ЭДТА

Динатриевая соль этилендиаминтетрауксусной кислоты, динатрийдигидроэтилендиаминтетраацетат, ЭДТА, Комплексон 3, Na 2 H 2 Y, трилон Б

· Белое кристаллическое вещество, хорошо растворимое в воде: Na2H2Y * 2Н2О.
· Одна молекула комплексона может образовывать с катионом металла 4 или 6 связей.
4. Комплексонометрическое титрование: принцип метода, требования к реакциям.
КТ – это титриметрический метод анализа, в котором титрантом служит комплексон.
Реакции, используемые в комплексометрии, должны отвечать следующим основным требованиям.
· Стехиометричность. В реакции должен образовываться один продукт точно определенного состава (побочных стадий в реакции не допускается).
· Полнота протекания реакции. Реакция, лежащая в основе титрования, должна протекать практически до конца, т. е. не менее чем на 99,99 %. Для того чтобы реакция комплексообразования прошла до конца (на —99,99 %), необходимо, чтобы образующийся комплекс обладал высокой устойчивостью (константа нестойкости должна быть < 108).
· Скорость реакции. Реакция комплексообразования должна протекать быстро и равновесие должно устанавливаться практически мгновенно.
5. Особенности комплексообразования при взаимодействии катиона металла с ЭДТА.


6. Металлохромные индикаторы. Эриохром черный Т: строение, примеры использования.


7. Приготовление и стандартизация раствора ЭДТА = комплексона III.
Приготовление раствора ЭДТА
а) Рассчитайте навеску Na2H2Y∙2H2O (М = 372,25 г/моль), необходимую для приготовления 250 мл раствора ЭДТА с концентрацией 0,05 моль/л. Навеску возьмите на аптечных или технических весах.
б) Взвешенный реактив Na2H2Y∙2H2O количественно перенесите в мерный стакан на 250 мл, растворите в 40-50 мл воды, доведите водой до 250 мл и тщательно перемешайте.
Стандартизация раствора ЭДТА по раствору ZnCl2.
а) Узнайте у преподавателя степень чистоты металлического цинка (если цинк содержит примеси, это необходимо учесть).
б) Рассчитайте навеску металлического цинка для приготовления 100,0 мл раствора ZnCl2 с концентрацией 0,1 моль/л.
в) Возьмите навеску на аналитических весах, учитывая. что масса одной гранулы цинка 0,4-0,7 г.
г) Навеску металлического цинка перенесите в термостойкий стакан (колбу). Добавьте ≈ 10 мл 16 % раствора НС1. Нагрейте до полного растворения цинка. Опыт проводите только в вытяжном шкафу! До полного охлаждения полученного раствора ZnCl2 не вынимайте его из вытяжного шкафа, чтобы не отравиться хлороводородом. После чего количественно перенесите содержимое стакана в мерную колбу на 100,0 мл. Доведите раствор до метки дистиллированной водой, тщательно перемешайте.
д) Рассчитайте точную концентрацию раствора ZnCl2.
е) В колбу для титрования перенесите 5,0 мл раствора ZnCl2, цилиндром добавьте 20 мл воды и нейтрализуйте избыточную соляную кислоту, добавляя по каплям с помощью капельницы раствор аммиака до рН = 6-7. Контроль за рН можно провести по универсальной индикаторной бумаге. После этого добавьте 10 мл аммиачного буферного раствора и индикатор эриохром черный Т. Раствор приобретает винно-красную окраску. Винно- красный раствор оттитруйте раствором ЭДТА до появления синей окраски раствора. Титрование проведите не менее 3 раз до получения сходимых результатов. Результаты титрования не должны отличаться более чем на 0,1 мл.