Кислотно-основная классификация катионов. Реакции, подтверждающие принадлежность катиона к определенной группе.

| Аналитическая группа
| Реакция, подтверждающая принадлежность катиона к определенной группе
|
| I (К+, Na+, NH4, Li+)
| Групповой реагент отсутствует, следовательно, продукты взаимодействия и их свойства отсутствуют
|
| II(Ag+, Pb2+, Hg2+)
| Групповой реагент – HCl
Ag+HCl=AgCl+H2O
Осадки не растворяются в разбавленных кислотах
|
| III (Са2+, Sr2+, Ва2+)
| Групповойреагент – H2SO4
Ca(NO3)2+H2SO4=CaSO4+2HNO3
Осадки не растворяются в кислотах, щелочах, аммиаке
|
| IV (Al3+, Cr3+, Zn2+, Sn2+, Sn4+)
| Групповойреагент – NaOH (избыток)
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Осадки растворяются в присутствии избытка гидроксида натрия
|
| V (Мn2+, Fe2+, Fe3+, Bi3+, Sb3+, Sb(V), Mg2+)
| Групповойреагент – NaOH
MgCl2+2NaOH=Mg(OH)2+2NaCl
Осадки не растворяются в избытке щелочи и аммиака
|
| VI (Cu2+, Ni2+, Cd2+, Hg2+, Со2+)
| Групповой реагент – 25%-ный раствор аммиака
Cu(OH)2 + 4(NH3*H2O)= [Cu(NH3)4](OH)2 + 4H2O
Осадки растворяются в присутствии избытка группового реагента с образованием аммиакатов.
|
2. Предварительные испытания на катионы Fe2+, Fe3+, Bi3+, Cu2+, Mn2+, Cr3+
3. Классификация анионов.


4. Предварительные испытания на анионы неустойчивых кислот СO32-; SO32-; S2-
Вместимости мерных колб, пипеток, бюреток, изготавливаемых промышленно
· Мерные колбы имеют вместимость 25.0; 50.0; 100.0; 200.0; 250.0; 500.0; 1000.0 и 2000.0 мл.
· Пипетки бывают двух типов: градуированные (дифференциальные) и пипетки Мора. Пипетки Мора бывают вместимостью 1,0; 2,0; 5,0; 10,0; 15,0; 20,0; 25,0; 50,0 и 100,0 мл. Градуированные пипетки бывают вместимостью 1,0; 2,0; 5,0; 10,0 и 25,0 мл. Вместимость указывается изготовителем в верхней или средней части. Пипетки вместимостью менее 1 мл называются микропипетками; с их помощью можно отбирать объемы, измеряемы десятыми и сотыми долями миллилитра.
· Вместимость обычных бюреток —25,0 и 50,0 мл, реже используются бюретки на 100,0 мл. При необходимости измерять небольшие объемы — от 5 мл до десятых долей миллилитра — пользуются микробюреткой.
Статистическая обработка выборки: проверка на промахи, расчет доверительного интервала, доверительных границ, проверка на присутствие систематической погрешности.
Проверка на промахи
Правило 1. Результаты располагают по возрастанию в линию. Промахом может быть минимальный или максимальный результат, более сильно отличающийся от соседнего.
Qкритерий = 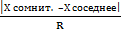
Размах варьирования R = Xmax – Xmin
Правило 2. Результат является промахом, если при данной доверительной вероятностиQрасчет>Qтабл. В этом случае результат выбрасывают, статистическую обработку результатов проводят без него.
Правило 3. Результат не промах, если при Qрасчет<Qтабл. В этом случае статистической обработке подвергают все результаты.
Для объединенной выборки
- Среднее значение  = ½ (
= ½ (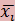 +
+ 
- Число степеней свободы
- Средневзвешенная дисперсия
- Стандартное отклонение
- Полуширина доверительного интервала (tберется при р=0,99 и при f= f1 + f2)
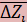 =
= 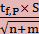
- Доверительный интервал
Результат = 
9. Правила округления при расчетах.
· Значащими цифрами в числе называются все достоверные цифры + первая из недостоверных. Результаты вычислений необходимо выражать только значащими цифрами, т.е. округлять до первой недостоверной.
Округление массы навески. На аналитических весах с погрешностью 0,0002 г массу округляют до десятитысячных, а на технических весах с погрешностью 0,01 г округляют до сотых.
Округление объема.
· Мерный стакан, цилиндр, мензурка – 5, 8, 10, 25, 50, 100, 180, 200, 230, 250, 2000 мл
· Мерная колба – 25,0; 50,0; 100,0; 200,0; 250,0 мл и т.д.
· Пипетка Мора – 1,0; 2,0; 5,0; 10,0; 15,0; 20,0; 50,0 мл
· Градуированная пипетка – 0,50; 0,85; 5,5; 6,0; 10,0 и т.д.
· Бюретка – 10,15; 12,20 мл
Требования к осаждаемой и гравиметрической формам. Примеры.
Требования к осаждаемой форме:
- растворимость не более погрешности взвешивания на аналитических весах: летучие S≤ 10-6 моль/л, крайний случай S ≤ 10-5 моль/л.
- Устойчивость к внешним воздействиям
- Способность легко фильтроваться
В этом отношении очень удобны крупнокристаллические осадки, т.к.они почти не забивают поры фильтра, мало загрязняются посторонними примесями из анализируемого раствора и легко отмываются от них.
Аморфные осадки типа Al(OH)3 и Fe(OH)3, имея сильно развитую поверхность, являясь рыхлыми и объемными, значительно адсорбируют примеси из анализируемого раствора, трудно отмываются от них, а также медленно фильтруются.
- Чистота или же способность отмываться от примесей
- Легкий переход в гр.ф.
Требования к гравиметрической форме:
- точное соответствие химической формуле
- химическая устойчивость
Например, осадок СаО, легко поглощающий Н2О и СО2 из воздуха (что затрудняет его точное взвешивание), иногда превращают в CaSO4, обработав серной кислотой.
- чистота
- по возможности, большая молекулярная масса: чем больше М гр.ф., тем точнее анализ, более низкое содержание вещества X можно определить.
7. Условия образования аморфных и кристаллических осадков.
| Условия
| Для получения кристаллических осадков
| Для получения аморфных осадков
|
| Чего добиваемся
| Уменьшения Р, получения более крупных кристаллов
| Увеличения Р, получения более плотного аморфного осадка
|
| Концентрация исходного раствора и осадителя
| Малая: осаждение ведут из разбавленного раствора разбавленным раствором осадителя
| Высокая: осаждение ведут из концентрированного раствора концентрированным раствором осадителя
|
| Температура
| Высокая: осаждение ведут из горячего раствора горячим раствором осадителя
| Высокая: уменьшаем адсорбцию, предотвращаем пептизацию – переход осадка в коллоидный раствор
|
| Скорость осаждения
| Малая: осаждение ведут медленно, первые порции по каплям
| Высокая: осаждение ведут быстро, осадитель добавляют струей
|
| Перемешивание
| Постоянно
| Постоянно
|
| Добавление постороннего электролита
| Например: добавление кислоты – увеличивает I (ионную силу) раствора, увеличивает S, снижает P
| Вводят электролит-коагулятор
NH4Cl, NH4NO3
|
| Операция в конце осаждения
| Добавляют 50% избыток осадителя
| Добавляют 100 мл горячей дистиллированной воды и перемешивают
|
| Хранение осадка
| Осадок оставляют для созревания (старения) от 1 до 24 ч.
| Осадки не хранят, так как они переходят в гемообразные структуры
|
8. Принцип гравиметрического определения Ag+, Cl-, Ba2+, SO42-, Mg2+, Ca2+, PO43-, Fe2+, Fe3+.
??? Осаждаемое вещество (Х) – Ag +, осадитель (R) – HCl
Реакция получения осаждаемой формы:
Ag+ + Cl-→ AgCl↓(крист.)
Схема или реакция получения гр.ф.:
AgCl → AgCl
А) Расчет рН сильных кислот
| Концентрация кислоты, моль/л
| Концентрация Н+, моль/л
| рН
|
| С>10-2
| 1. Расчет I (9)
2. fдля Н+ (11)
3. a (H+) (10)
| (14)
pH = -lgaH+
|
| 10-5≤С≤10-2
| C(H+) = Cкисл.
| (15)
pH = -lgCкисл.
|
| C<10-5
| ΣС(Н+)=Скисл.+ Сн+(от Н2О)
| (16)
рН= -lg(ΣCн+)
|
(9) Ионная сила раствора I = ½*Σ(Сi*Zi2)
(10) Активная концентрация иона a = f*c
(11) Коэффициент активности иона f берется из таблиц, если известен заряд иона и ионная сила раствора f табл.
Вариант 1 – очень слабая кислота
| Оценка α
| Концентрация Н+
Расчет рН
|
α≤5% (13)
или
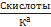 ≥ 400 ≥ 400
| Из формулы 12, считая, что [Н+] мала
[Н+]= 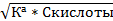 pH= ½*(pK1a-lgCкисл.)
pH= ½*(pK1a-lgCкисл.)
|
(12) Связь между константой ионизации и концентрацией протонов (гидроксид-ионов):
К ионизации кислоты = 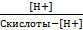 ; К ионизации основания =
; К ионизации основания = 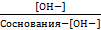
(13) Степень диссоциации (ионизации) + закон разбавления Оствальда:
α = 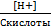 ≈
≈ 
Вариант 2 – кислота средней силы
| Оценка α
| Концентрация Н+
Расчет рН
|
α>5% (13)
или
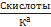 < 400 < 400
| Из формулы 12, решая квадратное уравнение
[Н+]= 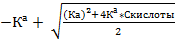 pH рассчитать по формуле 4
pH рассчитать по формуле 4
|
(4) Водородный показатель рН = -lg[Н+]
Б) Расчет рОН растворов слабых оснований
Вариант 1 – очень слабое основание
| Оценка α
| Концентрация Н+
Расчет рН
|
α≤5%
или
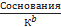 ≥ 400 ≥ 400
| Из формулы 12, считая, что [OН+] мала
[OН-]= 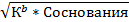 pОH= ½*(pK1b-lgCосн.)
pОH= ½*(pK1b-lgCосн.)
|
Вариант 2 – основание средней силы
| Оценка α
| Концентрация Н+
Расчет рН
|
α>5%
или
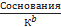 < 400 < 400
| Из формулы 12, решая квадратное уравнение
[OН-]= 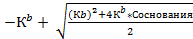 pOH рассчитать по формуле 5
pOH рассчитать по формуле 5
|
(5) Гидроксильный показатель pOH = -lg[OН-]
Первичные и вторичные стандарты. Требования к исходным веществам для установки титра (первичным стандартам). Фиксаналы.
· Для титриметрического определения Х нужно знать точную концентрацию титрантаR!!!
· Раствор с точно известной концентрацией – стандартный раствор или стандарт (старые названия: стандарт–титр и титрованный раствор
· По способу приготовления различают первичные и вторичные стандарты
Требования к первичным стандартам:
1) Высокая степень чистоты (о.с.ч. или х.ч.)
2) Постоянный состав, точно соответствующий химической формуле
3) Химическая устойчивость, отсутствие взаимодействия с компонентами атмосферы и растворителем
4) Существование доступных и надежных методов, подтверждающих чистоту и состав вещества
Примеры первичных стандартов
Кристаллические вещества:
Na2CO3 (сода); CaCO3; K2Cr2O7; Н2С2О4*Н2О (дигидрат щавелевой кислоты); HOOC-(CH2)2-COOH (янтарная кислота); Na2C2O4 (оксалат натрия); Na2B4O7*10H2O (тетраборат натрия или бура)
Фиксаналы:
HCl, H2SO4, MgSO4
Приготовление первичного стандарта:
1) из фиксанала (запаенная стеклянная трубка с реактивом) в мерной колбе
2) по точной навеске в мерной колбе (используют в методе пипетирования)
3) по точной навеске в колбе для титрования (используют в методе отдельных навесок)
Если вещество не соответствует хотя бы одному из требований для первичных стандартов, оно является вторичным стандартом.
Желательно, чтобы первичный стандарт:
1) не содержал воду или же количество кристаллизационной воды в молекуле было строго постоянным
2) имел высокую эквивалентную массу, в этом случае исходная навеска вещества больше, погрешность анализа меньше
3) не менял свою концентрацию при хранении в растворе
| Вторичный стандарт
| Почему вещество не является первичным стандартом?
| По какому веществу идет стандартизация?
|
| HCl, H2SO4
| растворы приготовлены разбавлением
| Na2CO3, CaCO3, бура
|
| NaOH, KOH
| щелочь поглощает СО2 воздуха, на его поверхности пленка из карбоната
| фиксаналHCl, H2SO4, янтарная кислота, щавелевая кислота
|
| KMnO4
| Вещество содержит примесь MnO2, неустойчиво:
Разлагается при нагревании, на свету разлагаются даже свежие растворы, окисляет воду, при хранении раствора концентрация растворенных веществ уменьшается, так как выпадает осадок MnO2
| Н2С2О4*Н2О,
Na2C2O4,
сольМора(NH4)2Fe(SO4)2*6H2O
|
| Na2S2O3
| Вещество неустойчиво, разлагается в кислой среде, на свету и при нагревании
| K2Cr2O7
|
| I2
| Вещество разлагается
| Na2S2O3
|
| Na2H2Y (ЭДТА)
| Вещество неустойчиво
| Zn, фиксаналMgSO4
|
Метод пипетирования
1. Готовят раствор первичного стандарта растворением точной навески в воде в мерной колбе.
2. В колбу для титрования пипеткой отбирают аликвотную часть и титруют раствором вторичного стандарта.
3. По результатам титрования пользуясь законом эквивалентов находят концентрация раствора вторичного стандарта.
Титрование сильной кислоты
HCl + NaOH → NaCl + H2O
Для фиксирования КТТ можно использовать любой индикатор с рТ=3--11. Например, м/о (рТ=4,0) или ф/ф 2 капли (рТ=9,0).
Титрование слабой кислоты
СН3СООН + NaOH → СН3СООNa + Н2О
Для фиксирования КТТ используют ф/ф (рТ=9,0)
Методика: Вариант 1. В 1 колбу для титрования помещают смесь, добавляют м/о и титруют раствором NaOH, фиксируют по бюретке VR(м/о); добавляют ф/ф и продолжают титрование до изменения цвета индикатора, фиксируют по бюретке VR(ф/ф).
Вариант 2. В 2 колбы для титрования помещают одинаковое количество смеси; в одну – добавляют м/о, в другую – ф/ф. Растворы оттитровываютNaOH, фиксируют по бюретке VR(м/о) и VR(ф/ф).
Титрование смеси NaOH и Na2CO3
В коническую колбу или мерный стакан на 2000 мл мерным цилиндром перенесите 500 мл дистиллированной воды, мензуркой добавьте рассчитанное количество концентрированной кислоты, после чего водой доведите объем раствора до 2 л. Тщательно перемешайте приготовленный раствор.
Примеры использования индикатора Мора, индикатора Фольгарда, адсорбционного индикатора.
1) Осадительные индикаторы образуют с титрантом окрашенный осадок вблизи ТЭ.
Пример – индикатор Мора (К2 CrO 4) для аргентометрического титрования Cl-

Условия применения индикатора Мора:
1) Ограничение рН = 6,5-10,3
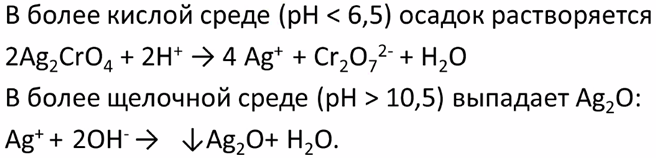
2) Ограничение по составу раствора: не должно быть ионов свинца, бария, висмута, дающих нерастворимые хроматы.
3) Оптимальная концентрации индикатора – 0,005 моль/л
ЭДТА

Динатриевая соль этилендиаминтетрауксусной кислоты, динатрийдигидроэтилендиаминтетраацетат, ЭДТА, Комплексон 3, Na 2 H 2 Y, трилон Б

· Белое кристаллическое вещество, хорошо растворимое в воде: Na2H2Y * 2Н2О.
· Одна молекула комплексона может образовывать с катионом металла 4 или 6 связей.
4. Комплексонометрическое титрование: принцип метода, требования к реакциям.
КТ – это титриметрический метод анализа, в котором титрантом служит комплексон.
Реакции, используемые в комплексометрии, должны отвечать следующим основным требованиям.
· Стехиометричность. В реакции должен образовываться один продукт точно определенного состава (побочных стадий в реакции не допускается).
· Полнота протекания реакции. Реакция, лежащая в основе титрования, должна протекать практически до конца, т. е. не менее чем на 99,99 %. Для того чтобы реакция комплексообразования прошла до конца (на —99,99 %), необходимо, чтобы образующийся комплекс обладал высокой устойчивостью (константа нестойкости должна быть < 108).
· Скорость реакции. Реакция комплексообразования должна протекать быстро и равновесие должно устанавливаться практически мгновенно.
5. Особенности комплексообразования при взаимодействии катиона металла с ЭДТА.


6. Металлохромные индикаторы. Эриохром черный Т: строение, примеры использования.


7. Приготовление и стандартизация раствора ЭДТА = комплексона III.
Приготовление раствора ЭДТА
а) Рассчитайте навеску Na2H2Y∙2H2O (М = 372,25 г/моль), необходимую для приготовления 250 мл раствора ЭДТА с концентрацией 0,05 моль/л. Навеску возьмите на аптечных или технических весах.
б) Взвешенный реактив Na2H2Y∙2H2O количественно перенесите в мерный стакан на 250 мл, растворите в 40-50 мл воды, доведите водой до 250 мл и тщательно перемешайте.
Стандартизация раствора ЭДТА по раствору ZnCl2.
а) Узнайте у преподавателя степень чистоты металлического цинка (если цинк содержит примеси, это необходимо учесть).
б) Рассчитайте навеску металлического цинка для приготовления 100,0 мл раствора ZnCl2 с концентрацией 0,1 моль/л.
в) Возьмите навеску на аналитических весах, учитывая. что масса одной гранулы цинка 0,4-0,7 г.
г) Навеску металлического цинка перенесите в термостойкий стакан (колбу). Добавьте ≈ 10 мл 16 % раствора НС1. Нагрейте до полного растворения цинка. Опыт проводите только в вытяжном шкафу! До полного охлаждения полученного раствора ZnCl2 не вынимайте его из вытяжного шкафа, чтобы не отравиться хлороводородом. После чего количественно перенесите содержимое стакана в мерную колбу на 100,0 мл. Доведите раствор до метки дистиллированной водой, тщательно перемешайте.
д) Рассчитайте точную концентрацию раствора ZnCl2.
е) В колбу для титрования перенесите 5,0 мл раствора ZnCl2, цилиндром добавьте 20 мл воды и нейтрализуйте избыточную соляную кислоту, добавляя по каплям с помощью капельницы раствор аммиака до рН = 6-7. Контроль за рН можно провести по универсальной индикаторной бумаге. После этого добавьте 10 мл аммиачного буферного раствора и индикатор эриохром черный Т. Раствор приобретает винно-красную окраску. Винно- красный раствор оттитруйте раствором ЭДТА до появления синей окраски раствора. Титрование проведите не менее 3 раз до получения сходимых результатов. Результаты титрования не должны отличаться более чем на 0,1 мл.
Правило №1
В кислой среде в ту сторону полуреакции, где не хватает атомов О, ставят столько же молекул Н2О. В другую сторону полуреакции – удвоенное количество Н+.
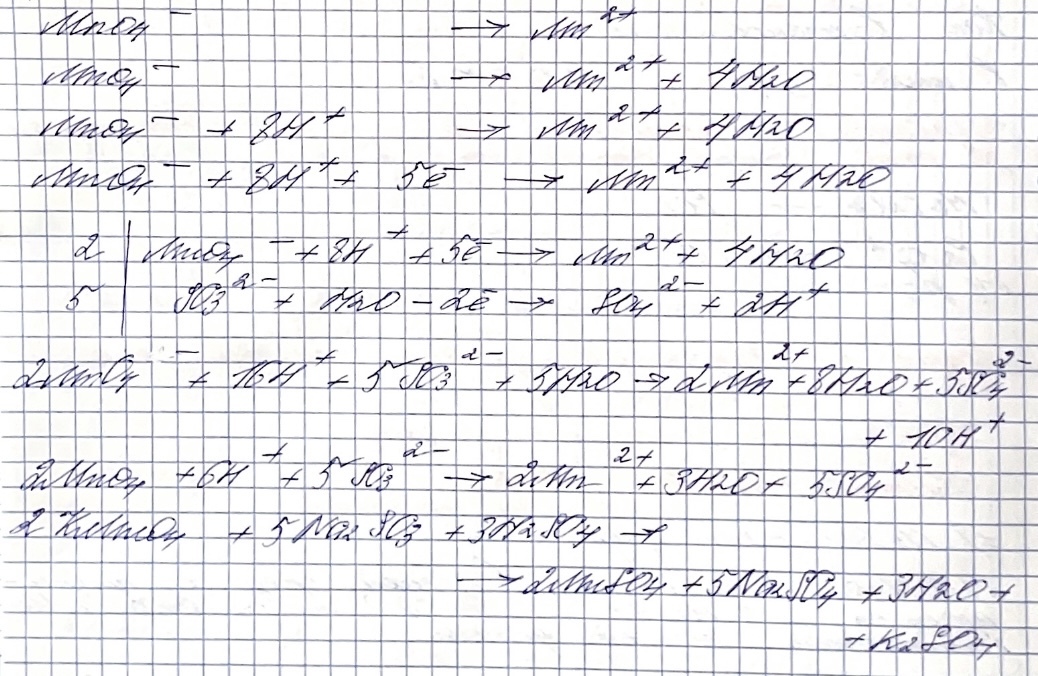
Правило №2
В щелочной среде в ту сторону полуреакции, где избыток атомов О, ставят столько же молекул Н2О. В другую сторону полуреакции – удвоенное количество ОН-.
Правило №3
В щелочной среде в ту сторону полуреакции, где избыток атомов Н, ставят столько же ОН- групп. В другую сторону полуреакции добавляют столько же Н2О.

Требования к титранту и ОВР
1. Полнота протекания ОВР
ΔЕ = Е окислителя – Е восстановителя ≥ 0,2В
2. Желательно, чтобы титрант был сильным окислителем

3. Титрант не должен вступать в побочные реакции
4. Высокая скорость реакции
- большинство ОВР идут медленнее КОР
- многостадийность восстановления
Mn+7 → Mn+6 → Mn+4 → Mn+3→ Mn+2
- ↑ скорость: ↑t до 60-70 градусов (добавить катализатор MnSO4)
5. Наличие способа фиксирования КТТ
- перманганатометрия в кислой среде – безиндикаторное титрование (бесцветный → розовый)
- дихроматометрическое титрование: на фоне зеленого расвтора нужно увидеть лишнюю каплю оранжевого цвета. Нереально. Используют дифениламин: синий → зеленый. Йод с крахмалом образует прочный комплекс, индикатор добавляют только в конце титрования.
Уравнение Нернста
· Для концентрированного раствора:
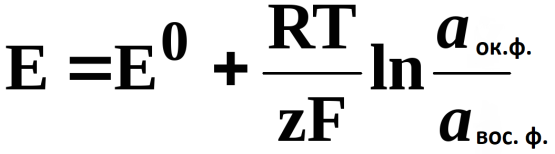
· Для разбавленного раствора:
- при любой температуре

- при 298 К=25°С

Факторы, влияющие на ОВП
1. Природа данной системы.
2. Концентрация ок.ф., в.ф., их отношение.
3. Температура
4. Кислотность раствора (рН, рОН)
5. Комплексообразование с участием одного из ионов
6. Осаждение с участием одного из ионов.
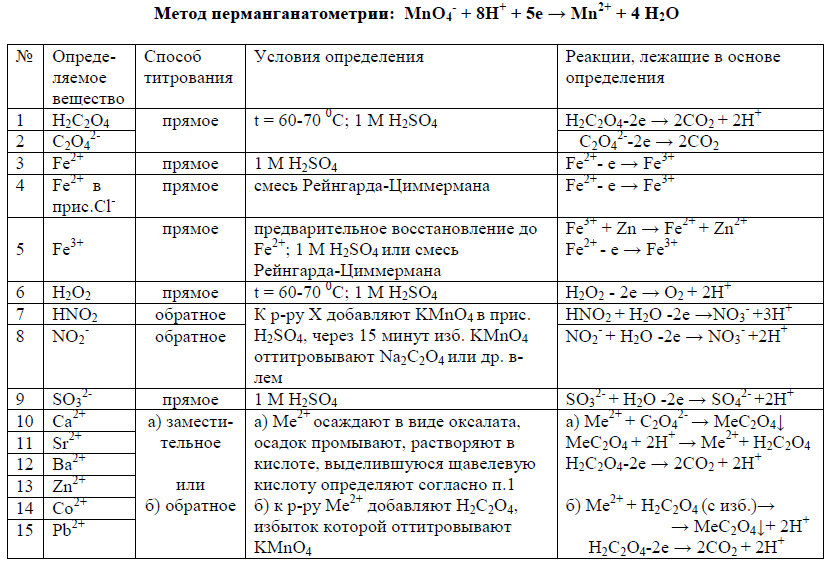
Стандартизация
В качестве первичных стандартов для определения точной концентрации КМnО4 чаще всего используются оксалат натрия (Na2C2O4) и щавелевая кислота (Н2С2О4 ∙ 2Н2О).
По щавелевой кислоте. Уравнение реакции между щавелевой кислотой и перманганатом калия:

Особенностью этой реакции является малая ее скорость в начале реакции. Поэтому перманганатом калия титруют горячий раствор щавелевой кислоты (t = 60 – 70°С).
Порядок работы: 1. Промываем и заполняем бюретку раствором KMnO4.
2. В колбу для титрования цилиндром добавляем H2SO4и дистиллированную воду. Далее колбу нагреваем до 70-80°С. Чистую пипетку ополаскиваем раствором Н2С2О4, после чего, отмеряем ею точный объем раствора Н2С2О4и переносим его в колбу для титрования с нагретым раствором H2SO4.
3. Титруем горячий раствор Н2С2О4перманганатом калия. Прибавление первого миллилитра перманганата нужно проводить очень медленно. После того как образовались ионы Mn2+, скорость реакции увеличивается, титрование можно вести быстрее, прибавляя КМnО4 маленькими порциями и сильно перемешивая раствор в колбе.
4. Титрование повторить до получения 2-3 сходящихся результатов. Вычисляем среднее значение объема КМnО4.
По оксалату натрия. 1. Промываем и заполняем бюретку раствором KMnO4.
2. В колбу для титрования отбирают пипеткой 10,0 мл приготовленного стандартного раствора Na2C2O4, приливают H2SO4.
3. Смесь нагревают до 70-80°С и титруют.
4. титрование прекращают, когда одна капля KMnO4окрасит весь раствор в бледно-розовый цвет.
5. Титрование повторяют 2-3 раза.
Особенности:
· Титрование можно проводить без использования индикаторов.
· Титрование осуществляется в кислой (чаще неорганические) и щелочной (органические) средах.
· Для кислой среды необходим дополнительный реагент
| Реакция протекает медленно, так как процесс стадийный. Всего – 4 стадии, четвертая – лимитированная и самая медленная
|
Скорость реакции можно увеличить:
- повышением температуры;
- изменением рН раствора;
- применением катализатора (MnSO4).
Для создания кислой среды при перманганатометрии обычно используют H2SO4, так как НСl (Cl-) иHNO3 могут окисляться перманганатом калия.
Смесь Рейнгарда-Циммермана используется для определения Fe2+ в сильнокислой среде с помощью перманганата калия. Назначение: убрать побочную реакцию, увеличить скорость, облегчить определение КТТ.
H2SO4 – сильнокислая среда;
MnSO4 – катализатор, уменьшает ЕMnO4- / Mn2+;
Н3РО4 – связывает Fe3+ в бесцветный комплекс.
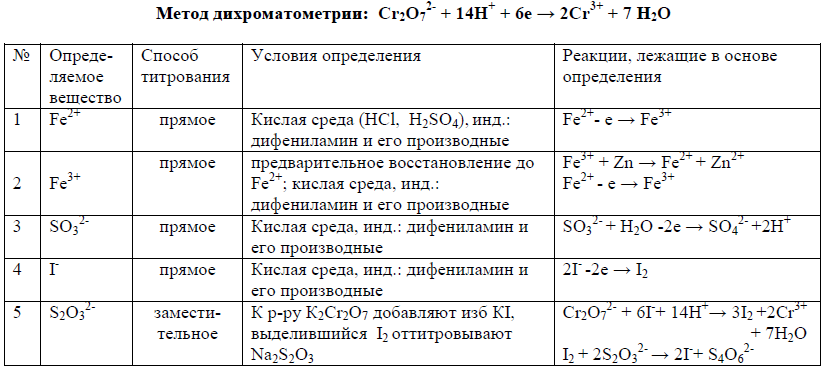
14. Дихроматометрическое титрование: сущность метода; особенности метода; фиксирование КТТ; приготовление стандартного раствора K2Cr2O7; определение Fe2+, Н2О2, KI, Na2S2О3, KAsO2.
Дихроматометрия – метод определения веществ, основанный на реакции их окисления дихромат-ионами.


Приготовление стандартного раствора K2Cr2O7.
1. Расчет массы навески K2Cr2O7 для приготовления 100,0 мл стандартного раствора с молярной концентрацией эквивалента 0,05 моль-экв/л.
2. Взяв на аналитических весах точную навеску соли, количественно перенесите её в мерную колбу. 3. Растворить навеску в 30-40 мл воды, довести объем раствора до метки и тщательно перемешать. Если масса навески несколько отличается от рассчитанной, уточнить концентрацию дихромата калия.
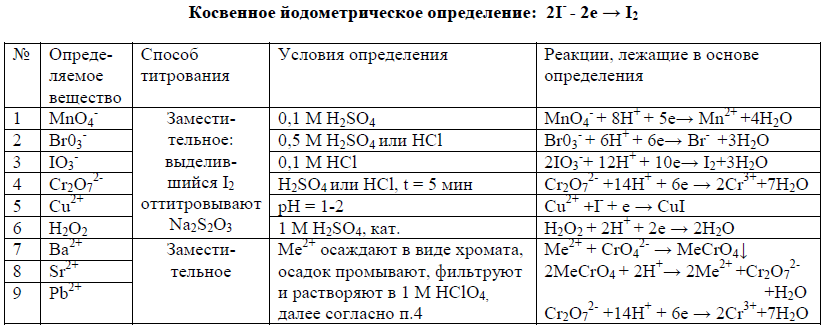
15. Иодометрическое титрование: сущность метода; особенности метода; примеры прямого и заместительного иодометрического титрования; фиксирование КТТ; приготовление и стандартизация раствора I2; стандартизация раствора Na2S2О3 методом заместительного титрования по дихромату калия; прямое йодометрическое определение восстановителей; заместительное йодометрическое определение окислителей K2Cr2O7, KMnO4, Cu2+, Fe3+.
Йодометрия – метод ОВТ, основанный на реакциях, связанных с окислением восстановителей свободным йодом или с восстановлением окислителей йодидом калия.
I2 + 2e ↔ 2I-
Особенности метода:
1.Большая точность по сравнению с другими методами ОВТ.
2. Растворы йода окрашены, и титрование можно проводить без индикатора.
3. Йод хорошо растворяется в органических растворителях, поэтому метод широко применяется для титрования в неводных средах.
4. Титрование проводят на холоду и по возможности быстро.
5. Йодометрическое титрование нельзя проводить в щелочной среде вследствие диспропорционирования йода.




Стандартизация раствора тиосульфата натрия по раствору K2Cr2O7
1. Получаем раствор тиосульфата натрия.
2. Стандартизацию проводят в нескольких параллелях: в колбу для титрования отбираем раствор K2Cr2O7, H2SO4 и 10% KI, закрываем стеклом и выдерживаем в темном месте 5 минут.
3. Далее титруем раствором тиосульфата натрия, добавляя крахмал после достижения светло-желтой окраски.

16.Цериметрическое титрование: сущность метода; особенности метода; примеры использования титрантаCe(SO4)2. Определение соли Мора.
Цериметрическое титрование – титриметрический метод анализа, в котором титрантом является соль Ce (+4), обычно Ce(SO4)2.
В процессе цериметрического титрования происходит восстановление Се(4) до Се(3):
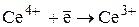 E0 = +1,74 В
E0 = +1,74 В
Гидратированные ионы церия, особенно Ce4+, обладают выраженными кислотными свойствами и образуют малорастворимые гидроксокомплексы, поэтому цериметрическое титрование проводится в сильнокислой среде.
· Стандартизацию сернокислого раствора проводят йодометрически
· ЦТ проводят в присутствии редокс-индикаторов (дифениламин, ферроин и др.)
· Возможность проведения титрования, в присутствии хлорид-ионов.
· ЦТ непригодно для титрования нейтральных и щелочных растворов.
В цериметрическом титровании обычно используют серную кислоту. Растворы Ce4+ в HNO3 и HClO4 при хранении менее устойчивы, потому что Ce4+ в таких растворах является более сильным окислителем и может окислять воду. Растворы церия Ce4+ в HCl также недостаточно устойчивы вследствие возможного окисления хлорид-ионов.
Стандартный раствор Ce(SO4)2 готовят из Ce(SO4)2×4H2O или Ce(SO4)2×2(NH4)2SO4×2H2O путём растворения навески в 1 М серной кислоте. Стандартный раствор Ce(SO4)2 обычно является вторичным. Для его стандартизации используют Na2C2O4, соль Мора, заместительное иодометрическое титрование и т.д.
Обнаружение конечной точки цериметрического титрования может проводиться по собственной окраске титранта (гидратированный ион Ce4+ - жёлтый, а Ce3+ - бесцветный). Однако чаще для этой цели используют окислительно-восстановительные индикаторы - дифениламин, ферроин и др.
Прямое цериметрическое титрование используется для определения различных восстановителей: как неорганических (Fe2+, H2O2, SO32- и др.), так и органических.
В случае обратного цериметрического титрования вторым стандартным раствором обычно является раствор Fe2+. Известны методики цериметрического титрования, в которых проводится титрование заместителя. Таким образом определяют сильные восстановители, легко окисляющиеся кислородом воздуха. Цериметрическое титрование может быть использовано и для определения некоторых окислителей, например, персульфат-ионов. К исследуемому раствору вначале добавляют избыток стандартного раствора Fe2+, а затем титруют избыток Fe2+ стандартным раствором Ce(SO4)2.
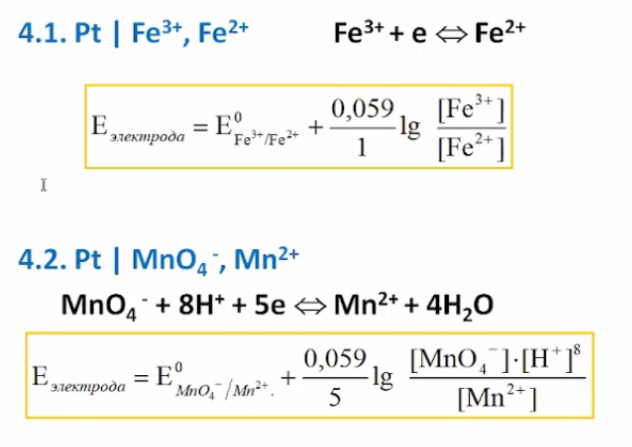
Каломельный электрод

3. Ион-селективные электроды (ИСЭ) – основаны на возникновении мембранного потенциала.
В нижней части электрода имеется полупроницаемая мембрана – проницаема только для ионов определенного вида.
Е электрода = f (aиона), например, H+, NO3-, F-, Ca2+
Стеклянный электрод

Назначение стеклянного электрода: индикаторный электрод для измерения рН.
Минусы: очень хрупкий, достаточно микротрещины на мембране, электрод не подлежит восстановлению.
4. Платиновый электрод (окислительно-восстановительный электрод) – погруженный в любую ОВ-систему.
Устройство рН – метра.
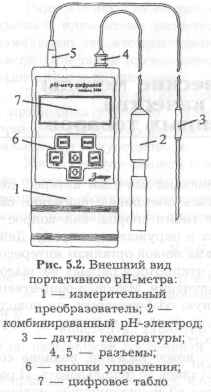
Принцип работы pH метра – потенциометрический, основанный на измерении электродвижущей силы, которая создается электрохимической частью устройства (электроды стеклянный и хлорсеребряный), погружаемые в раствор, pH которого необходимо измерить. В комплексе с подходящими электродами pH-метры могут определять окислительно-восстановительный потенциал.
pH-измерение кислотности или щелочности раствора в значениях от 0 до 14 (менее 7 – кислая среда, больше 7 – щелочная или основная, 7 – нейтральная).
Основные законы светопоглощения: закон Бугера и Ламберта, закон Бера, закон Бугера-Ламберта-Бера. Молярный коэффициент погашения. Удельный коэффициент погашения. Спектры поглощения водных растворов. Информация из спектра. Выбор длины волны для фотометрии.
Закон Бугера и Ламберта: Доля светового потока, поглощенного однородной средой, прямо пропорциональна толщине поглощающего слоя.
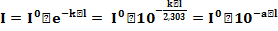

Закон Бера: Доля светового потока, поглощенного однородной средой, прямо пропорциональна концентрации растворенного вещества.

Закон Бугера-Ламберта-Бера: Доля светового потока, поглощенного однородной средой, прямо пропорциональна толщине поглощающего слоя и концентрации растворенного вещества.
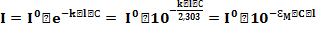
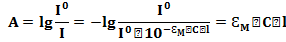



Физический смысл молярного коэффициента погашения (  )
)
· 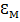 –это оптическая плотность 1М раствора в кювете толщиной 1см.
–это оптическая плотность 1М раствора в кювете толщиной 1см.
· 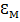 –зависит от природы вещества, температуры и длины волны.
–зависит от природы вещества, температуры и длины волны.
· Чем больше 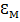 , тем более чувствительное определение можно сделать.
, тем более чувствительное определение можно сделать.

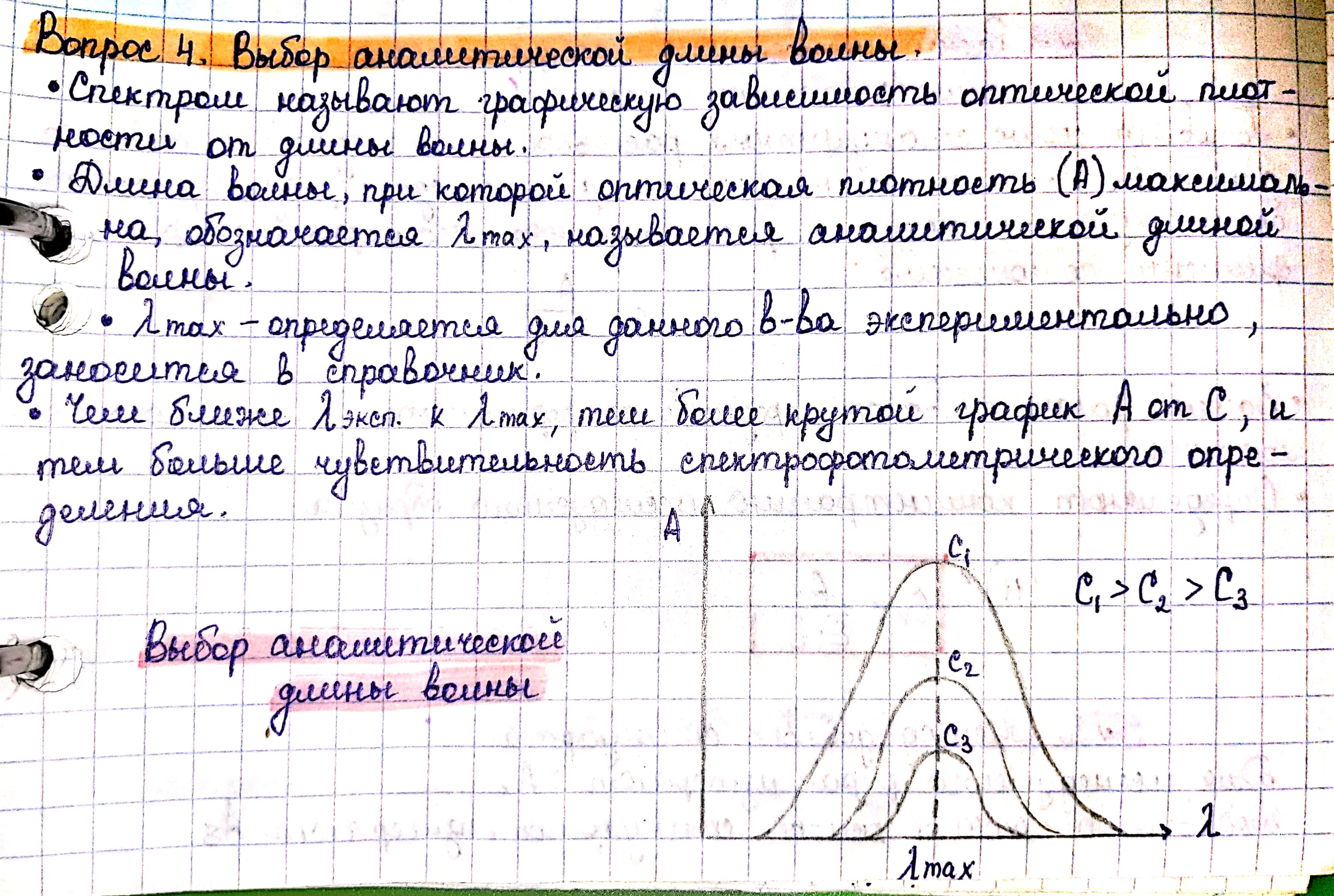
Спектральный анализ однокомпонентных систем: метод градуировочного графика, метод одного стандарта, метод добавок (графический и арифметический методы), расчет по величине молярного коэффициента погашения.
· В качестве раствора сравнения используют дистиллированную воду или холостую пробу.
· Измеряется оптическая плотность А.
· Спектрофотометрическое определение вещества можно провести 4-мя способами.
· Достоинства метода: точность определения; анализ разбавленных растворов.
По технике разделения:
А) колоночная
- стеклянную трубку с отверстием в нижней части заполняют адсорбентом (НФ)
- сверху помещают смесь веществ + растворитель (ПФ) или смесь газов + газ-носитель (ПФ)
- растворитель медленно стекает по колонке (газ-носитель несется по колонке), перенося с собой компоненты смеси
- компоненты перемещаются на разное состояние и могут быть разделены
- чем больше сродство вещество-адсорбент, тем меньше скорость движения вещества по колонке!
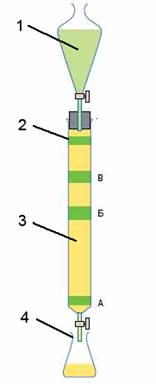 1. элюент
1. элюент
2. хроматографическая колонка и количество сорбента
3. сорбент
4. приемники фракций
Б) бумажная
- на ХР бумагу (твердый полярный адсорбент) на стартовую линию наносят каплю смеси или смесь + чистые компоненты (свидетели)
- край бумаги опускают в смесь 2-3 растворителей с разной полярностью
- неполярный растворитель не адсорбируется на бумаге и является подвижной фазой (ПФ): передвигается по бумаге быстро
- полярный растворитель адсорбируется на бумаге и является неподвижной фазой (НФ): передвигается по бумаге медленно
- компоненты смеси растворяются в разных растворителях, перемещаются на разное расстояние и могут быть разделены
Расшифровка хроматограммы

В) тонкослойная
- на стеклянную или алюминиевую пластинку наносят (приклеивают) тонкий слой твердого полярного сорбента (алюмаге



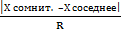
 = ½ (
= ½ (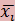 +
+ 
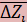 =
= 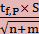

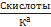 ≥ 400
≥ 400
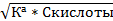 pH= ½*(pK1a-lgCкисл.)
pH= ½*(pK1a-lgCкисл.)
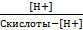 ; К ионизации основания =
; К ионизации основания = 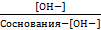
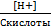 ≈
≈ 
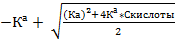 pH рассчитать по формуле 4
pH рассчитать по формуле 4
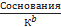 ≥ 400
≥ 400
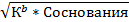 pОH= ½*(pK1b-lgCосн.)
pОH= ½*(pK1b-lgCосн.)
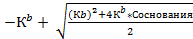 pOH рассчитать по формуле 5
pOH рассчитать по формуле 5

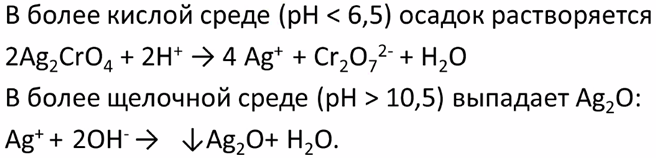






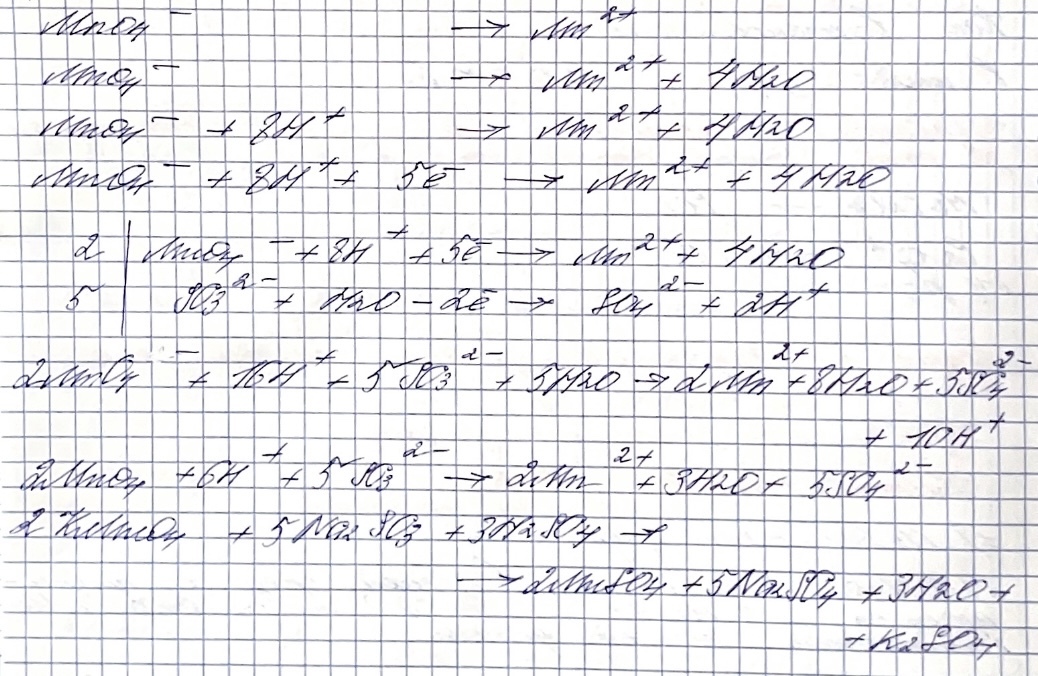


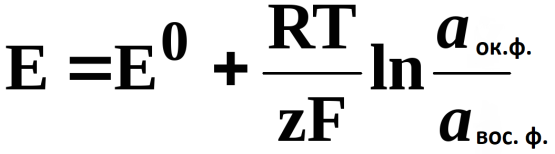














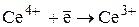 E0 = +1,74 В
E0 = +1,74 В



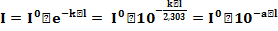


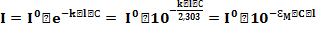
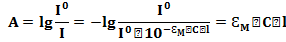



 )
)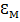 –это оптическая плотность 1М раствора в кювете толщиной 1см.
–это оптическая плотность 1М раствора в кювете толщиной 1см.

 1. элюент
1. элюент



