А) Светорассеяние
|
Образец
|
Регион
|
| R S 1
| RS 2
| RS 3
|
| %
| FSC
| SSC
| %
| FSC
| SSC
| %
| FSC
| SSC
|
| Образец № 1
|
|
|
|
|
|
|
|
|
|
| Образец № 2
|
|
|
|
|
|
|
|
|
|
| Образец № 3
|
|
|
|
|
|
|
|
|
|
Б) Флуоресценция
|
Образец
|
Дискриминационный фильтр
|
| Fl 1
| Fl 2
|
| %
| Интенсивность флуоресценции, условные единицы
| %
| Интенсивность флуоресценции, условные единицы
|
| Образец № 1
|
|
|
|
|
| Образец № 2
|
|
|
|
|
| Образец № 3
|
|
|
|
|
Примечания:
1) в таблице указывают частоту (в %) встречаемости клеток по каждому из образцов, принадлежащих тому или иному региону точечного графика;
2) значения FSC и SSC выражают в условных единицах интенсивности светорассеивания (как арифметическая средняя);
3) значения Fl 1 и Fl 3 выражают в условных единицах интенсивности флуоресценции (как арифметическая средняя).
4. ОЦЕНКА СВЯЗАННЫХ С АПОПТОЗОМ ИЗМЕНЕНИЙ КЛЕТОЧНОГО ЯДРА
Анализ морфологии клеточных ядер
Морфологические изменения ядер являются важными признаками, используемыми для обнаружения и изучения апоптотических клеток. Для морфологического анализа ядер апоптотических клеток проводят окрашивание живых или фиксированных клеток флуоресцентными
ДНК-тропными красителями, такими как AO, EB или PI с их последующим изучением под флуоресцентным микроскопом. Методология окрашивания и анализа аналогична таковой, описанной в подразделе 2.3.2 и, как правило, совмещается с оценкой избирательной проницаемости ПМ.
Выявление фрагментации ДНК
Характерной особенностью каспаз-зависимого процесса программируемой гибели клеток является фрагментация хроматина специфическими эндонуклеазами на фрагменты длиной до нескольких десятков килобаз с последующим межнуклеосомным разрезанием хромосомальной ДНК на мелкие фрагменты с длиной, кратной примерно 160-200 парам оснований. Для регистрации этого процесса используется несколько методических подходов.
4.2.1. Определение количественного содержания ДНК
в клетках
Предлагаемый метод основан на способности небольших молекул ДНК, образующихся в результате межнуклеосомной фрагментации, выходить из клеток после их предварительной обработки фиксаторами типа этанола, обеспечивающими пермеабилизацию клеточных мембран. После фиксации клетки выдерживают в высокосолевом буфере, в который и переходят высвободившиеся фрагменты молекул ДНК. При этом количество ДНК, оставшееся в ядрах апоптотических клеток, оказывается меньшим, чем диплоидное содержание ДНК, характерное для нормальных клеток того же типа. Далее клетки окрашивают ДНК-тропным красителем типа PI, при этом количество связавшегося красителя будет пропорционально количеству содержащейся в клетке ДНК. Анализ проводят на проточном цитофлуориметре, и пул апоптотических клеток регистрируют как гипо-диплоидный пик.
Методика
1) Осаждают 2 ´ 106 клеток каждого образца в цитоцентрифуге с ускорением 1 ´ 103 об./мин на протяжении 5 мин при температуре от +2оС до +8оС. Осадок клеток ресуспензируют в остатках жидкости, добавляют 2 мл холодного (около 0оС) 80% этанола и фиксируют на протяжении не менее 24 часов (но не более одной недели) при температуре –20оС.
2) Готовят 0,2 М раствор Na 2 HPO 4. Для этого 1,42 г безводной соли растворяют в 50 мл деионизированной воды. Раствор хранят при температуре от +2оС до +8оС.
3) Готовят 0,1 М раствор лимонной кислоты. Для этого 0,96 г безводной лимонной кислоты растворяют в 50 мл деионизированной воды. Раствор хранят при температуре от +2оС до +8оС.
4) Готовят буфер для экстракции низкомолекулярной ДНК, содержащий 192 частей 0,2 М Na 2 HPO 4 и 8 частей 0,1 М лимонной кислоты. Буфер не хранят, используют свежеприготовленный.
5) После фиксации клетки осаждают в цитоцентрифуге с ускорением 1 ´ 103 об./мин на протяжении 5 мин при температуре от +2оС до +8оС, этанол удаляют, к осадку клеток добавляют 50 мкл буфера для экстракции низкомолекулярной ДНК, тщательно встряхивают на вортексе и инкубируют при температуре +37ºС на протяжении 30 мин.
6) После экстракции клетки повторно встряхивают, осаждают в цитоцентрифуге с ускорением 1 ´ 103 об./мин на протяжении 10 мин при температуре от +2оС до +8оС, отбирают 40 мкл супернатанта, содержащего низкомолекулярную ДНК, в отдельную пробирку Эппендорф и оставляют ее на хранение при –20оС до проведения анализа методом агарозного гель-электрофореза.
7) Осадок клеток ресуспензируют в 1 мл фосфатного буфера, осаждают в цитоцентрифуге с ускорением 1 ´ 103 об./мин на протяжении
5 мин при температуре от +2оС до +8оС, супернатант удаляют. При необходимости, клетки могут быть переведены в 70%-ный этанол и храниться до проведения анализа при –20ºС.
8) Отмытые клетки ресуспензируют в 200 мкл фосфатного буфера, добавляют 2 мкл маточного раствора PI (конечная концентрация
50 мкг/мл), 2 мкл маточного раствора (10 мг/мл) РНКазы А (конечная концентрация 100 мкг/мл) и инкубируют на протяжении 30 мин при температуре от +15оС до +30оС.
9) Окрашенные клетки анализируют на проточном цитофлуориметре типа FACScan с 15-мВт 488-нм аргон-неоновым лазером и дискриминационным фильтром Fl 2. На одну пробу анализируют минимум 30000 клеток.
При сборе и анализе данных следуют общим правилам обработки данных проточной цитометрии, описанным в подразделе 2.2, учитывая специфику проводимого анализа (в частности, ключевой задачей в данном случае является определение пика клеток с нормальным и со сниженным содержанием ДНК, а также оценка процентной доли клеток в каждом пике). Характер распределения клеток по показателю флуоресценции представлен на рис. 7.
Количественные результаты анализа оформляют в виде таблицы (табл. 7). Поскольку данный метод позволяет определить не только гипо-диплоидные клетки, но и оценить характер распределения остальных клеток по фазам клеточного цикла, то в таблице предлагается указать частотное распределение клеток по G 0/ G 1, S и G 2/ M фазам.
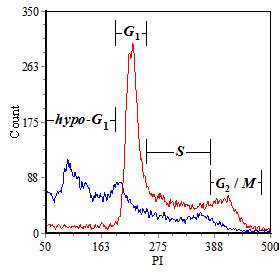
Рис. 7. Частотные гистограммы распределение анализируемых образцов
контрольных (красная кривая) и экспериментальных (синяя кривая) клеток, окрашенных PI, по содержанию ДНК.
Таблица 7






