2.1. Оценка ассоциированных с апоптозом
морфологических изменений ПМ и других структур клетки с помощью световой и фазово-контрастной микроскопии
Целый ряд морфологических изменений, которые претерпевают клетки в момент разворачивания программы апоптоза, может быть выявлен с помощью световой, фазово-контрастной или электронной микроскопии. Так, с помощью световой и фазово-контрастной микроскопии можно наблюдать такие явления, как округление и сжатие клеток (рис. 1, стрелка 1), сморщивание их поверхности (там же, стрелка 2), пузырение ПМ (там же, стрелка 3), морфологические изменения ядра клетки
(там же, стрелка 4).

Рис. 1. Морфологические особенности апоптотических клеток, выявляемые с помощью световой микроскопии.
Фотография воспроизведена с Web -сайта http:// www. cyto. purdue. edu / flowcyt / research / cytotech / apopto / data / malorni / malorni. htm
Электронная микроскопия позволяет установить более тонкие ультраструктурные изменения, происходящие с клеткой во время апоптоза. В первую очередь к ним относятся изменения ПМ и поверхностных структур клетки. Вначале происходит утрата микроворсинок и десмосом, затем появляются выпячивания и пузыри на мембране. При этом сама ПМ и мембраны органоидов остаются интактными вплоть до фагоцитоза или вторичного некроза апоптотических телец. Митохондрии не набухают (как это происходит при некрозе), рибосомы концентрируются в кристаллоидные структуры, под мембраной появляются параллельные пучки филаментов. В ядре обнаруживаются транскрипционные комплексы, поступающие из ядрышек и формирующие осмиофильные тельца. Поры сохраняются лишь в тех участках оболочки ядра, где отсутствует маргинация хроматина. Эндоплазматический ретикулум после кратковременной дилятации образует контакты с ПМ (считается, что они имеют значение для последующего фагоцитоза апоптотических тел), далее его канальцы формируют кластеры и фрагментируются.
В целом, электронная микроскопия считается более надежным способом выявления апоптоза по сравнению со световой или фазово-контрастной микроскопией, однако, с одной стороны, этот метод требует дорогостоящего оборудования и определенных практических навыков работы, а, с другой стороны, и в том и в другом случае идентифицируемые изменения не являются однозначными признаками апоптоза, поскольку такая морфология может являться обычной для некоторых типов интактных клеток.
2.2. Оценка ассиметричности распределения
фосфатидилсеринов в ПМ с помощью Annexin V
Высокоспецифичным и чувствительным методом детекции апоптоза является метод, основанный на обработке клеток белком Annexin V, меченным флуоресцеин изотиоцианатом (FITC) – флуорохромом с максимум возбуждения 495 нм и максимумом эмиссии 519 нм. Annexin V – это белок (35 кДа), специфически связывающий фосфолипиды, в частности, при физиологической концентрации кальция он обладает высоким сродством к фосфатидилсерину. В норме фосфатидилсерины локализуются на внутренней стороне ПМ, при инициации же апоптоза они утрачивают асимметричность распределения в липидном бислое и перемещаются на внешнюю сторону мембраны (в условиях in vivo это служит сигналом для фагоцитоза таких клеток). Экспонированные на поверхности ПМ фосфатидилсерины и могут быть обнаружены с помощью флуоресцентно-меченного Annexin V.
Поскольку при некрозе происходит нарушение целостности мембраны, что может послужить причиной попадания меченного Annexin V внутрь клетки, то при проведении такого рода анализа используют дополнительно окрашивание клеток красителем иодидом пропидия (PI). Принимая во внимание, что PI проникает только в клетки с нарушенной проницаемостью ПМ, при двойном окрашивании Annexin V и PI можно различить три пула клеток: Annexin V–/ PI – (живые), Annexin V+/ PI – (раннеапоптотические) и Annexin V+/ PI + (некротические и позднеапоптотические). Все три популяции клеток могут быть идентифицированы как с помощью визуального наблюдения под флуоресцентным микроскопом, так и методом проточной цитофлуориметрии.
Методика:
1) Готовят 1Х фосфатный буфер. Для этого в 800 мл деионизированной воды растворяют 8 г NaCl (конечная концентрация
0,14 М), 2,88 г Na 2 HPO 4 ´ 12 H 2 O (конечная концентрация 8 мМ), 0,2 г KH 2 PO 4 (конечная концентрация 1 мМ) и 0,2 г KCl (конечная концентрация 3 мМ), доводят рН раствора до 7,4 с помощью HCl, после чего его объём доливают до конечного объема 1 литр деионизированной водой. Готовый буфер стерилизуют в автоклаве при давлении 1,05 кг/см2 на протяжении
20 мин или путем фильтрации через фильтр с диаметром пор 0,22 мкм. Буфер хранят при температуре от +15оС до +30оС (комнатная температура).
2) Готовят 10Х Annexin V-связывающий буфер. Для этого в 40 мл деионизированной воды растворяют 4,09 г NaCl (конечная концентрация 1,4 М), 0,14 г CaCl 2 (конечная концентрация 25 мМ), добавляют 5 мл 1 M HEPES (конечная концентрация 0,1 М), pH которого скорректирован до 7,4 с помощью NaOH, после чего объем раствора доводят до 50 мл деионизированной водой и стерилизуют путем фильтрации через фильтр с диаметром пор 0,22 мкм. Готовый раствор может храниться при температуре от +2оС до +8оС.
3) Готовят 1Х Annexin V-буфер для хранения. Для этого в 40 мл деионизированной воды растворяют 0,3 г основания Tris
(Tris -(гидроксиметил)-аминометан) (конечная концентрация 50 мМ),
0,29 г NaCl (конечная концентрация 100 мМ), 0,5 г бычьего сывороточного альбумина (конечная концентрация 1%) и 0,01 г азида натрия (конечная концентрация 0,02%), корректируют pH раствора до 7,4 с помощью HCl, после чего его объем раствора до 50 мл деионизированной водой и стерилизуют путем фильтрации через фильтр с диаметром пор 0,22 мкм. Готовый раствор может храниться при температуре от +2оС до +8оС.
4) Готовят маточный раствор Annexin V (кальфосбиндин I, липокортин V или PAP -1) с концентрацией 1 мг/мл. Для этого 1 мг лиофилизированного белка растворяют в 1 мл Annexin V-буфера для хранения. Готовый раствор хранят при температуре от +2оС до +8оС.
5) Готовят маточный раствор PI с концентрацией 5 мг/мл. Для этого навеску флуорохрома в 5 мг растворяют в 1 мл 1Х фосфатного буфера, готовый раствор хранят, разделив на небольшие порции, при температуре от +2оС до +8оС в темной бутылке или сосуде, завернутом в алюминиевую фольгу.
6) Осаждают 2-5 ´ 105 клеток каждого образца в цитоцентрифуге с ускорением 1 ´ 103 об./мин на протяжении 5 мин при температуре от +2оС до +8оС. Осадок клеток ресуспензируют в 500 мкл холодного (от +2оС до +8оС) фосфатного буфера и повторно осаждают в цитоцентрифуге, надосадочную жидкость сливают.
7) Отмытые клетки ресуспензируют в 100 мкл окрашивающего раствора, приготовленного непосредственно перед использованием по следующей прописи:
10Х Annexin V-связывающий буфер – 10 мкл;
маточный раствор PI – 10 мкл;
маточный раствор Annexin V – 1 мкл;
деионизированная вода – 79 мкл.
Окрашивающий раствор может непродолжительное время храниться на льду в темноте.
8) Для полного окрашивания клетки инкубируют 15 мин в темноте при температуре от +15оС до +30оС, после чего в каждую пробу добавляют по 400 мкл 1Х Annexin V-связывающего буфера (для получения 1Х Annexin V-связывающего буфера его 10-кратный концентрат разводят в 10 раз деионизированной водой).
9) Не позднее 1 часа после завершения окрашивания клеток последние анализируют под флуоресцентным микроскопом (рис. 2) или с помощью проточного цитофлуориметра типа FACScan, оснащенного
15-мВт 488-нм аргон-неоновым лазером и двумя дискриминационными фильтрами – 515-545 нм (фильтр Fl 1 для FITC -меченного Annexin V) и 564-606 нм (фильтр Fl 2 для PI).
10) В том случае, когда используется проточный цитофлуориметр, на одну пробу анализируют минимум 30000 клеток. Сбор данных проводят с помощью программы CellQuest (или ее эквивалента, инсталированного на приборе). Анализ полученных данных может быть осуществлен с помощью любой программы, подходящей для обработки файлов с расширением *. fcs (например, программы FCS Express Version 3, которая доступна для скачивания с официального Web -сайта компании DeNovo Software: http://www.denovosoftware.com/site/Product2.shtml).
При сборе и анализе данных следуют определенным правилам обработки данных проточной цитометрии. Обязательным этапом проведения такого рода анализа является разделение живых и мертвых клеток по показателям прямого (FSC) (рассеивание света под углом 1°-10°) и бокового светорассеяния (SSC) (рассеивание света под углом 90°), которые отражают, соответственно, различия в размере и гранулярности (неоднородности цитоплазмы) клеток. При этом следует учитывать, что некротические и позднеапоптотические клетки имеют сниженные значения по обоим параметрам по сравнению с живыми клетками из-за разрушения целостности клеток и внутриклеточных структур. В то же время раннеапоптотические клетки часто имеют несколько повышенное значение бокового светорассеяния по сравнению со средним значением этого параметра для живых клеток.
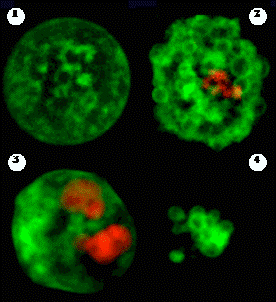
Рис. 2. Морфология клеток, окрашенных Annexin V и PI.
На микрофотографии, полученной с помощью флуоресцентного микроскопа, видны морфологические различия между раннеапоптотическими клетками (1), клетками с пузырящейся мембраной (2), позднеапоптотическими клетками со вторичным некрозом (3) и апоптотическими телами (4). Области клеток, которые связывают
FITC -меченный Annexin V, имеют зеленую окраску, а PI – красную. Фотография воспроизведена с официального Web -сайта компании Assay Designs Inc. (http://www.assaydesigns.com)
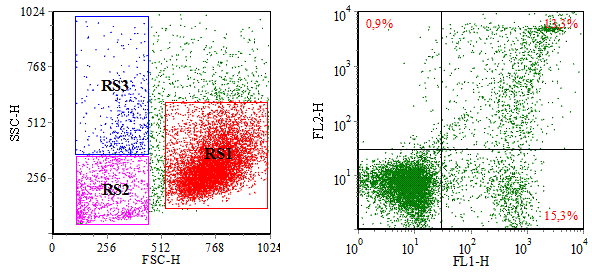
11) Анализ начинают с образца № 1, содержащего преимущественно живые неповрежденные клетки. На точечном графике с осями координат FSC / SSC определяют область распределения основной популяции клеток (регион R S 1). Эта область и будет соответствовать живым клеткам
(рис. 3А). Аналогичным образом обрабатывают точечный график с образца № 2 (где индуцирован некроз клеток). На этом графике должна появиться дополнительная (по сравнению с контрольными клетками) популяция клеток с более низкими показателями FSC и SSC, область распределения которой (регион RS 2) будет соответствовать некротическим клеткам (рис. 3А).
 А Б
А Б
Рис. 3. Распределение анализируемых образцов клеток, окрашенных Annexin V и PI, по показателям прямого и бокового светорассеивания (А) и флуоресценции (Б).
В части Б) рисунка показана общая популяция клеток, без деления на регионы по светорассеиванию; Annexin V–/ PI – клетки располагаются в нижнем левом квадранте, Annexin V+/ PI – – в нижнем правом квадранте, Annexin V+/ PI + – в верхнем правом квадранте, а Annexin V–/ PI + – в верхнем левом квадранте; частоты встречаемости клеток с тем или иным показателем флуоресценции указаны в соответствующих квадрантах. Данные воспроизведены из книги «Методы проточной цитометрии в медицинских и биологических исследованиях / Под ред. М. П. Потапнева. – Минск.: ГУ РНМБ, 2003»
12) Аналогичным образом обрабатывают точечный график с образца № 2 (где индуцирован некроз клеток). На этом графике должна появиться дополнительная (по сравнению с контрольными клетками) популяция клеток с более низкими показателями FSC и SSC, область распределения которой (регион RS 2) будет соответствовать некротическим клеткам (рис. 3А).
13) На точечном графике с осями координат FSC / SSC образца № 3 идентифицируют третью популяцию клеток (регион RS 3) со значениями FSC и SSC, отличающимися от таковых в RS 1 и RS 2 (рис. 3А).
14) В дальнейшем аналогичным образом проводят последовательный анализ распределения клеток по флуоресценции на точечном графике с осями Fl 1 (зеленая флуоресценция красителя Annexin V) и F l 2 (красная флуоресценция красителя PI). Регионы, соответствующие живым, некротическим и апоптотическим клеткам обозначают как RF 1, RF 2 и RF 3, соответственно (рис. 3Б).
15) По каждому из выделенных регионов, используя соответствующие инструменты программы, получают численные показатели частоты встречаемости клеток и средних значений интенсивности светорассеивания (как прямого, так и бокового) и флуоресценции. Результаты анализа оформляют в виде таблиц (табл. 2)
Таблица 2
Количественный анализ клеток, окрашенных Annexin V и PI, с помощью проточной цитофлуориметрии
А) Светорассеяние
|
Образец
|
Регион
|
| R S 1
| RS 2
| RS 3
|
| %
| FSC
| SSC
| %
| FSC
| SSC
| %
| FSC
| SSC
|
| Образец № 1
|
|
|
|
|
|
|
|
|
|
| Образец № 2
|
|
|
|
|
|
|
|
|
|
| Образец № 3
|
|
|
|
|
|
|
|
|
|
Б) Флуоресценция
|
Образец
|
Регион
|
| RF 1
| RF 2
| RF 3
|
| %
| F l 1
| Fl 2
| %
| F l 1
| Fl 2
| %
| F l 1
| Fl 2
|
| Образец № 1
|
|
|
|
|
|
|
|
|
|
| Образец № 2
|
|
|
|
|
|
|
|
|
|
| Образец № 3
|
|
|
|
|
|
|
|
|
|
Примечания:
1) в таблице указывают частоту (в %) встречаемости клеток по каждому из образцов, принадлежащих тому или иному региону точечного графика;
2) значения FSC и SSC выражают в условных единицах интенсивности светорассеивания (как арифметическая средняя);
3) значения Fl 1 и Fl 2 выражают в условных единицах интенсивности флуоресценции (как арифметическая средняя).





 А Б
А Б


