Р е ц е н з е н т
кандидат биологических наук, доцент А. В. Сидоров
| К63
| Комплексный подход при оценке программируемой гибели (апоптоза) клеток человека: метод. пособие к лабораторным занятиям по специальному курсу «Патология клетки» для студентов биол. фак. / авт.-сост.: С. В. Глушен, Т. В. Романовская, В. В. Гринев. – Минск: БГУ, 2009. – 43 с.
|
Методическое пособие содержит подробное описание комплекса клеточных и молекулярно-биологических методов анализа состояния плазматической мембраны, митохондрий и ядра апоптотических клеток. Применение описанных методов в лабораторной практике позволяет провести точную диагностику интактных, апоптотических и некротических клеток человека (нормальных или трансформированных, длительно поддерживаемых в культуре или свежевыделенных).
Предназначено для студентов, обучающихся по специальности 1-31 01 01 «Биология», специализации 1-31 01 01 07 «Генетика». Может быть полезным магистрантам, аспирантам и специалистам-биологам, решающим задачи диагностики и изучения программируемый клеточной гибели.
УДК 576.367.085(076)
ББК 28.05в.я73
 © БГУ, 2009
© БГУ, 2009
ВВЕДЕНИЕ
Термин «апоптоз» был впервые предложен Керром с соавторами для обозначения особой формы гибели клеток, которая, в отличие от некроза, носит физиологический характер. Греческое слово «apoptosis» можно перевести как «опадание», что ассоциируется с листопадом.
Апоптоз – это процесс запрограммированной физиологической гибели клеток, характерный для эукариот, и играющий особенно важную роль в поддержании клеточного гомеостаза у многоклеточных организмов. Он не только определяет количество клеток в тех или иных органах и тканях, но и контролирует их качественный состав, элиминируя из организма аберрантные клетки.
Аберрантный апоптоз наблюдается при вирусных инфекциях, воздействии ионизирующей радиации и цитотоксических веществ. Особенно большое значение придают изучению взаимосвязи апоптоза с опухолевым ростом. Эта форма гибели клеток находится под строгим генетическим контролем и регулируется специфическими молекулярными продуктами, что облегчает ее фармакологическую модуляцию и создает перспективы лечения заболеваний, в патогенезе которых она принимает участие.
Проблема апоптоза стала в настоящее время одной из самых актуальных в биологии и медицине. В связи с этим цель настоящей работы заключалась в том, чтобы ввести студентов-биологов в существо проблемы, ознакомить их с последними достижениями в этой области, особо заострив внимание на клеточных и молекулярно-биологических методах анализа состояния плазматической мембраны, митохондрий и ядра апоптотических клеток как ключевых мишеней воздействия разворачивающейся внутри клетки программы самоубийства. Авторы надеются, что предлагаемое методическое пособие будет полезным не только студентам биологического профиля, но также магистрантам и аспирантам, решающим задачи диагностики и изучения программируемый гибели клеток человека.
C ПИСОК СОКРАЩЕНИЙ
ПМ – плазматическая мембрана, плазмалемма;
ОП – оптическая плотность;
7- AAD – 7-аминоактиномицин D (от англ. 7- actinomycin D);
AO – акридиновый оранжевый (от англ. acridine orange);
CAD – каспаз-активируемая ДНКаза (от англ. caspase - activated
DNase);
EB – бромид этидия (от англ. ethidium bromide);
FITC – флуоресцеин изотиоцианат (от англ. fluorescein
isothiocyanate);
МТТ – 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2 Н -тетразолиум
бромид (от англ. 3-[4,5- dimethylthiazol -2- yl ]-2,5- diphenyl -2 H - tetrazolium bromide);
PI – иодид пропидия (от англ. propidium iodide);
TNF -a – фактор некроза опухолей-a (от англ. tumour necrosis factor -a).
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
ИСТОРИЯ ПРОБЛЕМЫ
Морфологические исследования гибели клеток проводились в начале XX века неоднократно. При этом были описаны типичные картины апоптоза. Однако еще со времен Р. Вирхова любую гибель клеток было принято обозначать термином «некроз» (т. е. отмирание) и наблюдаемые различия рассматривались как варианты одного и того же процесса.
Концепция некроза как единой формы гибели клеток еще более укрепилась благодаря открытию лизосом К. де Дювом в 1955 г. Он установил, что в интактных лизосомах гидролитические ферменты неактивны, поскольку они блокированы углеводами мембраны и матрикса. При повреждении лизосомальной мембраны гидролазы активируются и начинают расщеплять любые клеточные макромолекулы, что приводит к деградации органелл и разрушению клетки. Ключевым событием некроза является повреждение клеточных мембран при воздействии внешних физических, химических или биологических факторов
Гипотеза о существовании у эукариот генетически запрограммированной гибели клеток, которая, в отличие от некроза, представляет собой нормальный, физиологический процесс, высказывалась неоднократно. Решающие данные в ее пользу были получены Керром с сотр. в 1972 г. Было установлено, что при длительном нарушении кровоснабжения в печени крыс, атрофия ткани обеспечивается гибелью клеток, которая по времени наступления, морфологии и отсутствию воспаления отличается от некроза. Лизосомы при этом остаются интактными, о чем свидетельствует дискретное распределение кислой фосфатазы в цитоплазме погибающих гепатоцитов. Физиологическим результатом гибели клеток было приведение массы органа в соответствие с уровнем его кровоснабжения. В связи с этим авторы дали открытому ими типу клеточной гибели название «апоптоз» (опадание), подчеркивая тем самым ее физиологический характер.
В 1980 г. Вилли обнаружил, что апоптоз тимоцитов, вызванный глюкокортикоидами, сопровождается расщеплением ДНК на фрагменты длиной около 180 пар оснований. На заключительных стадиях некроза ДНК также может разрушаться, но при этом образуются фрагменты случайной длины. С этого времени ступенчатый в случае апоптоза или диффузный в случае некроза электрофоретический спектр ДНК стал рассматриваться как один из основных критериев идентификации различных форм клеточной гибели.
Гены, контролирующие апоптоз, были первоначально идентифицированы у нематоды Caenorhabditis elegans. В начале 90-х годов два гомологичных им гена были обнаружены у млекопитающих. Один из них, ice (интерлейкин-1-конвертирующий энзим), инициирует апоптоз, кодируя участвующую в нем цистеиновую протеазу. Другой гомолог, bcl -2, представляет собой онкоген из В-клеточной лимфомы, который подавляет эффект ice.
Наличие связи апоптоза с неопластической трансформацией выдвинуло проблему генетически контролируемой клеточной гибели в ряд наиболее актуальных в современной биологии. Более того, мутации и нарушения экспрессии генов, контролирующих апоптоз, участвуют в патогенезе не только опухолей, но иммунодефицитов, вирусных инфекций и нейродегенеративных заболеваний.
В последние годы особый интерес вызывают молекулярные сигналы, запускающие апоптоз, и модулирующие чувствительность к ним сенсоры. Изучение механизмов регуляции апоптоза сопровождается поиском новых фармакологических препаратов для онкологии, клинической иммунологии, эндокринологии, гематологии и других областей медицины.
МОРФОФИЗИОЛОГИЯ
Морфология апоптоза обладает видо- и тканеспецифичностью, а также зависит от методов приготовления и анализа препаратов. Тем не менее, гибель клеток путем апоптоза в различных клеточных популяциях имеет сходные морфологические проявления, которые разворачиваются по единому сценарию.
В начале процесса клетка утрачивает микроворсинки и контакты с соседними клетками, округляется и отделяется от клеточного пласта. Одновременно в ядре наблюдается перераспределение хроматина – гетерохроматин смещается к периферии, тогда как центральные эухроматиновые области приобретают однородный характер. Затем в ядре появляются выпячивания нуклеолеммы («протуберанцы»), которые заполняются гетерохроматином. В результате гетерохроматин формирует по периметру ядра скопления с четко очерченными границами. Эухроматиновые области ядра при этом просветляются, становясь оптически пустыми.
Маргинация гетерохроматина и образование кольца из отдельных глыбок по периферии ядра давно известна цитологам под названием «кариорексис». Ядра клеток при апоптозе могут также сжиматься, что обозначается в цитологии термином «пикноз».
Параллельно изменениям ядра при апоптозе наблюдается конденсация цитоплазмы. При этом длительное время сохраняется целостность большинства цитоплазматических органелл, в том числе лизосом и митохондрий.
На более поздних этапах плазматическая мембрана (ПМ) начинает формировать глубокие инвагинации, которые приводят к распаду клетки на гроздь апоптозных телец. В некоторых из них могут содержаться остатки клеточного ядра, состоящие из фрагментов нуклеолеммы и скоплений гетерохроматина. В дальнейшем апоптозные тельца фагоцитируются макрофагами. Иногда апоптозные тельца не фагоцитируются, а слущиваются в полости, кровеносное русло или почечные канальцы. Длительность апоптоза обычно варьирует в пределах от 1 до 12 часов.
В некоторых клеточных системах отдельные морфологические проявления апоптоза могут быть выражены слабо или полностью отсутствовать. Например, у тимоцитов маргинация хроматина приводит к формированию одного скопления в форме полумесяца. Деградация ДНК в кардиомиоцитах происходит без маргинации и конденсации хроматина. Распад клетки на апоптозные тельца также наблюдается не всегда. Несмотря на это по комплексу морфофизиологических свойств апоптоз значительно отличается от некроза (табл. 1).
Таблица 1
Пусковые процессы
В пусковых процессах апоптоза участвуют:
· внеклеточные молекулярные сигналы – триггеры и их рецепторы;
· внутриклеточные модификаторы действия триггеров – сенсоры;
· внутриклеточные пути передачи сигнала.
3.1.1. Триггер-рецепторные комплексы
Наиболее изученным примером триггер-рецепторного комплекса, который обеспечивает запуск апоптоза во многих клеточных линиях, является пара молекул лиганд Fas -рецептор Fas (или CD 95).
Лиганд Fas экспрессируется главным образом на активированных
Т-лимфоцитах. Он имеет молекулярную массу 46 кД, но в мембране находится в виде ди- или тримера, причем его С -конец обращен во внеклеточное пространство. В отличие от лиганда, рецептор Fas экспрессируется на многих типах клеток. Его молекулярная масса составляет 36 кД. На цитоплазматической стороне рецептора имеется участок из 70 аминокислот, который критичен для передачи сигнала внутрь клетки и называется «домен смерти».
Другими примерами триггер-рецепторных комплексов могут служить фактор некроза опухолей-a (TNF -a) и его рецептор TNFR 1, фактор роста нервов и его рецептор NGFR, рецептор CD 45 и его лиганд. Все они содержат «домен смерти» и участвуют в запуске апоптоза у различных типов клеток. Помимо этого, апоптоз индуцируется с помощью гормонов, а также моноклональных антител к поверхностным рецепторам для интерлейкина-2, g-интерферона и других физиологически активных молекул. Некоторые клетки подвергаются апоптозу при воздействии гидроксимочевины, ионизирующей радиации или ультрафиолетового света. У предшественников клеток крови, напротив, он запускается спонтанно при дефиците факторов роста.
В некоторых случаях эти эффекты связаны с воздействием на промежуточные компоненты комплекса Fas. Например, антитела против Fas, перекрестно сшивая молекулы рецептора, вызывают апоптоз без триггера (т. е. лиганда Fas). Для других индукторов участие триггер-рецепторных комплексов не столь очевидно. Например, специфический блокатор топоизомеразы II этопозид вызывает апоптоз, нарушая суперспирализацию ДНК и ее взаимодействие с ламинами. При этом образуются только крупные фрагменты ДНК величиной более 50 килобаз.
Сенсоры
Сенсорами в молекулярном механизме апоптоза называют внутриклеточные молекулы, которые модифицируют действие триггеров в зависимости от состояния клетки. Самым известным из сенсоров является белок р 53, подавляющий развитие опухолей. Он обладает способностью узнавать специфические последовательности ДНК и регулировать транскрипцию ряда генов, участвующих в пролиферации и апоптозе. Содержание р 53 в клетке увеличивается при облучении ее ионизирующей радиацией или обработке веществами, повреждающими ДНК. Повышение уровня р 53, в свою очередь, вызывает задержку клетки в G 1-фазе клеточного цикла, усиление репарации ДНК и снижение порога чувствительности к триггерам апоптоза. Белок р 53 образно называют «хранителем генома», так как он не только сигнализирует о повреждениях ДНК, но и участвует в их репарации. Если исправить ДНК не удается и повышенный уровень р 53 сохраняется при переходе клетки в S -фазе, вместо репликации ДНК запускается программа самоуничтожения генетически дефектной клетки.
На роль сенсора претендуют и другие регуляторы клеточного цикла, в том числе продукт протоонкогена c - myc, высокий уровень которого в контрольной точке G 1/ S при дефиците факторов роста индуцирует апоптоз.
Передача сигнала в клетке
Триггер-рецепторные комплексы Fas и TNF -a способны активировать сфингомиелиназу, которая расщепляет содержащийся в ПМ сфингомиелин на фосфохолин и церамид. В частности, при обработке клеток TNF -a или антителами к Fas, увеличение концентрации церамида регистрировалось к концу первой минуты после начала опыта. Установлено также, что синтетические церамиды индуцируют апоптоз различных типов клеток. Таким образом, церамид может играть роль вторичного посредника для апоптоза, запуская каскад катаболических реакций внутри клетки.
С другой стороны, при индукции апоптоза гормонами и антигенами могут быть, вероятно, использованы уже известные пути передачи сигнала. Например, при апоптозе, запускаемом глюкокортикоидами, участвует система аденилатциклаза-цАМФ, а гибель лимфоцитов может быть вызвана связыванием антигена с комплексом Т-клеточный рецептор- CD 3, при котором активируются протеинкиназы и повышается концентрация ионов кальция.
Таким образом, в отношении путей внутриклеточной передачи сигналов при апоптозе существуют две точки зрения. Согласно первой апоптоз имеет собственный путь передачи с церамидом в качестве вторичного посредника. Противоположная точка зрения состоит в том, что при апоптозе задействованы пути передачи сигналов, регулирующие пролиферацию и дифференцировку. Возможно также, что эти варианты не являются альтернативными, поскольку используются клетками с различной специализацией.
Эффекторные процессы
Эффекторные процессы апоптоза обеспечивают фрагментацию ДНК в клеточном ядре и конденсацию цитоплазмы. При этом в большинстве случаев изменения в клеточном ядре опережают изменения в цитоплазме. Более того, морфологические признаки апоптоза можно наблюдать в клетках, ядра которых удалены при обработке цитохалазином. Таким образом, характерные для апоптоза изменения ядра и цитоплазмы обладают определенной автономностью.
Беспозвоночные
Доказательства участия специфических генов в апоптозе были впервые получены при исследовании нематоды Caenorhabditis elegans. Эмбриогенез этой нематоды жестко детерминирован и почти не имеет индивидуальных различий. Оплодотворенное яйцо развивается в личинку, состоящую из 550 клеток. Во время постэмбрионального развития число клеток возрастает до 1025 у самцов и до 961 у гермафродитных особей.
Развитие нематоды сопровождается гибелью 131 клетки. Генетический анализ мутантов позволил идентифицировать 14 генов, контролирующих гибель этих клеток. Гены программируемой клеточной гибели подразделяют на следующие функциональные группы:
· выбор гибели: активатор ces -1, ингибиторы ces -2 и egl -1;
· реализация гибели: активаторы ced -3 и ced -4, ингибитор ced -9;
· контроль фагоцитоза: семь других генов серии ced;
· деградация клетки: nuc -1.
Непосредственно в апоптозе клеток нематоды участвуют гены ced -3, ced -4, ced -9и nuc -1. Продуктом ced -3 является цистеиновая протеаза, а ced -4кодирует белок, связанный с N -концом продукта ced -9. Мутации генов ced -3 и ced -4 обеспечивают выживание клеток, запрограммированных на апоптоз. Ген ced -9 кодирует белок, который предотвращает гибель клеток со включенными генами ced -3 и ced -4. Развитие личинок, мутантных по ced -9, прекращается на ранних стадиях из-за массовой гибели клеток. Продукт гена nuc -1 представляет собой эндонуклеазу, которая расщепляет ДНК в мертвых клетках. Клетки, мутантные по nuc -1, погибают без расщепления ДНК.
Наиболее общей схемой последовательности событий при запуске программы апоптоза у нематоды является следующая цепочка взаимодействий: диссоциация комплекса ced -4/ ced -9, процессинг и активация ced -9, активация ced -3, перемещение ced -3 из цитоплазмы в ядро, активация nuc -1.
Позвоночные
У позвоночных животных (обычно исследуются клетки млекопитающих) описаны два семейства генов, гомологичных генам ced -9 и
ced -3 C. elegans. Гомологом ced -9 у млекопитающих является ген bcl -2, который был обнаружен при хромосомной перестройке в В-клеточной фолликулярной лимфоме. Трансфекция bcl -2 предотвращает апоптоз многих клеточных линий, в том числе и при активации через комплексы Fas и TNF -a. Продуктом bcl -2 является белок с молекулярной массой
26 кД, который называют «фактором выживания». Он встроен в мембраны митохондрий, плазматической сети и нуклеолеммы. Предполагается, что функция этого белка состоит в регуляции работы кальциевых насосов.
В последнее время у млекопитающих обнаружен еще ряд генов, гомологичных ced -9, которые объединены в семейство ced -9/ bcl -2. Их продуктами являются как промоторы апоптоза (Bax, Bak, Nbk / Bik 1, Bad, Bcl - xS), так и его ингибиторы (Bcl -2, Bcl - xL, Mcl -1, Bcl - w, ced -9 и другие). Члены семейства взаимодействуют между собой, формируя гомо- и гетеродимеры, причем баланс ингибиторов и промоторов определяет судьбу клетки.
Продукт гена ced -3, который участвует в апоптозе у C. elegans, гомологичен цистеиновой протеазе ICE млекопитающих. В клетках млекопитающих при апоптозе можно зарегистрировать увеличение активности еще целого ряда цистеиновых протеаз (NEDD -2/ Ich -1, ICErel -III, Mch -2, CPP 32 и др.), которые обладают структурным и функциональным сходством с ICE. В последнее время их объединяют под общим названием «каспазы» и рассматривают как основное звено сигнального пути Fas / TNF -a. Белок вируса осповакцины CrmA и белок бакуловируса p 35, которые способны связываться с этими ферментами и блокировать их, подавляют апоптоз в самых различных клеточных системах.
Таким образом, последовательность рецептор Fas / ICE / CPP 32/ CAD рассматривается в настоящее время как основной путь реализации генетической программы апоптоза у млекопитающих. Следует, однако, отметить, что при индукции апоптоза глюкокортикоидами, радиацией или ультрафиолетовым светом могут, по-видимому, использоваться и другие сигнальные пути.
А) Светорассеяние
|
Образец
|
Регион
|
| R S 1
| RS 2
| RS 3
|
| %
| FSC
| SSC
| %
| FSC
| SSC
| %
| FSC
| SSC
|
| Образец № 1
|
|
|
|
|
|
|
|
|
|
| Образец № 2
|
|
|
|
|
|
|
|
|
|
| Образец № 3
|
|
|
|
|
|
|
|
|
|
Б) Флуоресценция
|
Образец
|
Регион
|
| RF 1
| RF 2
| RF 3
|
| %
| F l 1
| Fl 2
| %
| F l 1
| Fl 2
| %
| F l 1
| Fl 2
|
| Образец № 1
|
|
|
|
|
|
|
|
|
|
| Образец № 2
|
|
|
|
|
|
|
|
|
|
| Образец № 3
|
|
|
|
|
|
|
|
|
|
Примечания:
1) в таблице указывают частоту (в %) встречаемости клеток по каждому из образцов, принадлежащих тому или иному региону точечного графика;
2) значения FSC и SSC выражают в условных единицах интенсивности светорассеивания (как арифметическая средняя);
3) значения Fl 1 и Fl 2 выражают в условных единицах интенсивности флуоресценции (как арифметическая средняя).
Методика
1) Готовят 0,2% (вес на объем) раствор трипанового синего на фосфатном буфере. Для этого взвешивают 0,2 г. сухого порошка красителя, 0,2 г. азида натрия (необходим как консервант, предохраняющий готовый раствор от бактериального прорастания во время хранения) и растворяют полученные навески в 100 мл фосфатного буфера. Готовый раствор красителя фильтруют через фильтр с диаметром пор 0,22 мкм и хранят до использования при +4оС.
2) К небольшому объему (10-20 мкл) суспензии исследуемого образца клеток добавляют равный объем раствора трипанового синего, смесь ресуспензируют и вносят в камеру Горяева.
3) Под световым микроскопом производят подсчет количества клеток в поле 25-и больших квадратов камеры Горяева. Подсчитывают общее количество клеток, а также количество окрашенных в синий цвет нежизнеспособных клеток (рис. 4).

Рис. 4. Морфология живых (стрелка 1), некротических (стрелка 2) и позднеапоптотических (стрелка 3) клеток после их окрашивания трипановым синим.
Пересчет количества клеток в камере Горяева в концентрацию клеток (Скл) в суспензии и расчет жизнеспособности (ЖСП) клеток производят по следующим формулам:
Скл, клеток/мл = количество клеток в 25-и квадратах × 5000 (1)
ЖСП, % = (Скл живых клеток)/(Скл всех клеток) × 100% (2)
Процент нежизнеспособных клеток (погибших путем некроза или находящихся на этапе позднего апоптоза) определяют как 100% – ЖСП.
Результаты проведенного анализа оформляют в виде таблицы (табл. 3).
Таблица 3
Методика
1) Готовят маточный раствор EB с концентрацией 20 мг/мл. Для этого 20 мг твердого вещества растворяют в 1 мл деионизированной воды. EB очень плохо растворим в воде, поэтому для ускорения процесса растворения сосуд помещают на магнитную мешалку. Готовый раствор EB хранят при температуре от +2оС до +8оС в темной бутылке или сосуде, завернутом в алюминиевую фольгу.
2) Готовят маточный раствор AO с концентрацией 20 мг/мл. Для этого 20 мг твердого вещества растворяют в 1 мл 1Х фосфатного буфера. Готовый раствор AO хранят при температуре от +2оС до +8оС в темной бутылке или сосуде, завернутом в алюминиевую фольгу.
3) Осаждают 0,5-1 ´ 105 клеток каждого образца в цитоцентрифуге с ускорением 1 ´ 103 об./мин на протяжении 5 мин при температуре от +2оС до +8оС. Осадок клеток ресуспензируют в 25 мкл фосфатного буфера, имеющего температуру от +15оС до +30оС.
4) Готовят смесь EB и AO с конечной концентрацией 15 мкг/мл и
5 мкг/мл, соответственно для первого и второго красителя. К полученной суспензии клеток добавляют 25 мкл свежеприготовленной смеси EB и AO. Сразу же после этого по 10 мкл окрашенной суспензии клеток помещают на заранее подготовленное чистое обезжиренное предметное стекло, накрывают покровным стеклом и незамедлительно (во избежание получения ложных результатов, связанных с гибелью клеток в приготовленных препаратах и избыточного проникновения красителей в клетки) анализируют под флуоресцентным микроскопом.
Установлено, что EB проникает только в клетки с нарушенной избирательной проницаемостью мембраны (некротические и позднеапоптотические клетки), придавая таким клеткам красно-коричневую флуоресценцию, а AO является витальным красителем, он проникает во все клетки и, связываясь с хроматином, придает клеточным ядрам зелёную флуоресценцию, интенсивность которой зависит от степени конденсации хроматина. Следовательно, основываясь на морфологии окрашенных выше описанным методом клеток, можно определить частоту встречаемости в анализируемом образце мертвых клеток, а также клеток с некротическим и апоптотическим фенотипом. При этом целесообразно следовать следующим критериям отнесения клетки к тому или иному типу:
· живые (интактные) клетки имеют чётко очерченное ядро относительно равномерной зелёной или желто-зеленой окраски (рис. 5, стрелка 1);
· некротические клетки имеют крупное ядро, окрашенное в равномерный бурый цвет (рис. 5, стрелка 2);
· апоптотические клетки имеют ядро среднего или уменьшенного размера, содержащее гранулы сконденсированного хроматина ярко-зелёного или желто-зелёного (ранний апоптоз) или красно-коричневого (поздняя стадия апоптоза) цвета.
Среди апоптотических клеток, в зависимости от характера распределения конденсированного хроматина в ядре, можно выделить три морфотипа:
· пикноз – хроматин сконденсирован в одну сравнительно крупную гранулу (рис. 5, стрелка 3);
· периферическая конденсация – хроматин сконденсирован в виде кольца по периферии ядра (рис. 5, стрелка 4);
· кариорексис – в ядре видны гроздья мелких гранул сконденсированного хроматина (рис. 5, стрелка 5).
Конечной задачей исследования является выявление морфологических особенностей интактных клеток (преимущественная популяция клеток в образце № 1), некротических клеток (образец № 2) и апоптотических клеток, ожидаемых в образце № 3. Помимо описания морфологических типов клеток следует произвести количественную оценку процентного содержания каждого морфотипа в каждом из образцов. Для достоверности такого анализа общее количество клеток, учитываемых в каждом из образцов должно быть не менее 300. Результаты проведенного анализа оформляют в виде таблицы (табл. 4).
Таблица 4
Качественный и количественный анализ клеток, окрашенных EB и AO
|
Клетки
|
Морфология
| Частота, %
|
| Образец № 1
| Образец № 2
| Образец № 3
|
| Живые
|
|
|
|
|
| Некротические
|
|
|
|
|
| Апоптотические
|
|
|
|
|
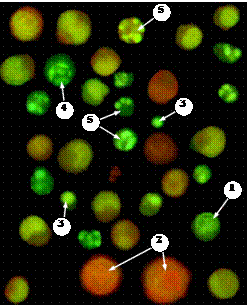
Рис. 5. Морфология интактных, апоптотических и некротических клеток после их окрашивания с EB и AO.
На микрофотографии, полученной с помощью флуоресцентного микроскопа ZEISS AXIO Imager. A 1 видны живые (стрелка 1) клетки, клетки с признаками некроза (стрелка 2), пикноза ядра (стрелка 3), периферической конденсации хроматина (стрелка 4) и кариорексиса (стрелка 5)
3. ОЦЕНКА СВЯЗАННЫХ С АПОПТОЗОМ ИЗМЕНЕНИЙ МИТОХОНДРИЙ
Методика
1) Готовят маточный раствор МТТ с концентрацией 5 мг/мл. Для этого 5 мг безводной соли МТТ растворяют в 1 мл фосфатного буфера. Свежеприготовленный раствор МТТ стерилизуют фильтрацией через фильтр с диаметром пор 0,22 мкм и хранят в темноте либо при температуре +4оС
(1-1,5 месяца), либо при –20оС (более длительный срок хранения).
2) Изучаемые клетки культивируют в 96-луночной плоскодонной культуральной планшетке в соответствии с дизайном эксперимента или диагностической процедуры. Все варианты ставят в трех повторностях, обязательным компонентом являются контрольные клетки, культивируемые в оптимальных условиях без каких-либо воздействий.
3) При анализе в каждую тестируемую лунку 96-луночной культуральной планшетки добавляют по 10-20 мкл раствора МТТ и инкубируют на протяжении 4-х часов в темноте при температуре +37оС во влажной атмосфере с 5% CO 2.
4) После завершения инкубационного периода из планшетки как можно более полно удаляют супернатант, в каждую тестируемую лунку добавляют по 200 мкл диметилсульфоксида, содержимое лунок тщательно пипетируют и инкубируют ещё 15 мин в темноте при температуре от +2оС до +8оС.
5) Показания оптической плотности (ОП) (в условных единицах) считывают на планшетном спектрофотометре типа Multiscan Ascent при λ = 492 нм.
6) Жизнеспособность клеток (как интегральный показатель, включающий и митохондриальную активность) рассчитывают по следующей формуле:
жизнеспособность, % = (ОПЭ / ОПК) × 100%, (3)
где ОПЭ обозначает оптическую плотность в экспериментальных пробах (клетки, подвергшиеся экспериментальному воздействию), а ОПК – в контрольных пробах (клетки, культивированные в оптимальных условиях без какого-либо воздействия).
Полученные результаты оформляют в виде таблицы (табл. 5).
Таблица 5
Оценка жизнеспособности клеток с помощью MTT -теста
| Образец
| ОП при l = 492 нм
| Жизнеспособность клеток, %
|
| Образец № 1
|
|
|
| Образец № 2
|
|
|
| Образец № 3
|
|
|
3.2. Оценка снижения потенциала
мембраны митохондрий
Существует ряд витальных флуоресцентных красителей катионного типа, таких как мероцианин 540, родамин 123 или 5,5’,6,6’-тетрахлоро-1,1’,3,3’-тетраэтилбензимидазолкарбоцианина иодид (JC -1), которые имеют повышенное сродство к митохондриям и накапливаются в межмембранном пространстве при наличии на внешней мембране митохондрий высокого отрицательного потенциала. При снижении этого потенциала при гибели клеток сродство красителей к митохондриям падает, что выражается в более слабом сигнале флуоресценции. Это явление используют для выявления апоптоза методами проточной цитофлуориметрии и флуоресцентной микроскопии. Следует отметить, что использование только лишь критерия снижения потенциала мембраны митохондрий не позволит осуществить разделение апоптотических и некротических клеток. Отчасти эта проблема может быть решена одновременным окрашиванием клеток флуоресцентным красителем на потенциал митохондриальной мембраны и PI, однако такой подход приемлем не для всех митохондриальных красителей (см. спектральные свойства, описанные ниже для такого красителя, как JC -1).
Методика
1) Осаждают 2-5 ´ 105 клеток каждого образца в цитоцентрифуге с ускорением 1 ´ 103 об./мин на протяжении 5 мин при температуре от +2оС до +8оС. Осадок клеток ресуспензируют в 200 мкл фосфатного буфера, имеющего температуру от +15оС до +30оС.
2) К клеточной суспензии добавляют краситель JC -1 до конечной концентрации 1 мкМ и клетки инкубируют в течение 15 мин в темноте при температуре от +15оС до +30оС. Краситель JC -1, в отличие от других катионных зондов (например, родамина 123), имеет некоторые преимущества, в частности, он обладает более высокой тропностью к митохондриальной мембране, чем к ПМ, и большей чувствительностью к изменению ее потенциала.
3) После окрашивания к клеткам добавляют фосфатный буфер до конечного объема 1 мл, клетки ресуспензируют, после чего осаждают в цитоцентрифуге с ускорением 1 ´ 103 об./мин на протяжении 5 мин при температуре от +2оС до +8оС.
4) Супернатант сливают, а осадок клеток ресуспензируют в 200 мкл фосфатного буфера, имеющего температуру от +15оС до +30оС и анализируют на проточном цитофлуориметре.
5) Аналитическую цитометрию проводят на проточном цитофлуориметре типа FACScan с 15-мВт 488-нм аргон-неоновым лазером и двумя дискриминационными фильтрами – 515-545 нм (фильтр Fl 1 для мономерной формы JC -1) и 564-606 нм (фильтр Fl 2 для агрегированной формы
J C -1). На одну пробу анализируют минимум 30000 клеток. При сборе и анализе данных следуют общим правилам обработки данных проточной цитометрии, описанным в подразделе 2.2. Характер распределения контрольных клеток по флуоресценции представлен на рис. 6А, а экспериментальных, подвергшихся проапоптотическому воздействию – на рис. 6Б. Количественные результаты анализа оформляют в виде таблиц (табл. 6).
А Б

Рис. 6. Распределение окрашенных JC -1 контрольных (А) и экспериментальных (Б) клеток по показателям флуоресценции.
Регион R 1 соответствует клеткам с нормальным потенциалом митохондриальной мембраны, а регион R 2 – со сниженным. Данные воспроизведены из книги «Методы проточной цитометрии в медицинских и биологических исследованиях / Под ред.
М. П. Потапнева. – Минск.: ГУ РНМБ, 2003»
При использовании JC -1 в качестве флуоресцентного зонда на потенциал митохондриальной мембраны следует учитывать, что после возбуждения 488-нм аргон-неоновым лазером мономерная форма JC -1 (в этой форме краситель существует при невысокой концентрации) флуоресцирует с l = 527 нм, увеличение же концентрации JC -1 выше некоторого значения приводит к образованию агрегатов красителя с эмиссией при
l = 590 нм. В момент деполяризации митохондриальной мембраны наблюдается уменьшение соотношения интенсивности флуоресцентного сигнала при 590 нм (Fl 2) к интенсивности флуоресценции при 527 нм (Fl 1).
Таблица 6
Количественный анализ клеток, окрашенных JC -1,
А) Светорассеяние
|
Образец
|
Регион
|
| R S 1
| RS 2
| RS 3
|
| %
| FSC
| SSC
| %
| FSC
| SSC
| %
| FSC
| SSC
|
| Образец № 1
|
|
|
|
|
|
|
|
|
|
| Образец № 2
|
|
|
|
|
|
|
|
|
|
| Образец № 3
|
|
|
|
|
|
|
|
|
|
Б) Флуоресценция
|
Образец
|
Дискриминационный фильтр
|
| Fl 1
| Fl 2
|
| %
| Интенсивность флуоресценции, условные единицы
| %
| Интенсивность флуоресценции, условные единицы
|
| Образец № 1
|
|
|
|
|
| Образец № 2
|
|
|
|
|
| Образец № 3
|
|
|
|
|
Примечания:
1) в таблице указывают частоту (в %) встречаемости клеток по каждому из образцов, принадлежащих тому или иному региону точечного графика;
2) значения FSC и SSC выражают в условных единиц



 © БГУ, 2009
© БГУ, 2009





