Как уже было отмечено, ПМ живых, апоптотических и некротических клеток имеет разную степень проницаемости для определенных типов красителей, в частности, для описанного выше нефлуоресцирующего красителя трипанового синего. С практической точки зрения более подходящим является окрашивание клеток витальными флуоресцентными красителями, что позволяет проводить параллельно как визуальное исследование клеток под флуоресцентным микроскопом, так и их исследование методом проточной цитофлуориметрии, позволяющей производить быстрый автоматизированный учет апоптотических клеток по параметрам светорассеяния и флуоресценции.
По проникающей способности среди флуоресцентных красителей можно выделить следующие группы:
1) ДНК-тропные красители с высокой молекулярной массой, такие как PI, бромид этидия (EB), 7-аминоактиномицин D (7- AAD), не проникающие в живые, но свободно проникающие в некротические клетки. Мембрана апоптотических клеток слабо проницаема для таких красителей (до наступления поздних стадий апоптоза).
2) ДНК-тропные красители с низкой молекулярной массой, такие как 4’,6-диамидино-2-фенилиндол (DAPI), Hoechst 33342 или
Hoechst 33258, с высокой эффективностью проникающие в апоптотические и некротические, и с меньшей эффективностью – в живые клетки. При этом следует учитывать, что для регистрации флуоресценции красителей DAPI или Hoechst необходим возбуждающий источник света с длиной волны около 350 нм, а также соответствующие эмиссионные фильтры, имеющиеся не во всех моделях проточных цитофлуориметров.
3) В особую группу можно выделить такие красители, как акридиновый оранжевый (AO), SYTO -16 и LDS -751, которые хорошо проникают через мембраны живых клеток, однако, в отличие от второй группы, дают инвертированную картину при разделении живых, апоптотических и некротических клеток, окрашивая живые клетки с наибольшей интенсивностью, а некротические и позднеапоптотические – с наименьшей. Механизм такого явления пока не выяснен. Преимуществом этой группы красителей является то, что для их использования не требуется дополнительный ультрафиолетовый лазер и для такого анализа подходит стандартный проточный цитофлуориметр типа FACScan с аргоновым лазером, испускающим свет с λ = 488 нм.
Методика
1) Готовят маточный раствор EB с концентрацией 20 мг/мл. Для этого 20 мг твердого вещества растворяют в 1 мл деионизированной воды. EB очень плохо растворим в воде, поэтому для ускорения процесса растворения сосуд помещают на магнитную мешалку. Готовый раствор EB хранят при температуре от +2оС до +8оС в темной бутылке или сосуде, завернутом в алюминиевую фольгу.
2) Готовят маточный раствор AO с концентрацией 20 мг/мл. Для этого 20 мг твердого вещества растворяют в 1 мл 1Х фосфатного буфера. Готовый раствор AO хранят при температуре от +2оС до +8оС в темной бутылке или сосуде, завернутом в алюминиевую фольгу.
3) Осаждают 0,5-1 ´ 105 клеток каждого образца в цитоцентрифуге с ускорением 1 ´ 103 об./мин на протяжении 5 мин при температуре от +2оС до +8оС. Осадок клеток ресуспензируют в 25 мкл фосфатного буфера, имеющего температуру от +15оС до +30оС.
4) Готовят смесь EB и AO с конечной концентрацией 15 мкг/мл и
5 мкг/мл, соответственно для первого и второго красителя. К полученной суспензии клеток добавляют 25 мкл свежеприготовленной смеси EB и AO. Сразу же после этого по 10 мкл окрашенной суспензии клеток помещают на заранее подготовленное чистое обезжиренное предметное стекло, накрывают покровным стеклом и незамедлительно (во избежание получения ложных результатов, связанных с гибелью клеток в приготовленных препаратах и избыточного проникновения красителей в клетки) анализируют под флуоресцентным микроскопом.
Установлено, что EB проникает только в клетки с нарушенной избирательной проницаемостью мембраны (некротические и позднеапоптотические клетки), придавая таким клеткам красно-коричневую флуоресценцию, а AO является витальным красителем, он проникает во все клетки и, связываясь с хроматином, придает клеточным ядрам зелёную флуоресценцию, интенсивность которой зависит от степени конденсации хроматина. Следовательно, основываясь на морфологии окрашенных выше описанным методом клеток, можно определить частоту встречаемости в анализируемом образце мертвых клеток, а также клеток с некротическим и апоптотическим фенотипом. При этом целесообразно следовать следующим критериям отнесения клетки к тому или иному типу:
· живые (интактные) клетки имеют чётко очерченное ядро относительно равномерной зелёной или желто-зеленой окраски (рис. 5, стрелка 1);
· некротические клетки имеют крупное ядро, окрашенное в равномерный бурый цвет (рис. 5, стрелка 2);
· апоптотические клетки имеют ядро среднего или уменьшенного размера, содержащее гранулы сконденсированного хроматина ярко-зелёного или желто-зелёного (ранний апоптоз) или красно-коричневого (поздняя стадия апоптоза) цвета.
Среди апоптотических клеток, в зависимости от характера распределения конденсированного хроматина в ядре, можно выделить три морфотипа:
· пикноз – хроматин сконденсирован в одну сравнительно крупную гранулу (рис. 5, стрелка 3);
· периферическая конденсация – хроматин сконденсирован в виде кольца по периферии ядра (рис. 5, стрелка 4);
· кариорексис – в ядре видны гроздья мелких гранул сконденсированного хроматина (рис. 5, стрелка 5).
Конечной задачей исследования является выявление морфологических особенностей интактных клеток (преимущественная популяция клеток в образце № 1), некротических клеток (образец № 2) и апоптотических клеток, ожидаемых в образце № 3. Помимо описания морфологических типов клеток следует произвести количественную оценку процентного содержания каждого морфотипа в каждом из образцов. Для достоверности такого анализа общее количество клеток, учитываемых в каждом из образцов должно быть не менее 300. Результаты проведенного анализа оформляют в виде таблицы (табл. 4).
Таблица 4
Качественный и количественный анализ клеток, окрашенных EB и AO
|
Клетки
|
Морфология
| Частота, %
|
| Образец № 1
| Образец № 2
| Образец № 3
|
| Живые
|
|
|
|
|
| Некротические
|
|
|
|
|
| Апоптотические
|
|
|
|
|
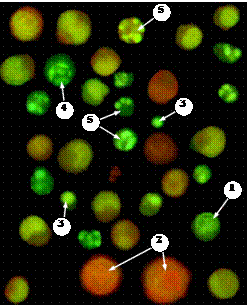
Рис. 5. Морфология интактных, апоптотических и некротических клеток после их окрашивания с EB и AO.
На микрофотографии, полученной с помощью флуоресцентного микроскопа ZEISS AXIO Imager. A 1 видны живые (стрелка 1) клетки, клетки с признаками некроза (стрелка 2), пикноза ядра (стрелка 3), периферической конденсации хроматина (стрелка 4) и кариорексиса (стрелка 5)
3. ОЦЕНКА СВЯЗАННЫХ С АПОПТОЗОМ ИЗМЕНЕНИЙ МИТОХОНДРИЙ







