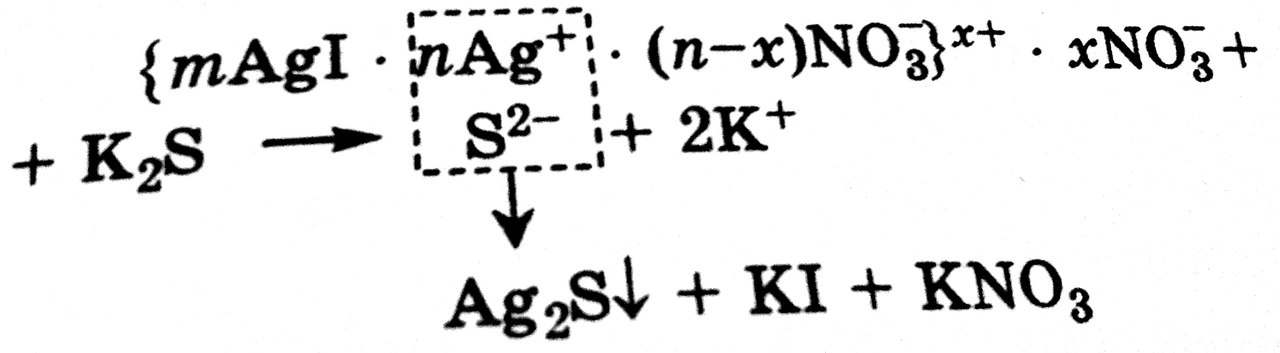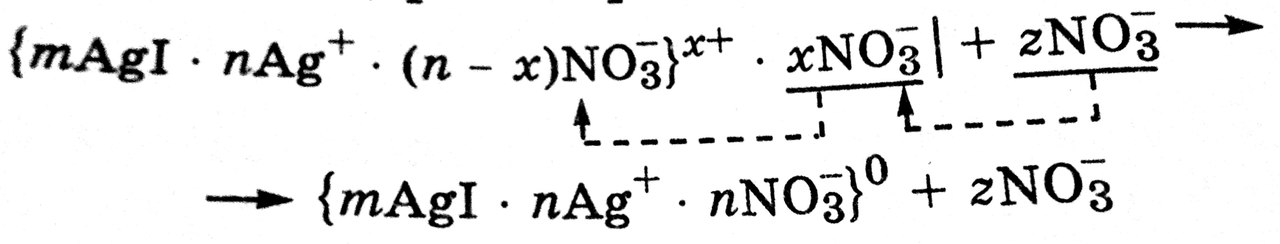1) Дисперсные системы. Классификация их по различным признакам. Краткая характеристика дисперсных систем. Виды устойчивости этих систем.
Дисперсной системой называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределенными в объеме другой однородной фазы.
Всяка дисперсная система состоит из дисперсной фазы и дисперсионной среды.
Дисперсионную фазу составляет мелкораздробленные частицы, равномерно распределенные в дисперсной системе.
Дисперсионную среду составляет однородная непрерывная фаза, в которой распределены частицы дисперсной фазы.
Классификацияпо размеру частиц дисперсной фазы:
1) Микрогетерогенные: суспензии, эмульсии, пены, аэрозоли. (М). не проходят через бумажный фильтр
2) Ультрамикрогетерогенные: коллоидные растворы. (П). проходят через бумажный фильтр, но не проходят через животные и растительные мембраны.
3) Молекулярно – дисперсные: истинные растворы низкомолекулярных веществ. (П). проходит через животные и растительные мембраны.
По агрегатному состоянию дисперсной фазы и дисперсионной среды:
Твердая – Газ – т/г – Дымы, пыли
Жидкая – Газ – ж/г – Туманы
Твердая – Жидкая – т/ж – Суспензии, коллоидные растворы
Жидкая – Жидкая – ж/ж – Эмульсии
Газ – Жидкая – г/ж – Пены.
По характеру взаимодействия дисперсной фазы с дисперсионной средой:
- Лиофобные системы: коллоидные растворы со стабилизатором (золи), суспензии, эмульсии, пены, аэрозоли. Слабое взаимодействие между дисперсной фазой и дисперсионной средой. Образуются за счет затраты энергии извне. Эндэргонический процесс. Необходим стабилизатор.
- Лиофильные системы: коллоидные растворы ПАВ и ВМС. Сильное взаимодействие между дисперсной фазой и дисперсионной средой. Образуются самопроизвольно. Экзэргонический процесс. термодинамические устойчивы. Стабилизатор не требуется.
По структурно – механическим свойствам:
- Свободнодисперсные системы: лиозоли, суспензии, эмульсии, кровь, аэрозоли (туманы, дымы, пыли). Дисперсная фаза подвижна, так как представлена отдельными не связанными между собой частицами, более или менее равномерно распределенными в объеме дисперсионной среды
- Связнодисперсные системы: лиогели, студни, волокнистые и пористые капиллярные системы (костная ткань, биологические мембраны). Дисперсная фаза практические неподвижна, так как образует сплошную структуру (сетку, каркас), внутри которой заключена дисперсионная среда.
Коллоидные растворы, как и другие дисперсные системы, могут быть лиофобными и лиофильными. И в тех, и в других структурными единицами являются мицеллы – микроструктуры, образующиеся при взаимодействии компонентов дисперсной фазы и дисперсионной среды.
Учебник: 709 – 710.
2) Гидрофобные коллоидные растворы, способы и условия их получения. Строение структурных частиц дисперсной фазы. Приведите схему строения мицеллы коллоидного раствора AgI, полученного обменной реакцией между AgNO 3 и KI в избытке KI. Укажите составные частицы мицеллы и причины возникновения межфазного (термодинамического) и электрокинетического потенциалов.
В биологических системах, например, в крови человека, содержится малорастворимые соли кальция, магния, а также холестерин и другие малорастворимые вещества, существующие в виде лиофобных коллоидных растворов. В литературе такие коллоидные растворы часто называют золями или лиозолями.
Такие системы являются термодинамически неустойчивыми, в них самопроизвольно происходят процессы, сопровождающиеся уменьшением свободной энергии (Δ Gs< 0).
Условия:
1) Малая растворимость дисперсной фазы, т.е. плохое сродство к ее дисперсионной среде;
2) Определенные размеры частиц дисперсной фазы (10-9 – 10-6 м);
3) Присутствие в системе стабилизатора.
Любое вещество может быть получено в коллоидном состоянии.
Получить коллоидный раствор можно двумя путями: измельчением крупных частиц до размеров коллоидных в присутствии стабилизатора – диспергационные методы – или объединением молекул и ионов в истинных растворах в более крупные коллоидные частицы – конденсационные методы.
Условия конденсационного метода:
- Использование достаточно разбавленных растворов;
- Небольшой избыток одного из реагирующих веществ, которое выполняет роль стабилизатора образующихся коллоидных частиц.
Лиофобные раствора обязательно требуют присутствие стабилизатора – электролита. Ионы стабилизатора адсорбируются на их поверхности ДЭС, следовательно, обеспечивается устойчивость дисперсионной системы.
Мицеллой лиофобной системы называется гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
 - KI (избыток)⇌K+ + I—
- KI (избыток)⇌K+ + I—
{[mAgI]*nI-(n-x)K+}*xK+
nI – потенциалопределяющий ион
(n-x)K+ - адсорбционные противоионы
xK+ - диффузные противоионы
- KNO3 (избыток) ⇌K+ + NO3-
{[mAgI]*nAg+(n-x)NO3-}*xNO3-
nAg+ - потенциалопределяющий ион
(n-x)NO3- - адсорбционные противоионы.
xNO3- - диффузные противоионы.
Ядром мицеллы лиофобного коллоидного раствора называется микрокристалл малорастворимого вещества, на поверхности которого адсорбированы потенциалопределяющие ионы, сообщающие заряд ядру мицеллы.
В мицелле с ионными стабилизатором во всякой гетерогенной системе, в которой на границе раздела фаз есть ДЭС, различают 2 потенциала:
- Межфазным потенциалом называется потенциал ДЭС на границе раздела между твердой и жидкой фазами в мицелле. Значение зависит от природы твердой фазы, а также от заряда и концентрации потенциалопределяющих ионов, адсорбированных на твердой фазе.
- Электрокинетическим потенциалом (дзета-потенциал) называется потенциал на границе скольжения между адсорбционной и диффузионной частями ЛЖС мицеллы. Значение определяется толщиной диффузного слоя, чем выше заряд противоионов и больше их концентрация, тем больше противоионов находится в плотном слое и меньше остается в диффузном слое.
Учебник: 710-715.
3) Молекулярно – кинетические свойства гидрофобных коллоидных растворов: броуновское движение, диффузия, осмос, оптические свойства. Диализ, его применение в медицине. Агрегативная и седиментационна устойчивость коллоидных растворов.
Молекулярно – кинетическая свойства к ним относятся свойства, связанные с тепловым движением частиц: броуновскоедвижение, диффузия, осмос. Эти свойства зависят от размеров и массы частиц дисперсной фазы (броуновское движение и диффузия), а также от числа частиц в единице объема системы (осмотическое давление).
Броуновское движение –беспорядочное движение микроскопических видимых, взвешенных в жидкости или газе частиц твердого вещества, вызываемое тепловым движением частиц жидкости или газа.
Диффузией в растворе называется самопроизвольный направленный процесс переноса частиц растворенного веществ и растворителя, который осуществляется при наличии градиента концентрации растворенного вещества и приводит к выравниванию концентрации этого вещества по всему объему раствора.
Осмосом называется самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью.
Оптические свойства. Специфическим свойством коллоидных растворов является их способность рассеивать свет. Это обусловлено гетерогенностью коллоидных систем и размерами коллоидных частиц.
Грубодисперсные системы, размеры частиц в которых значительно превышают длины волн видимого света, отражают свет и поэтому выглядят мутными.
Если размеры коллоидных частиц соизмеримы с длинами волн видимого света, то такие коллоидные растворы рассеивают свет вследствие явления дифракции.
Эффект Тиндаля (конус) при точечном боковом.
Обычное боковое освещение – голубоватая опалесценция раствора.
Отчистка коллоидных растворов от истинно растворенных веществ основывается на том, что относительно крупные коллоидные частицы, в отличие от молекул и ионов, не проникают сквозь поры животных и растительных мембран.
Диализ – процесс очистки коллоидных растворов от ионов и молекул низкомолекулярных примесей результате их диффузии в чистый растворитель сквозь полупроницаемую мембрану. (Очень медленно, чтобы увеличить скорость с помощью увеличения градиента концентрации растворенных веществ по обе стороны мембраны).
Для ускорения очистки коллоидных растворов от ионов растворенных электролитов используют также метод электродиализа. В этом случае во внешний сосед помещают электроды и подают постоянный электрический ток.
Электродиализ – это диализ в условиях наложения постоянного электрического поля, под действие которого катионы и анионы приобретают направленное движение к электродам.
В биологических жидкостях количественное определение низкомолекулярных веществ часто проводят методом компенсационного диализа, или вивидиализа. В этом случае биологическая жидкость в диализаторе омывается не чистым растворителем, а растворами с различными концентрациями определяемого вещества.
По принципу диализа работает аппарат «искусственная почка», применяемая при острой почечной недостаточности, которая может наступить в результате отравления сулемой, сульфаниламидными препаратами, при уремии после переливания крови, при тяжелых ожогах и т.п.
Устойчивость дисперсных систем характеризует способность дисперсной фазы сохранять состояние равномерного распределения частиц дисперсной фазы во всем объеме дисперсионной среды.
В дисперсных системах различают седиментационную и агрегативную устойчивость.
Седиментационная устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегативная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять неизменным свои размеры.
Грубодиспперсные системы гетерогенны и неустойчивы. Они самопроизвольно расслаиваются на дисперсную фазу и дисперсионную среду, так как относительно крупные частицы дисперсной фазы под действием сил тяжести оседают (седиментируют).
Расклинивающее давление – характеризует состояние тонкого слоя (пленки) жидкости или газа в промежутке между поверхностями тел. Составляющее:
- Электростатическое отталкивание одновременно заряженных частиц за счет большого скопления противоионов в области контакта ионных атмосфер;
- Расклинивание за счет упругих свойств гидратных оболочек, окружающих противоионы и состоящих из ориентированных (упорядоченных) диполей воды;
- Расклинивание за счет осмотического всасывания молекул растворителя в область контакта ионных атмосфер, т.е. в область большого скопления противоионов.
Учебник: 716 – 720.
4) Коагуляция гидрофобных коллоидных растворов. Влияние электролитов и смеси электролитов на коагуляцию. Правило Щульце – Гарди. Концентрационный и нейтрализационный механизмы коагуляции. Гетерокоагуляция.
Коагуляцией называется процесс слипания коллоидных частиц с образованием более крупных агрегатов из-за потери коллоидным раствором агрегативной устойчивости. Причиной коагуляции является потеря агрегативной устойчивости коллоидным раствором, а следствием коагуляции – уменьшение его седиментационной устойчивости. Практически коагуляцию можно вызвать различными внешними воздействиями: добавлением небольших количеств электролита концентрированием коллоидного раствора, изменением температуры, действием ультразвука, электромагнитного поля и др.
Коагуляция проявляется в процессе свертывания крови. Свертывание крови играет в организме две противоположные роли: с одной стороны, уменьшает потерю крови при повреждении ткани, с другой – вызывает образование тромбов в кровеносной системе.
Порогом коагуляции называется минимальное количество электролита, которое надо добавить к коллоидному раствору, чтобы вызывать явную коагуляцию (заметную на глаз) – помутнение раствора или изменение его окраски.
Cпк =  , где
, где
Cэл – исходная концентрация раствора электролита;
Vэл – объем раствора электролита, добавленного к коллоидному раствору;
Vкр – объем коллоидного раствора.
Величина, обратная порогу коагуляции, называется коагулирующим действием(у):
У = 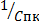
Коагулирующее действие электролитов на коллоидные растворы с ионным стабилизатором подчиняется правилу Шульце – Гарди: «Коагуляцию коллоидных растворов вызывают любые ионы, которые имеют знак заряда, противоположный заряжу гранул. Коагулирующее действие ионов (у) тем сильнее, чем выше заряд иона коагулянта».
Коагулирующее действие иона – коагулянта прямо пропорциональна его заряду в шестой степени: у=f(z6). Например, коагуляция золя AgI с отрицательно заряженными гранулами (потенциалопределяющие ионы – анионы I-) происходит за счет действия положительно заряженных ионов. Поэтому при добавлении к этому золю растворов NaCl, CaCl2, AlCl3 коагулирующее действие катионов Na+, Ca2+, Al3+ будет резко возрастать; y(Na+): y(Ca2+): y(Al3+) = 1: 64: 729.
Роль электролитов при коагуляции заключается в уменьшение расклинивающего давления между сближающимися коллоидными частицами. Это может происходит двумя путями: за счет уменьшения заряда поверхности твердой фазы (заряда поверхности ядра), т.е. за счет снижения межфазного потенциала 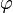 фм, или за счет уменьшения толщины (сжатия) ионных атмосфер мицелл при неизменном заряде поверхности их ядер. в связи с этим возможны два вида коагуляци и:нейтрализационная и концентрационная.
фм, или за счет уменьшения толщины (сжатия) ионных атмосфер мицелл при неизменном заряде поверхности их ядер. в связи с этим возможны два вида коагуляци и:нейтрализационная и концентрационная.
Нейтрализационная коагуляция наступает под действием электролита, который химически взаимодействует с потенциалопределяющими ионами, связывая их в прочное соединение (например, переводя в осадок) и тем самым уменьшая заряд поверхности ядра. Это происходит, например, при добавлении K2S к коллоидному раствору AgI с положительно заряженными гранулами (потенциалопределяющие ионы – катионы Ag+). Между анионами и катионами происходит реакция с образованием малорастворимого соединения Ag2S, что приводит к разрушению мицеллы AgI.
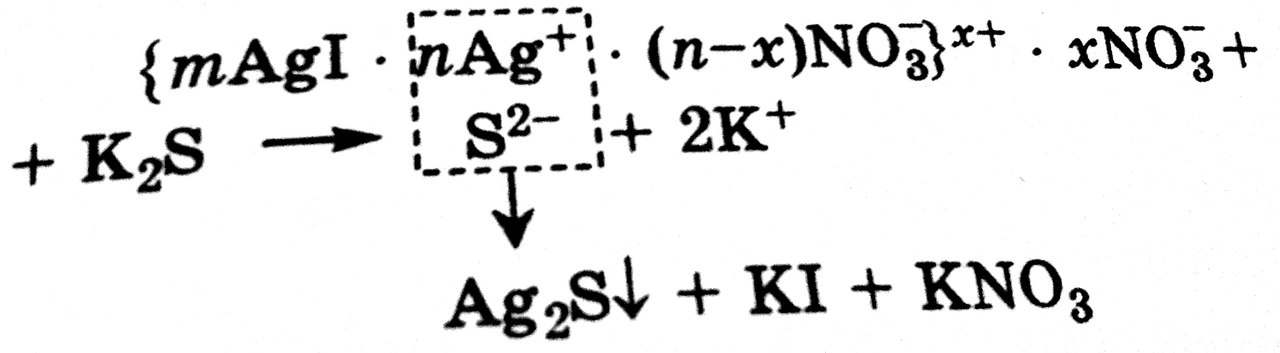
В результате связывания потенциалопределяющих катионов Ag+ межфазный потенциал 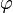 фм падает и число противоионов NO3- уменьшается. Таким образом ионные атмосферы вокруг ядер становятся тоньше, снижается расклинивающее давление между сближающимися частицами, а это в свою очередь приводит к их слипанию в более крупные агрегаты.
фм падает и число противоионов NO3- уменьшается. Таким образом ионные атмосферы вокруг ядер становятся тоньше, снижается расклинивающее давление между сближающимися частицами, а это в свою очередь приводит к их слипанию в более крупные агрегаты.
Концентрационная наступает под действием электролита, который химические не взаимодействует с ионами стабилизатора и не изменяет заряд поверхности ядра мицеллы. Концентрационная коагуляция наблюдается, например, при добавлении нитратов к коллоидному раствору AgI, мицеллы которого содержат противоионы NO3-.
По мере увеличения концентрации добавляемых ионов NO3- они способствуют внедрению противоионов диффузного слоя в адсорбционный слой. При этом диффузный слой сжимается, и может наступить такое состояние, при котором диффузный слой исчезнет вовсе, и гранула станет электронейтральной в таком состоянии расклинивающее давление между сближающимися частицами минимально, и это приводит к слипанию частиц в более крупные агрегаты.
Существуют три возможных варианта взаимодействия между электролитами: аддитивное действие, антагонизм и синергизм.
Аддитивность – это суммирование коагулирующего действия ионов, вызывающих коагуляцию. (Электролиты, содержащие коагулирующие ионы, не взаимодействуют химически с собой, KCl, NaNO3)
Антагонизм – это ослабление коагулирующего действия одного электролита в присутствии другого. (осадок выпал, Pb2+ + 2Cl- = PbCl2)
Синергизм – это усиление коагулирующего действия одного электролита в присутствии другого. (между электролитами проиходит химическое взаимодействие, в результате которого образуется многозарядный ион, обладающий очень высокой коагулирующей способностью. FeCl3 + 6KCNSàF3[Fe(CNS)6] + 3KCl
Гетерокоагуляцией называется коагуляция коллоидных растворов, содержащих разнородные частицы, отличающиеся по химической природе, знаку или величине заряда.
Учебник: 720 – 726.
5) Гидрофильные коллоидные растворы. Мицеллобразование в растворах ВМС и ПАВ. Критическая концентрация мицеллообразования (ККМ). Влияние концентрации ПАВ на процессы структурообразования в растворах. Понятие о простых и сложных липосомах.
К лиофильным коллоидным растворам относятся растворы поверхностно – активных веществ (ПАВ) и высокомолекулярных соединений (ВМС) в «хороших» растворителях.
Характерной особенностью является дифильность молекулы.
Мицеллами лиофильных коллоидных растворов называются ассоциаты из молекул поверхностно – активных веществ и высокомолекулярных соединений, возникающие самопроизвольно при концентрации, равной или большей ККМ, и образующие в растворе новую фазу.
ККМ (критическая концентрация мицеллообразования) - это резкое снижение поверхностного натяжения раствора ПАВ с увеличением его концентрации до определенного значения.
При концентрации ПАВ меньше значения ККМ на границе раздела между водным раствором и неполярной средой (воздухом или неполярной жидкостью) образуется монослой из молекул ПАВ – «частокол Лэнгмюра».
При концентрациях ПАВ, близких к ККМ, в толще воды начинают формироваться мицеллы из монослоев молекул ПАВ.
С увеличением концентрации ПАВ строение мицелл усложняется: сферические превращаются в эллипсоидные, а далее – в цилиндрические.
При концентрациях ПАВ в коллоидных растворах, превышающих ККМ в 10 – 100 раз, в зависимости от природы ПАВ из пластинчатых бислойных мицелл формируется объемная упорядоченная многослойная структура – ламелярная фаза.
Липосомы представляют собой микрокапсулы диаметром 10-5 - 10-7 м, содержащие внутри воду, окруженную одним или несколькими бислоями из молекул фосфолипидов или сфинголипидов.
Учебник: 729 – 734.
6) Электрокинетические свойства в дисперсных системах: потенциал течения, потенциал оседания, электрофорез, электроосмос. Использование этих явлений в медицине.
Термин «электрокинетические свойства» отражает взаимосвязь между электрическим полем и взаимным перемещением частиц дисперсной фазы и дисперсионной среды в дисперсных системах. (ДЭС)
Потенциалом течения называется разность потенциалов, возникающая на концах капиллярной системы при протекании через систему жидкой дисперсионной среды.
При сокращениях сердечной мышцы (миокарда) кровь проталкивается через капиллярную систему, что приводит к возникновению потенциала течения. Возникновение потенциала течения объясняется тем, что при движении через капиллярную систему жидкая дисперсионная среда увлекает за собой подвижные противоионы диффузного слоя, вследствие чего на конце капиллярной системы накапливается заряд, имеющий знак противоионов.
Использования методов электроосмоса и потенциала течения дает возможность определить заряд поверхности костной ткани и других пористых или волокнистых биологических структур.
Потенциалом седиментации (оседания) называется разность потенциалов, возникающая при оседании частиц дисперсной фазы в жидкой дисперсионной среде. Возникновение потенциала седиментации объясняется тем, что при оседании частиц дисперсной фазы нижние слои дисперсной системы приобретают заряд этих частиц, а верхние слои, обогащенные противоионами диффузной части ДЭС, приобретают заряд противоионов. (ПРОТИВОПОЛОЖНЫЙ ЭЛЕКТРОФОРЕЗ)
Электрофорезом называется направленное движение заряженных частиц дисперсной фазы относительно дисперсионной среды под действием электрического поля.
Методом электрофореза получены важные экспериментальные данные об электрохимических свойствах биологических систем. Внутренняя поверхность биологических мембран (клеточной стенки) заряжена отрицательно. Например, дзета – потенциал эритроцитов в крови человека практически постоянен и равен – 16,3 мВ.
Метод электрофореза позволяет разделять белки, аминокислоты и другие системы на отдельные фракции, пользуясь различием в скорости движения частиц дисперсной фазы в электрическом поле.
Электроосмосом называется направленное движение дисперсионной среды (жидкости) в капиллярной системе под действием электрического тока.
Одним из широкого используемых физиотерапевтических методов лечения многих заболевания является ионофорез, в основе которого лежит проникновение жидкостей, содержащих лечебные ионы и молекулы, через капиллярную систему кожного покрова под действием электрического поля. По существу – это явление электроосмосма.
Учебник: 760 – 763.



 - KI (избыток)⇌K+ + I—
- KI (избыток)⇌K+ + I— , где
, где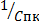
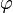 фм, или за счет уменьшения толщины (сжатия) ионных атмосфер мицелл при неизменном заряде поверхности их ядер. в связи с этим возможны два вида коагуляци и:нейтрализационная и концентрационная.
фм, или за счет уменьшения толщины (сжатия) ионных атмосфер мицелл при неизменном заряде поверхности их ядер. в связи с этим возможны два вида коагуляци и:нейтрализационная и концентрационная.