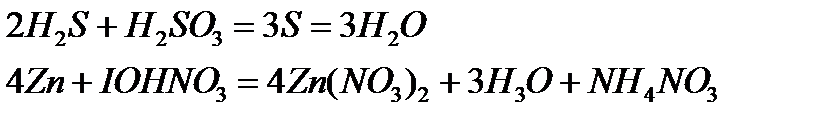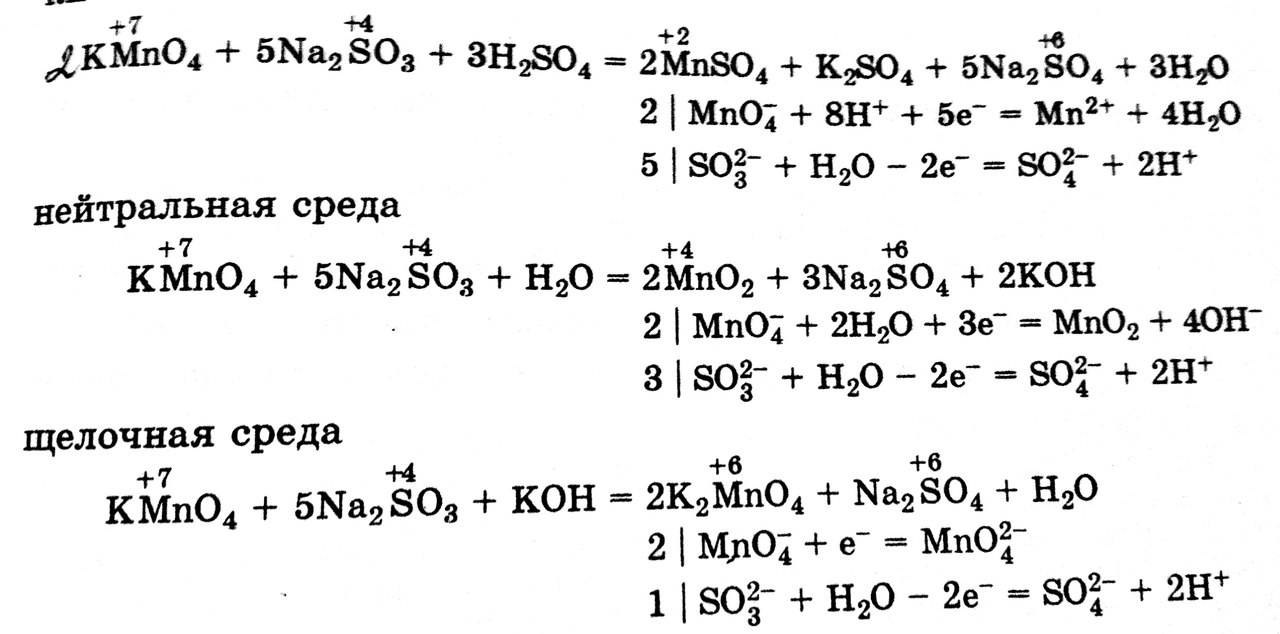1) Сущность окислительно – восстановительного взаимодействия. Сопряженные окислительно – восстановительные пары. Количественная мера силы окислителя и восстановителя в сопряженной паре. Критерий направления протекания ОВР и критерий необратимости реакции. Укажите направление протекания следующий реакций:
а) 2 FeCl 3 + 2 KI = FeCl 2 + I 2 + 2 KCl
б) 2 HI + S = I 2 + H 2 S
Окислительно – восстановительными реакциями называются химические реакции, протекающие с изменением степени окисления атомов вследствие перераспределения электронов между ними.
Окислением называется процесс отдачи электронов атомов вещества, сопровождающийся повышением степени его окисления. (-e)
Восстановлением называется процесс присоединения электронов атомом вещества, сопровождающийся понижением степени его окисления. (+e)
В ходе окислительно – восстановительной реакции оба процесса идут одновременно, а общее число отданных электронов равно общему принятых.
Окислителем называется вещество, в состав которого входят атомы, присоединяющие электроны, т. е. окислитель – акцептор электронов. (+e-)
Восстановителем называется вещество, в состав которого входят атомы, отдающие электроны, т.е. восстановитель – донор электронов. (-e-)
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Так, в реакции:
3Zn + 4H2SO4à 3 ZnSO4 + S + 4H2O
Участвуют пары: Zn2+, Zn0 и SO42-, S0 и протекают полуреакции:
3 | Zn0 – 2e-à Zn2+ 1 | S+6O42- + 6e- + 8H+à S0 + 4H2O
Эквивалентом окислителя или восстановителя называется его частица (реальная или условная), которая, соответственно, присоединяет или отдает один электрон.
Окислительно - восстановительные реакции самопроизвольно протекают всегда в сторону превращения сильного окислителя в слабый сопряженный восстановитель или сильного восстановителя в слабый сопряженный окислитель.
Восстановительные потенциалы – количественная мера окислительно-восстановительной способности данной сопряженной окислительно восстановительной пары.
Стандартный восстановительный потенциал Ф0 – значение, которой принимает Ф при стандартных условиях: концентрация всех компонентов, участвующих в реакции, включая ионы воды H+ (в кислой среде) и OH- (в щелочной среде), равна 1 моль/л, температура 298 К.
Суть окислительно – восстановительных реакций заключается в конкуренции за присоединение электрона между участвующими окислителями. При этом электрон присоединяет та сопряженная пара, окисленная форма которой сильнее его удерживает.
ЭДС окислительно – восстановительной реакции в стандартных условиях (E0) численно равна разности стандартных потенциалов сопряженных окислительно – восстановительных пар, участвующих в реакции: E0= ф0ок – ф0восст> 0.
Условием самопроизвольного протекания окислительно – восстановительной реакции является положительное значение ее ЭДС.
Если |E0| > 0.35 В, то реакций необратима.
Укажите направление протекания следующий реакций:
а) 2FeCl3 + 2KI => FeCl2 + I2 + 2KCl
ф0восст (I20,I-) = +0,54 В
ф0окисл (Fe+3, Fe+2) = +0,77 В
E0= ф0ок – ф0восст= 0,77 В – 0,54 В = 0,23 В > 0 (самопроизвольно протекает прямая реакция)
б) 2HI + S = I2 + H2S
ф0окисл (I20,I-) = +0,54 В
ф0восст (S0, S2-) = 0,17 В
E0= ф0ок – ф0восст= 0,54, В - 0,17 В = 0,37 В > 0 (самопроизвольно протекает прямая реакция)
Учебник: 208-215.
2) Типы окислительно – восстановительных реакций:
а) внутримолекулярные,
б) диспропорционирования (простых веществ, оксидов и солей),
в) межмолекулярные. ОВР. Приведите примеры. Типы окислительно – восстановительных реакций в живом организме.
А ) Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
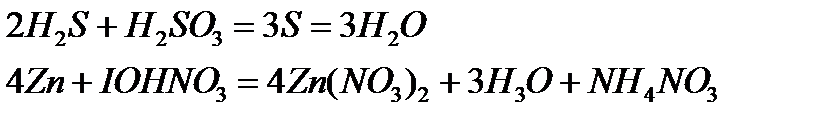
Б) Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
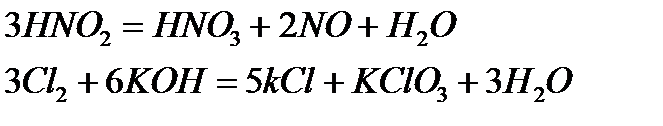
В) Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2

3) Влияние внешних факторов на протекание окислительно – восстановительных реакциях. Рассмотрите это влияние на следующих реакциях:
Факторы: концентрация реагента, температура реакции, наличие катализатора, влияние характера среды.
а) Zn + H2SO4 (разб.) = …; Zn + H2SO4 (конц.) = …;
Zn0 + H+12SO4 (разб.) = Zn+2SO4 + H20 (окислитель H+)
Zn0 + H2S+6O4 (конц.) = 3Zn+2SO4 + S0 + 4H2O (окислитель S+6)
б) Cl2 + KOH (холод) = …; Cl2 + KOH (горяч.) = …;
Cl20 + KOH (холод) = K-1Cl + KCl+1O + H2O
Cl2 + KOH (горяч.) = 5K-1Cl + KCl+5O3 + 3H2O
в) KMnO4 + Na2SO3 + (1) H2SO4 = … + (2) H2O = … + (3) NaOH (в картинке KOH(!) будьте осторожны)
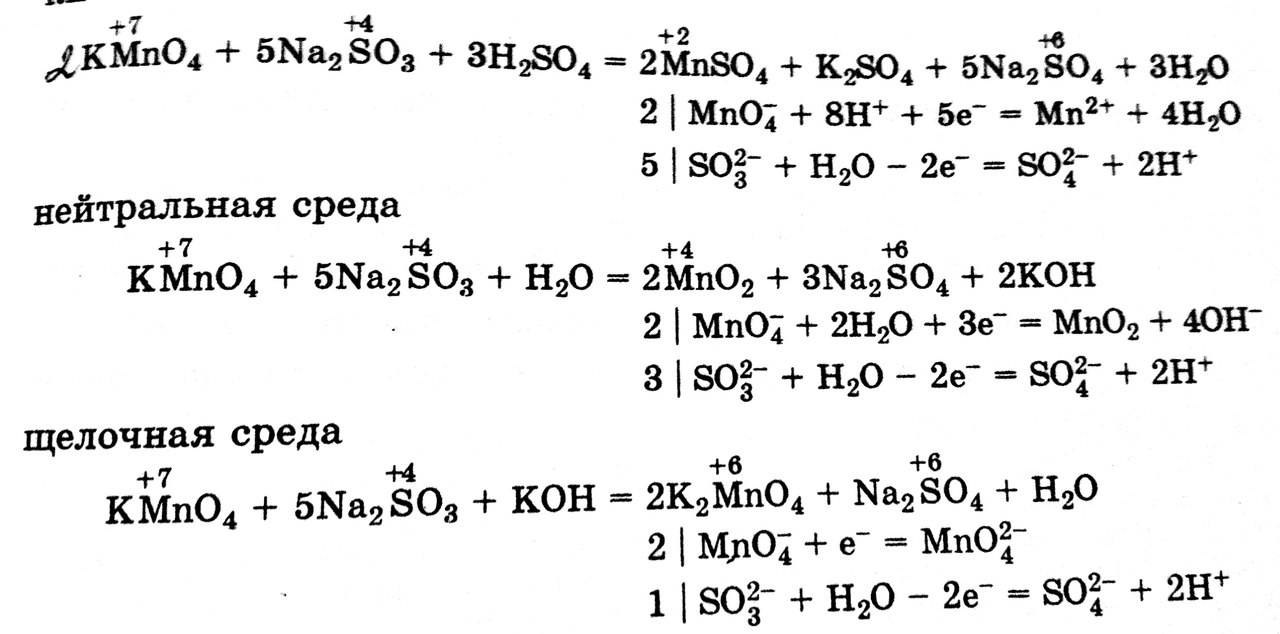
Учебник: 211.