1) Классификация распространенность химических элементов в организме человека и в окружающей среде. Особенности строения атомов углерода и его химических связей с элементами – органогенами. Кислотно – основные, окислительно – восстановительные и комплексообразующие свойства соединений углерода.
Органогены – шесть химических элементов: углерод, водород, кислород, азот, фосфор и сера. Общая массовая доля этих элементов в организме человека составляет 97,3 %. Из них C-21,0, H-9,7, O-62,4, N-3,1, P-0,95 и S-0,16 %. Для них характерно разнообразие образуемых ими связей, следовательно, многообразие биомолекул.
Металлы жизни – десять элементов: K, Na, Ca, Mg, Mn, Fe, Co, Cu, Zn, Mo. На их долю в организме приходится 2,4 %. Все металлы жизни в организме или находятся в виде свободных катионов, или являются ионами – комплексообразователями, связанными с биолигандами. Принимают активное участие в обмене веществ.
Биогенными элементами называют элементы, необходимые для построения и жизнедеятельности различных клеток организмов.
Основные неметаллы: F, Cl, Br, I, Si, Se, As; металлы: Li, Ba, Sr, Sn, Ti, V, Cr. Суммарное содержание всех этих элементов в организме составляет меньше 0,3 %, из них 0, 08 % приходится на хлор. Содержание остальных биогенных элементов находится в пределах 10-6-10-4 %.
Макроэлементы – элементы, содержание которых в организме больше 10-3 %. (Ткани, осмотический, водно – электролитный, кислотно-основный, окислительно – восстановительный и металло - лигандный гомеостаз).
Микроэлементы – элементы, содержание которых в организме находится в пределах 10-6-10-3 %. (Ферменты, гормоны, витамины и другие биологические активные соединения, в основном в качестве комплексообразователей или активаторов обмена веществ).
Элементы – токсиканты – Be, Ba, As, Pb, Cd, Hg, Tl – элементы, способные привести к летальному исходу.
Особенности строения атомов углерода и его химических связей с элементами – органогенами.
Углерод (С) – в периодической системе элементов располагается во втором периоде в группе IVА. Электронная конфигурация атома углерода 1s22s22p2. 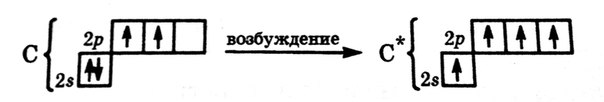
Вследствие этого для углерода характерны степени окисления: от -4 до +4, и типы гибридизации sp3,sp2,sp1. 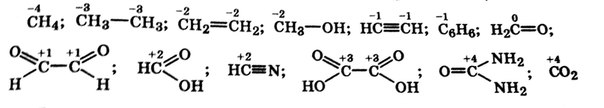
Все рассмотренные данные о свойствах углеродосодержащих связей свидетельствуют о том, что углерод в соединениях образует, с одной стороны, достаточно прочные ковалентные связи между собой и с другими органогенами, а с другой стороны – общие электронные пары этих связей достаточно лабильны. В результате этого может происходить как увеличение реакционной способности этих связей, так и стабилизация. Именно эти особенности углеродосодержащих соединений и делают углерод органогеном номер один.
Кислотно – основные свойства соединений углерода.
Оксид углерода (IV) кислотным оксидом, а соответствующий ему гидроксид – угольна кислота H2CO3 – слабой кислотой.
Угольная кислота существует только в растворе. Она образует два ряда солей – гидрокарбонаты (NaHCO3, Ca(HCO3)2) и карбонаты (Na2CO3, CaCO3). В воде гидрокарбонаты растворяются луче, чем карбонаты.
Совокупность угольной кислоты и гидрокарбонат - иона (H2CO3, HCO3-) образует гидрокарбонатную буферную систему – главную буферную систему плазму крови.
Синильная кислота, или циановодород, HCN – бесцветная, легколетучая жидкость с запахом горького миндаля, смешивающаяся с водой в любых соотношениях. Соли – цианиды.
При длительном воздействии CO2, содержащегося в воздухе, цианиды разлагаются с выделением синильной кислоты:
2KCN + CO2 + H2O à K2CO3 + 2HCN.
Окислительно – восстановительные свойства.
В ходе реакция углерод может и отдавать, и присоединять электроны, выступая соответственно восстановителем или окислителем в зависимости от свойств второго реагента:
C – восстановитель.
C + O2àCO2
С – окислитель.
C + 2H2àCH4
При взаимодействии сильных окислителей с органическими веществами может протекать неполное или полное окисление атомов углерода этих соединений.
Неполное окисление:
CH4 + O2àC + 2H2O
CH4 + Cl2à CH3Cl + HCl
C2H5OH + O2à CH3CHO + H2O
Полное окисление:
CH4 + 2O2àCO2 + 2H2O
CH4 + 4Cl2à CCl4 + 4HCl
C2H5OH + 3O2à 2CO2 + 3H2O
В условиях анаэробного окисления при недостатке или отсутствии кислорода атомы углерода органического соединения в зависимости от содержания кислородных атомов в этих соединениях и внешних условий могут превращать CO2, CO, C и даже CH4.
В органических соединениях степень окисления изменяют только атомы углерода, а атомы остальных органогенов при этом сохраняют свою степени окисления.
При реакциях гидрирования, т.е. присоединения водорода (восстановителя) по кратной связи, образующие ее атомы углерода понижают свою степени окисления (выступают окислителями).
Атом углерода в соединении – окислитель, если в результате реакции увеличивается число его связей с атомами менее электроотрицательных элементов (водород, металлы), потому что, притягивая к себе общие электроны этих связей, рассматриваемый атом углерода понижает свою степени окисления.
Атом углерода в соединении – восстановитель, если в результате реакции увеличивается число его связей с атомами более электроотрицательных элементов (C, O, N, S), потому что, отталкивая от себя общие электроны этих связей, рассматриваемый атом углерода повышает свою степень окисления.
Комплексообразующие свойства соединений углерода.
У атом углерода в соединениях нет неподеленных электронных пар, и поэтому лигандами могут выступать только соединения углерода, содержащие кратные связи с его участием.
CO – несолеобразующий оксид, CO – восстановитель при T> 1000 K. Хороший лиганд в реакциях комплексооборазования с атомами и катионами d – металлов, прежде всего с железом, с которым он образует пентакарбонил железа – летучую ядовитую жидкость:
Fe0 + 5 CO à [Fe0(CO)5]
Учебник: 284-287, 295–302.
2) Особенности строения атома кислорода. Кислотно – основные, окислительно – восстановительные и комплексообразующие свойства кислорода. Его роль в организме и в окружающей среде.
Кислород – самый распространенный элемент биосферы (более 50 % по массе). Без кислорода невозможны многочисленные чрезвычайно важные жизненные процессы, прежде всего дыхание и окисление биосубстартов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Кислород в периодической системе находится во втором периоде в группе VIA. Электронная конфигурация его атома 1s22s22p4. Наличие двух неспаренных электронов обеспечивает образование двух связей. Отсутствие вакантных атомных орбиталей во внешнем слое не позволяет кислороду повысить валентность за счет распаривания электронов, как это имеет место у его ближайшего соседа по группе атома серы. Наличие двух неподеленных пар электронов дает возможность атому кислорода выступать в роли донор одной из них при образовании донорно – акцепторной связи.
Степень окисления кислорода в соединениях обычно равна -2. (Бывает -1 H2O2, +2 OF2).
Кислород существуют в двух аллотропных модификациях: дикислород O2 (кислород) и трикислород O3 (озон).
Высокая химическая активность кислорода, определяющая его ведущую роль в процессах метаболизма, объясняется тем. Что молекула кислорода имеет структуру бирадикала («Триплетный кислород»).
Кислотно – основные свойства кислорода:
Рассмотрите соединение вида: Элемент-О-Н. Если в этом соединении слабее первая связь (т.е. легче отрывается гидроксид) - то это соединение проявляет больше свойства основные, если слабее вторая связь (т.е. легче отщепляется протон) - это уже кислота. А прочность первой связи будет завесить (вспомните закон Кулона) от расстояния между атомами и заряда их. Поскольку заряд атома кислорода - в данном случае постоянен, подумаем пока только о заряде этого некоего элемента. Чем он меньше, и чем больше его заряд, тем больше кислотных свойств будет он проявлять. А это - элементы, находящиеся в правом верхнем углу таблицы, металлы в высших степенях окисления. А если элемент имеет низкую степень окисления (малый заряд), да еще и "толстые" электронные оболочки (левый нижний угол таблицы) - он проявляет основные свойства.
Окислительно – восстановительные свойства.
Главная химическая функция кислорода в организме – окисление веществ, которое всегда сопровождается выделением энергии.
Для клетки очень важно, чтобы происходила полная утилизация кислорода:
O2 + 4e- + 4H+à 2H2O
Пероксид водорода H2O2 широкого используется в медицинской практике в основном как наружное бактерицидное средство. Действие H2O2 основано на его окислительной способности и безвредности образующихся продуктов O2 и H2O. Выделяющийся кислород оказывает противомикробное, дезодорирующее и депигментирующее действие. В то же время образующаяся пена способствует очищению ран, удаляя из них частицы тканевого распада.
Чистый пероксид термодинамически нестабилен и легко разлагается на воду и кислород, а на свету этот процесс протекает со взрывом.
2H2O2-1à 2H2O-2 + O20
Восстановительные свойства пероксид водорода проявляет только по отношению к сильным окислителям, окисляясь до свободного кислорода:
5H2O2-1 + 2KMn+7O4 + 3H2SO4 = 2Mn+2SO4 + K2SO4 + 8H2O + 5O20
Комплексообразующие свойства.
Молекула кислорода, хотя и содержит неподеленные электронные пары, является малоактивным лигандом. Кислород плохо растворим в воде.
Функцию транспорта кислорода у высших животных выполняет находящийся в эритроцитах гемоглобин, который, соединяясь в легких с кислородом, образует легко диссоциирующий комплекс оксигемоглобин.
 Кислородосодержащие соединения из-за низкой подвижности неподеленных электронных пар атома кислорода также являются малоактивными лигандами. Однако, если кислородосодержащая группа в соединении образует анион, то подвижность электронных пар в системе, несущей отрицательный заряд, резко возрастает. Это способствует образованию комплексных соединений. Так, многоатомные спирты или многоосновные органические кислоты дают в щелочной среде устойчивые хелатные комплексы с катионами d – металлов:
Кислородосодержащие соединения из-за низкой подвижности неподеленных электронных пар атома кислорода также являются малоактивными лигандами. Однако, если кислородосодержащая группа в соединении образует анион, то подвижность электронных пар в системе, несущей отрицательный заряд, резко возрастает. Это способствует образованию комплексных соединений. Так, многоатомные спирты или многоосновные органические кислоты дают в щелочной среде устойчивые хелатные комплексы с катионами d – металлов:
Основной (фактически единственной) функцией кислорода является его участие как окислителя в окислительно-восстановительных реакциях в организме. Благодаря наличию кислорода, организмы всех животных способны утилизировать (фактически «сжигать») различные вещества (углеводы, жиры, белки) с извлечением определенной энергии «сгорания» для собственных нужд. В покое организм взрослого человека потребляет 1,8-2,4 г кислорода в минуту.
Учебник: 318-322.
3) Особенности строения и гибридизации атомных орбиталей азота. Основные, кислотные, комплексообразующие и нуклеофильные свойства атома азота в его соединениях. Аммиак, его строение и химические свойства. Кислородные соединения азота. Нитраты и нитриты. Механизм их токсичного действия на организм.
В периодической системе азот находится во II периоде, в группе VA. Электронная конфигурация его атома – 1s22s22p3. Наличие во внешнем слое атоме азота трех неспаренных электронов обеспечивает образовании им трех связей в соединениях. Из-за наличия во внешнем слое неподелённой пары электроном атом азота может образовывать еще одну связь (четвертую) по ДАМ, выступая донором электронной пары.
В бинарных соединениях с любыми элементом, кроме кислорода и фтора, атом азота имеет отрицательную степень окисления. Степень окисления атома азота может изменяться –3 до +5:

Азот способен к образованию ковалентных связей с другими атомами по обменному механизму. Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Азот образует несколько водородных соединений – это гидразин, гидроксиламин и аммиак.
Основные свойства азота- инертность в большинстве случаев, возможность вступать в химические реакции при определенных условиях.
Кислотные свойства выражены очень слабо. Растворенные в воде органические соединения азота определяют комплексообразующие свойства воды.
Первичные и вторичные амины, могут проявлять слабые кислотные свойства, в аминах могут растворяться щелочные металлы с выделением водорода. Более важным свойством аминов является их основность, т. е. способность взаимодействовать с кислотами. На атоме азота присутствуют неподеленная пара электронов, которую он может обобществлять с атомами акцептора, образуя сам или комплексы. При растворении в воде, амины взаимодействуют с ней как с кислотой, образуя гидроксиды. Электронодонорные заместители увеличивают основные свойства аминов, а электроноакцепторные уменьшают.
Амины, как и аммиак, могут атаковать положительно заряженный атом углерода, вызывая реакции нуклеофильного замещения. Нуклеофильные реакции аммиака и аминов с ацильными производными – приводит к образованию амидов.
Создатель теории комплексных соединений, она называется еще координационной теорией, – шведский ученый Альфред Вернер. В начале прошлого столетия наибольший прогресс в этой области химии достигнут в нашей стране благодаря Льву Александровичу Чугаеву, который создал уникальную школу химиков-комплексников.
Рассмотрим комплексное соединение на конкретном примере: если, получив гидроксид меди, добавить к осадку раствор аммиака в воде, то осадок исчезнет, а раствор станет прозрачным и темно-синим. Это образовалось комплексное соединение. Запишем уравнения реакций:

Аммиак NH3 в организме человека является одним из продуктов дезаминирования аминокислот, белков, биогенных аминов, пуриновых и пиримидиновых оснований, поступающих с пищей.
Аммиак – бесцветный газ с резким запахом. В молекуле аммиака атом азота образует четыре гибридные орбитали sp3, направленные к вершинам тетраэдра, три из которых заняты атомами водорода, а четвертая – неподеленной парой электронов.
Наличие у атома азота аммиака неподеленной электронной пары на гибридной sp3 – орбитали делает его молекулу активным лигандом, который с катионами металлов жизни Cu2+, Zn2+, Ni2+ образует прочные аммиачные комплекс, устойчивость которых соизмерима с прочностью их бикомплексов, что может объяснять токсичность аммиака.
Качественный и количественный определитель аммиака – реакция с помощью реактива Несслера.
Нуклеофильность молекулы аммиака, т.е. ее сродство к атому углерода, несущему частичный положительный заряд, проявляется в способности алкилироваться галоидными алкилами в присутствии оснований. При это в зависимости от соотношения регентов образуются различные алкиламины вплоть до получения солей тетраалкиламмония.
Несмотря на низшую степень окисления атома азота (-3), аммиак в условиях организма устойчив к окислению. Его восстановительные свойства проявляются только при высокой температуре, когда происходит горение аммиака в кислороде с образование азота, а в присутствии платинового катализатора – до оксида азота (II):
4NH3 +3O2 = 2N2 + 6H2O
4NH3 + 5O2 = (Pt) = 4NO + 6H2O
Кислородные соединения азота. Азот образует с кислородом ряд оксидов.
Оксид азота (I) N 2 O (закись азота) – малополярный, несолеобразующий оксид, который при температуре ниже 500oС химически малоактивен. Атомы азота в нем не равноценны и имеют разную степень окисления. Закись азота – бесцветный газ, который в смеси с кислородом используется в медицине для ингаляционного наркоза.
Оксид азота (II) NO – также несолеобразующий оксид. В окислительно – восстанвительных реакциях он может быть восстановителем или окислителем, так как его азот имеет промежуточную степень окисления:
2NO + O2 = 2NO2
2NO + H2 = N2 + 2H2O
Из-за подвижность  - электронов оксид азота (II) является лигандом, который образует, подобно кислороду, комплексно соединение с катионом железа гемоглобина HHbNO, устойчивость которого в 60 раз больше, чем оксигемоглобина:
- электронов оксид азота (II) является лигандом, который образует, подобно кислороду, комплексно соединение с катионом железа гемоглобина HHbNO, устойчивость которого в 60 раз больше, чем оксигемоглобина:
HHb + NOàHHbNO
В этом заключается одна из причин токсичности оксида азота (II).
Оксид азота (III) N2O3 – кислотный оксид, который при растворении в воде образует слабую азотистую кислоту:
N2O3 + H2O = 2HNO2
Соли азотистой кислоты – нитриты – могут вести себя и как окислители, и как восстановители, в зависимости от свойств партнера.
Оксид азота (IV) NO 2 – красно – бурый газ, обладающий характерным запахом. При растворении NO2 в воде образуется азотистая и азотная кислоты:
2NO2 +H2O = HNO2 + HNO3
Эта реакция сопровождается межмолекулярной окислительно – восстановительной дисмутацией атомов азота.
В присутствии кислорода образуется только азотная кислота:
4NO2 + 2H2O + O2 = 4HNO3.
Оксид азота (V) N 2 O 5 – кислотный оксид, при его растворении в воде образуется азотная кислота. Соли азотной кислоты – нитраты, присутствующие в больших количествах в некоторых продуктах питания, попадая в организм, легко восстанавливаются до токсичных нитритов:
NO3- +2H+ +2e-àNO2- + H2O
Нитраты - соли азотной кислоты. Нитраты получают действием азотной кислоты HNO3 на металлы, оксиды, гидроксиды, соли. Практически все нитраты хорошо растворимы в воде. Нитраты являются достаточно сильными окислителями в твёрдом состоянии (обычно в виде расплава), но практически не обладают окислительными свойствами в растворе, в отличие от азотной кислоты.
Нитриты — соли азотистой кислоты HNO2. Нитриты термически менее устойчивы, чем нитраты. Нитриты попадают в кровь человека двумя путями: прямым содержанием или же нитратами, которые в крови человека превращаются в нитриты. Они — яд для гемоглобина человека.
Воздействие на организм: синюшность ногтей, губ, тошнота, рвота, боли в животе, смерть.
Попадание в организм: через продукты, лекарства, через питьевую воду и т.д
Нитраты снижают содержание витаминов в пище. Способствуют развитию патогенной химической микрофлоре, которая выделяет ядовитые химические вещества – токсины. Нитраты влияют на опухолевые заболевания. Вызывают резкое расширение сосудов, понижают кровяное давление.
Учебник: 304–311.
4) Строение и химические свойства фосфора и его соединений. Роль фосфатов в организме (структурообразующая и энергетическая). Взаимосвязь обмена фосфора и кальция в организме. Круговорот фосфора в природе.
В периодической системе фосфор, как и азот, находится в группе VA, но в III периоде. Его электронная конфигурация 1s22s22p63s23p3. Его электронная конфигурация приводит к образованию трех связей. Однако, фосфор имеет в валентном слое свободные 3d – орбитали. Поэтому при возбуждении атома фосфора легко достигается состояние с пятью неспаренными электронами 1s22s22p63s13p33d1, что позволяет ему образовывать пять связей. Таким образом, фосфор в своих соединениях проявляет валентность 3 и 5. Степень окисления атома фосфора в соединениях может  меняться от -3 до +5.
меняться от -3 до +5.
В природе встречается только в формах, содержащих фосфат – анион PO43-. Это обусловлено тем, что фосфор образует с кислородом более прочные связи, чем с другими органогенами.
В организме фосфор встречается только в виде фосфатов, неорганических и органических. Все они имеют тетраэдрическую структуру, в которой атом фосфора расположен в центре тетраэдра, а атомы кислорода – в его вершинах.
Фосфаты в живых организмах играют две ключевые роли. Во-первых, служат структурными компонентами скелета, клеточных мембран и НК. Во-вторых, роль фосфатов, точнее полифосфатов организме заключается в аккумуляции и переносе энергии от экзэргонических к эндорганическим реакциям и процессам.
Кислотные свойства:
Из оксидов фосфора наибольшее значение имеет оксид фосфора (V) P2O5, проявляющий кислотные свойства и существующий в молекулярной форме P4O10. Главная особенность оксида P2O5– очень большое сродство к воде. Поэтому он часто используется как эффективный осушитель для газов и органических растворителей.
Оксид фосфора (V) может присоединять одну, две, три и более молекул воды. При это образуются метафосфорная, дифосфорная или пирофосфорная, ортофосфорная и полифосфорные кислоты.
Самое замечательное свойство этих кислот – способность превращаться друг в друга в результате гидролиза (присоединения воды) или в результате дегидратации (потери воды).
Ортофосфорная кислота H3PO4 – трехосновная кислота. Она образует средние (Na3PO4) кислые (Na2HPO4 и NaH2PO4) соли. В водных растворах соли ортофосфорной кислоты гидролизуются.
Совокупность кислых фосфатов HPO42- и H2PO4- образует в крови фосфатную буферную систему, которая вместе с другими буферными системами обеспечивает постоянство pH крови.
Обмен фосфора в организме тесно связан с обмене кальция, но эта связь антагонистична. При увеличении содержания кальция в крови наблюдается уменьшение содержания фосфатов, прежде всего неорганических.
Дифосфорная кислота H4P2O7 – хорошо растворима в воде и в растворе постепенно (а при нагревании – быстрее) превращается в ортофосфорную кислоту в результате гидролиза по ангидридной группе.
Дифосфорная кислота является более сильной, чем ортофосфорная, в соответствии с общим правилом увеличения силы кислот при их конденсации.
Фосфор присутствует в живых клетках в виде ортофосфатной и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800—1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Круговорот фосфора в природе осуществляется посредством фосфатов, поэтому он не сложен, так как не сопровождается изменениями степени окисления атома фосфора. Значительная часть фосфора рано или поздно попадает в океан и откладывается в виде фосфатов в осадочных породах.
Учебник: 311 – 318.
5) Особенности строения атома серы и серосодержащих природных соединений, их роль в организме. Кислородные соединения серы и их свойства. Круговорот серы в природе.
В периодической системе сера расположена в III периоде, в группе VIA. Электронная конфигурация ее атома 1s22s22p63s23p4. Наличие во внешнем слое двух неспаренных электронов позволяет атому серы образовывать две связи. При возбуждении у атома серы могут возникать состояния с четырьмя неспаренными электронами. При возбуждении у атома серы могут возникать состояния с четырьмя неспаренными электронами s23p33d1 и с шестью неспаренными электронами 3s13p33d2, которые позволяют сере образовывать 4 и 6 связей соответственно. Максимальная степень окисления серы +6 (SO3, H2SO4), а минимальная -2 (H2S).в серосодержащих биосубстратах организма сера обычно имеет минимальную степень окисления (-2), что способствует высокой восстановительной активности этих соединений, особенно соединений, содержащих тиофильную группу (R-SH). Эта группа окисляется в дисульфидную группу (R-S-S-R), содержащую атомы серы со степенью окисления -1.
Сера находится в пятёрки важнейших биоэлементов нашей планеты. Без её участия не может обойтись ни один обменный процесс в организме. Роль серы трудно переоценить т.к. этот макроэлемент является составной частью всех без исключения белков. Сера-обязательная составная часть клеточных структур, тканей, кожные покровы, волосы и т.д.
Кислородные соединения серы.
Сера с кислородом образует два кислотных оксида: SO 2 – оксид серы (IV) и SO 3 – оксид серы (VI).
При растворении в воде оксида серы (IV) образует сложную равновесную систему на основе слабой малоустойчивой сернистой кислоты:
SO2 + H2OàßH2SO3
Эта кислота образует два типа солей: средние – сульфиты (Na2SO3, K2SO3) и кислые – гидросульфиты (NaHSO3, KHSO3).
Оксид серы (VI) SO3 активно поглощает воду, образуя сильную серную кислоту, которая полностью диссоциирована по первой ступени и в меньшей степени по второй ступени:
SO3 + H2OàßH2SO4
Соли серной кислоты – сульфаты и гидросульфаты – в водном растворе не подвергаются гидролизу по аниону. Многие сульфаты хорошо растворимы в воде и применяются в качестве лекарственных препаратов: Na2SO4 * 7H2O – глауберова соль, MgSO4 * 7H2O – горькая соль, CuSO4 * 5H2O – медный купорос.
Образующаяся в организме эндогенная серная кислота участвует в обезвреживании ядовитых соединений фенола, крезола, индиола, вырабатываемых в кишечнике из аминокислот микробами. С этими соединениями серная кислота образует эфиры сульфаты, которые выводятся из организма с мочой.
В разбавленных растворах серная кислота- окислитель за счёт катионов водорода, которые восстанавливаются до элементарного водорода.
Тиосульфат натрия Na2S2O3. Поскольку один из атомов серы в тиосульфат - ионе эквивалентен атому кислорода, считают, что его степень окисления равна -2, а степень окисления центрального атома серы +6. Тиосульфат - ион проявляет окислительно- восстановительную двойственность, является активным лигандом в реакциях комплексооборазования, для него характерны также реакции осаждения.
Круговорот серы в природе.
По содержанию в природе сера - один из распространённых элементов. В земной коре она присутствует в виде свободной серы, сульфидов и сульфатов. Последних много и в гидросфере. Потребности животных в соединениях серы удовлетворяются только за счёт растений, которые усваивают ее в основном из почвы в виде сульфатов и включают в состав серосодержащих белков. В результате сжигания ископаемого топлива, загрязненного серой, и плавки сульфидных руд в атмосферу поступают загрязняющие ее оксиды серы. В круговороте серы большую роль играют аэробные и анаэробные микроорганизмы, которые восстанавливают и окисляют серосодержащие соединения.
Учебник: 322-331.



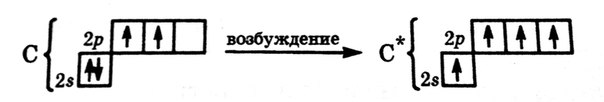

 Кислородосодержащие соединения из-за низкой подвижности неподеленных электронных пар атома кислорода также являются малоактивными лигандами. Однако, если кислородосодержащая группа в соединении образует анион, то подвижность электронных пар в системе, несущей отрицательный заряд, резко возрастает. Это способствует образованию комплексных соединений. Так, многоатомные спирты или многоосновные органические кислоты дают в щелочной среде устойчивые хелатные комплексы с катионами d – металлов:
Кислородосодержащие соединения из-за низкой подвижности неподеленных электронных пар атома кислорода также являются малоактивными лигандами. Однако, если кислородосодержащая группа в соединении образует анион, то подвижность электронных пар в системе, несущей отрицательный заряд, резко возрастает. Это способствует образованию комплексных соединений. Так, многоатомные спирты или многоосновные органические кислоты дают в щелочной среде устойчивые хелатные комплексы с катионами d – металлов:

 - электронов оксид азота (II) является лигандом, который образует, подобно кислороду, комплексно соединение с катионом железа гемоглобина HHbNO, устойчивость которого в 60 раз больше, чем оксигемоглобина:
- электронов оксид азота (II) является лигандом, который образует, подобно кислороду, комплексно соединение с катионом железа гемоглобина HHbNO, устойчивость которого в 60 раз больше, чем оксигемоглобина: меняться от -3 до +5.
меняться от -3 до +5.

