1) Межфазные электрические потенциалы, их виды и причины возникновения. Электродный потенциал и факторы, влияющие на его величину. Стандартный электродный потенциал, его определение. Уравнение Нернста. Метод прямой потенциометрии.
Двойным электрическим слоем (ДЭС) называется упорядоченное распределение противоположно заряженных частиц на межфазной границе.
В зависимости от природы соприкасающихся фаз и характера процессов, протекающих на границе их раздела, различают следующие виды электрических потенциалов:
- Электродный потенциал возникает на границе металл – раствор в результате протекания окислительно – восстановительных реакция на межфазной границе, сопровождаемых переходом катионов металла через нее.
- Восстановительный потенциал возникает на границе инертный электропроводник – раствор, содержащий сопряженную окислительно – восстановительную пару, - в результате протекания окислительно – восстановительных реакций на межфазной границе за счет перехода электронов через нее. (Раньше назывался окислительно – восстановительным)
- Диффузионный потенциал возникает на границе раздела двух различных растворов в результате направленного перехода ионов через границу раздела с разной скоростью.
- Мембранный потенциал возникает на мембране с избирательной проницаемостью, разделяющей два различных раствора, в результате направленного перехода ионов через эту мембрану.
Потенциалопределяющими ионами называют ионы, переход которых через границу раздела приводит к возникновении на ней двойного электрического слоя.
Электродом, или полуэлементом, называется система, состоящая из двух контактирующих разнородных проводников – электронного (металл) и ионного (раствор электролита), на межфазной границе между которыми возникает двойной электрический слой, характеризующийся определенным значением потенциала 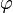 .
.
Факторы, влияющие на его величину:
1) Природа металла (энергии его кристаллической решетки, энергии ионизации атомов металла и энергии гидратации его катионов);
2) Активности (эффективной концентрации) потенциалопределяющих ионов в растворе;
3) Температуры раствора.
Стандартным электродным потенциалом называется потенциал, возникающий на границе металл – раствора при активности потенциалопределяющих ионов в растворе 1 моль/л и температуре 298 К. абсолютное значение стандартного электродного потенциала отдельно взятого электрода измерить или рассчитать невозможно, но можно определить его значение относительно какого – либо электрода, выбранного в качестве эталона. Согласно Международному соглашению таким эталоном служит стандартным однородный электрод.
Уравнение Нернста.
Значение электродного потенциала, возникающего на границе металл – раствор, зависит от природы металла, активности его ионов в растворе и от температуры. Влияние всех перечисленных факторов на величину электродного потенциала металла выражается уравнением Неранста:
 Потенциометрией называется физико – химический метод анализа, позволяющий определять активности (концентрации) ионов на основании измерения ЭДС гальванической цепи, состоящей из электрода сравнений и электрода определения, опущенных в исследуемый раствор.
Потенциометрией называется физико – химический метод анализа, позволяющий определять активности (концентрации) ионов на основании измерения ЭДС гальванической цепи, состоящей из электрода сравнений и электрода определения, опущенных в исследуемый раствор.
Электродов сравнения называется электрод, потенциал которого практически постоянен, легко воспроизводим и не зависит от протекания побочных реакций.
Стандартный водородный электрод – общепринятый электрод для сравнения. Потенциал его условно принят за ноль при любой температуре.
Электродом определения называется электрод, потенциал которого зависит от активности (концентрации) анализируемых ионов и практически не зависит от содержания других ионов в растворе.
Электродами определения являются ионоселективные электроды, среди которых наибольшее применении находят стеклянные электроды.
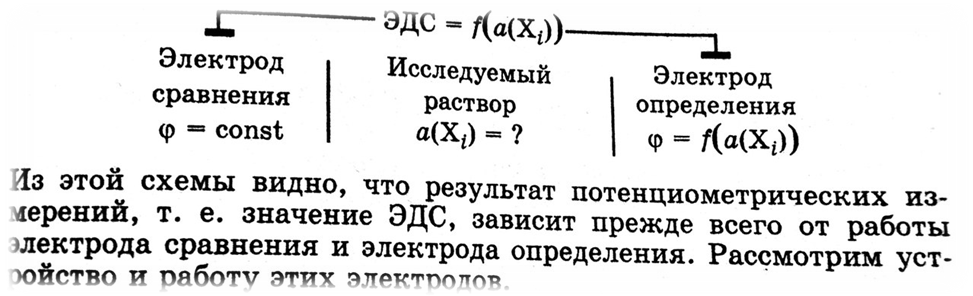
Учебник: 652 – 656, 670 – 671.
2) Гальванические цепи, их устройства и работа. Концентрационные гальванические цепи.
Гальваническая цепь – это замкнутая система, состоящая из двух электродов, соединённых между собой внешней цепью – электронный проводник (металл) и внутренней цепью – ионный проводник (растворы электролита, соединенные солевым мостиком). В гальванической цепи происходит превращение химической энергии процессов окисления в восстановления в электрическую энергию в гальванической цепи различают: Анод и Катод.
Анодом в электрохимии называется электрод, на котором протекает реакции окисления, т.е. отдача электронов. В гальванической цепи анод заряжен отрицательно, и он посылает электроны во внешнюю цепь. Анодом всегда является электрод, материл которого легче окисляется, например, более активный металл. В отличие от анода, анодный раствор из-за накопления в нем избытка катионов заряжается положительно.
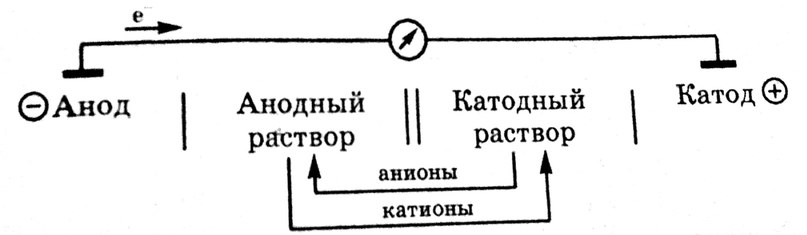 Катодом в электрохимии называется электрод, на котором протекает реакция восстановления, т.е. присоединение электронов. В гальванической цепи катод заряжен положительно, и он получает электроны из внешней цепи. Катодом является электрод из менее активного металла, катионы которого легче восстанавливаются. В отличие от катода, катодный раствор в гальванической цепи заряжается отрицательно из-за накопления в нем анионов.
Катодом в электрохимии называется электрод, на котором протекает реакция восстановления, т.е. присоединение электронов. В гальванической цепи катод заряжен положительно, и он получает электроны из внешней цепи. Катодом является электрод из менее активного металла, катионы которого легче восстанавливаются. В отличие от катода, катодный раствор в гальванической цепи заряжается отрицательно из-за накопления в нем анионов.
При замыкании гальванической цепи в ней из-за приостановленного разделения реакций окисления (анод) и восстановления (катод) происходит направленное движение электронов от анода к катоду во внешней цепи, а ионов – по внутренней цепи (электролитическому мостику). Вследствие возникновения направленного движения заряженных частиц в гальванической цепи имеет место превращение химической энергии окислительно – восстановительных реакций в электрическую. Таким образом, гальванические цепи могут быть химическими источниками тока.
Концентрационные гальванические цепи. В этих цепях материал электродов одинаковый, но они опущены в растворы с различной концентрацией потенциалопределяющих ионов. В концентрационных гальванических цепях анодом будет тот электрод, который опущен в раствор с меньшей концентрацией соли, а катодом – электрод, опущенный в раствор с большей концентрацией соли. ЭДС концентрационной гальванической цепи равна:
E = 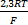 ln
ln 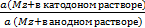 .
.
Концентрационные гальванические цепи широко используется для определения эффективной концентрации (активности) ионов в растворах, а также растворимости малорастворимых электролитов.
Учебник: 656 – 661.
3) Окислительно – восстановительные электроды. Их устройство. Стандартные значение потенциалов, сопряженных окислительно – восстановительных пар. Уравнение Нернста – Петерса. Понятия об условном восстановительном потенциале водорода и кислорода в живом организме.
Окислительно-восстановительный электрод - это электрод, состоящий из инертного материала (металлические платина, золото, вольфрам, титан, а также графит), погруженного в водный раствор, в котором имеются окисленная и восстановленная формы данного вещества.
Стандартным восстановительным потенциалом φ(ок, восст) называется потенциал окислительно – восстановительного электрода, возникающий на платине при стандартных условиях: T = 298 K, p=10133 Па и активностях окисленной и восстановленной форм в растворе, равных 1 моль/л.
Величина стандартного восстановительного потенциала является мерой окислительной способности сопряженной окислительно – восстановительной пары. Чем больше φ(ок, восст), тем сильнее выражена у окисленной формы данной пары способность присоединять электроны, т.е. способность восстанавливаться.
Если восстановительный потенциал системы имеет положительное значение, то в этой системе сильнее выражены окислительные свойства, а если отрицательное, то преобладают восстановительные свойства относительно системы H+, 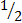 H2. При взаимодействии двух сопряженных окислительно – восстановительных систем окислителем всегда является та система, восстановительный потенциал которой больше.
H2. При взаимодействии двух сопряженных окислительно – восстановительных систем окислителем всегда является та система, восстановительный потенциал которой больше.
При нестандартных условиях значение восстановительного потенциала с учетом влияния природы окислительно – восстановительной пары, температуры и активности компонентов в растворе вычисляют по уравнению Нернста – Петерса:
φ(ок, восст) = φ(ок, восст)+ 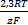 ln
ln 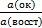 .
.
Учебник: 661-664.
4) Диффузионный и мембранные потенциалы. Причины их возникновения, факторы, влияющие на их величину. Потенциал покоя и потенциал действия. Регистрация мембранных потенциалов.
Диффузионным потенциалом называется потенциал, возникающий на границе раздела двух растворов, содержащих один и тот же электролит различной концентрации, или двух растворов разных электролитов вследствие различия в подвижности их катионов и анионов.
C1(HCl) >C2(HCl).
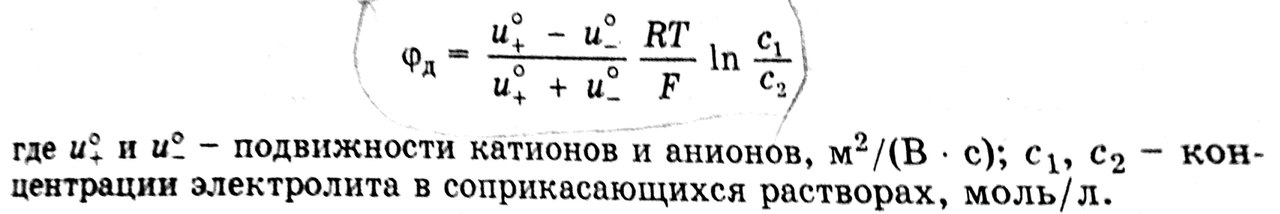 При соприкосновении растворов H+ и Cl- из более концентрированного раствора благодаря диффузии будут перемещаться в разбавленный раствор. Подвижность H+ больше. В разбавленный раствор в единицу времени ионов H+ переместится больше, чем ионов Cl-. В результате этого в разбавленном растворе на границе раздела зарядится положительно за счет более быстрых ионов H+, а концентрированный раствор – отрицательно за счет медленных ионов Cl-. Образуется ДЭС.
При соприкосновении растворов H+ и Cl- из более концентрированного раствора благодаря диффузии будут перемещаться в разбавленный раствор. Подвижность H+ больше. В разбавленный раствор в единицу времени ионов H+ переместится больше, чем ионов Cl-. В результате этого в разбавленном растворе на границе раздела зарядится положительно за счет более быстрых ионов H+, а концентрированный раствор – отрицательно за счет медленных ионов Cl-. Образуется ДЭС.
В биологических системах диффузионный потенциал проявляется при механическом повреждении клеток. Из места повреждения ионы перемещаются в межклеточную жидкость, в результате возникает диффузионный потенциал.
Мембранным потенциалом называется потенциал, возникающий между сторонами мембраны с избирательной проницаемость, разделяющей два раствора различного состава.
Величину мембранного потенциала можно определить, составив гальваническую цепь, в которой в растворы, разделенные мембраной с избирательной проницаемостью, опущены два электрода сравнения:
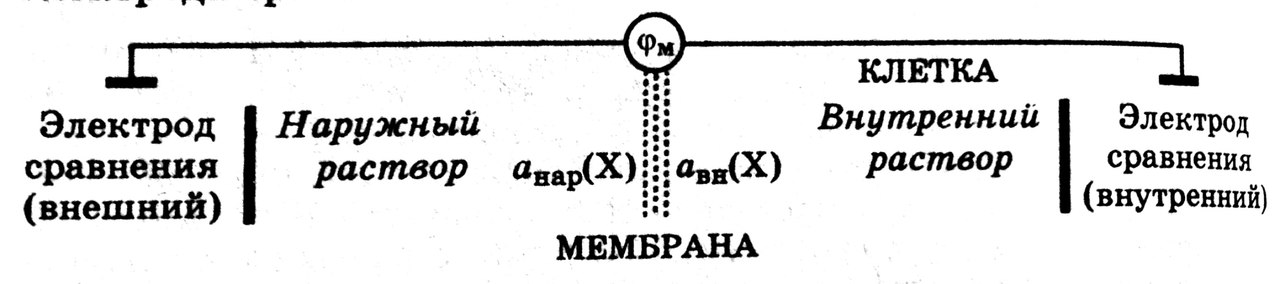 ЭДС такой гальванической цепи характеризует величину мембранного потенциала.
ЭДС такой гальванической цепи характеризует величину мембранного потенциала.
Мембранный потенциал зависит от отношения активностей ионов в растворах, разделенных мембраной, и от свойств мембраны.
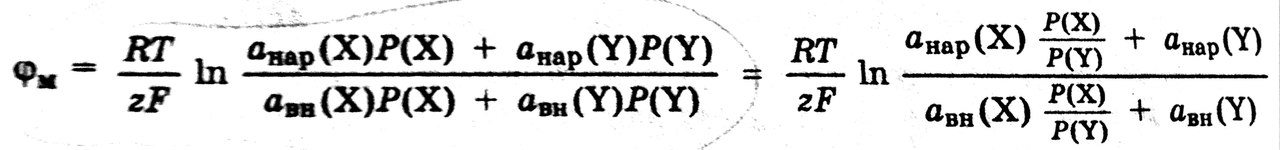 Потенциалом покоя называется мембранный потенциал, возникающий между внутренней и наружной сторонами клеточной мембраны, находящейся в невозбужденном состоянии.
Потенциалом покоя называется мембранный потенциал, возникающий между внутренней и наружной сторонами клеточной мембраны, находящейся в невозбужденном состоянии.
Определить потенциал покоя можно с помощью двух микроэлектродов сравнения, вводимых внутрь клетки и в наружный раствор. (-70 – 90)
При раздражение клетки химическим, электрическим или механическим воздействием она переходит в возбужденное состояние, при этом проницаемость ее мембраны для ионов Na+ становится значительно выше. Чем для K+. Поэтому ионы Na+ из наружного раствора, где их концентрация в 9 раз выше, чем внутри клетки, устремляются через клеточную мембрану во внутренний раствор. Ионы Na+ переносят положительный заряд с наружной поверхности мембраны и перезаряжает ее внутреннюю поверхность, меняя знак заряда с «-» на «+» и вызывая быструю деполяризацию мембрану. После прекращения возбуждения мембрана вновь становится проницаемой для ионов K+ и непроницаемой для Na+. Ионы K+ опять выходят из клетки в соответствии с градиентом концентрации, унося с собой положительный заряд до тех пор, пока на мембране не восстановится потенциал покоя, т.е. не произойдет реполяризация мембраны.
Потенциалом действия называется амплитуда (120-140 мВ) колебания (деполяризация и реполяризация) мембранного потенциала, возникающая при возбуждении клеточной мембраны.
Не только K+Na+, но и Ca2+, Cl-, H+ и других ионов.
Генерирование мембранного потенциала связано с работой сердца, мозга, мышц. Электрические потенциалы, возникающие при деятельности сердца, можно регистрировать с помощью электрокардиографа на электрокардиограмме. ЭКГ – важнейшая характеристика сердечной деятельности. Биоэлектрические потенциалы мозга регистрируются на электроэнцефалограмме, мышц – на электромиограмме, желудка – на электрогастрограмме и т.д.
Учебник: 664 – 670.



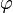 .
. Потенциометрией называется физико – химический метод анализа, позволяющий определять активности (концентрации) ионов на основании измерения ЭДС гальванической цепи, состоящей из электрода сравнений и электрода определения, опущенных в исследуемый раствор.
Потенциометрией называется физико – химический метод анализа, позволяющий определять активности (концентрации) ионов на основании измерения ЭДС гальванической цепи, состоящей из электрода сравнений и электрода определения, опущенных в исследуемый раствор.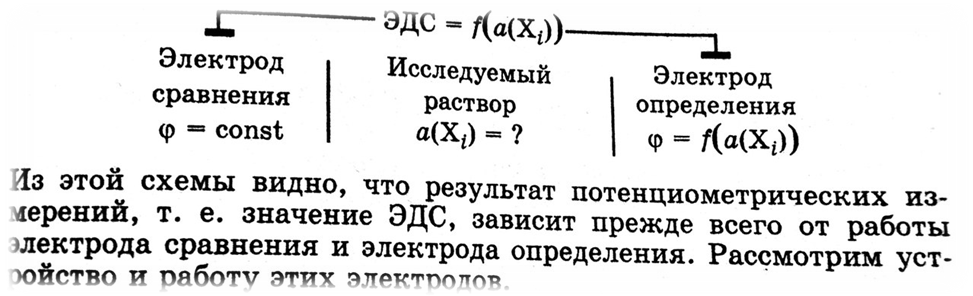
 Катодом в электрохимии называется электрод, на котором протекает реакция восстановления, т.е. присоединение электронов. В гальванической цепи катод заряжен положительно, и он получает электроны из внешней цепи. Катодом является электрод из менее активного металла, катионы которого легче восстанавливаются. В отличие от катода, катодный раствор в гальванической цепи заряжается отрицательно из-за накопления в нем анионов.
Катодом в электрохимии называется электрод, на котором протекает реакция восстановления, т.е. присоединение электронов. В гальванической цепи катод заряжен положительно, и он получает электроны из внешней цепи. Катодом является электрод из менее активного металла, катионы которого легче восстанавливаются. В отличие от катода, катодный раствор в гальванической цепи заряжается отрицательно из-за накопления в нем анионов.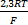 ln
ln 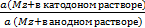 .
. H2. При взаимодействии двух сопряженных окислительно – восстановительных систем окислителем всегда является та система, восстановительный потенциал которой больше.
H2. При взаимодействии двух сопряженных окислительно – восстановительных систем окислителем всегда является та система, восстановительный потенциал которой больше.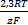 ln
ln 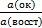 .
.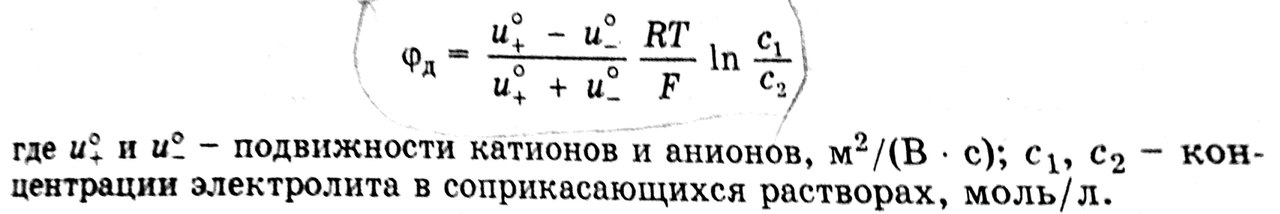 При соприкосновении растворов H+ и Cl- из более концентрированного раствора благодаря диффузии будут перемещаться в разбавленный раствор. Подвижность H+ больше. В разбавленный раствор в единицу времени ионов H+ переместится больше, чем ионов Cl-. В результате этого в разбавленном растворе на границе раздела зарядится положительно за счет более быстрых ионов H+, а концентрированный раствор – отрицательно за счет медленных ионов Cl-. Образуется ДЭС.
При соприкосновении растворов H+ и Cl- из более концентрированного раствора благодаря диффузии будут перемещаться в разбавленный раствор. Подвижность H+ больше. В разбавленный раствор в единицу времени ионов H+ переместится больше, чем ионов Cl-. В результате этого в разбавленном растворе на границе раздела зарядится положительно за счет более быстрых ионов H+, а концентрированный раствор – отрицательно за счет медленных ионов Cl-. Образуется ДЭС. ЭДС такой гальванической цепи характеризует величину мембранного потенциала.
ЭДС такой гальванической цепи характеризует величину мембранного потенциала.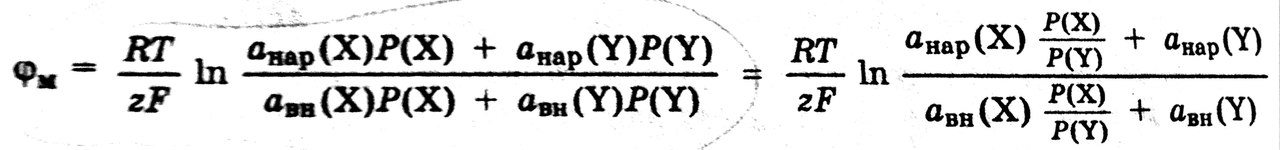 Потенциалом покоя называется мембранный потенциал, возникающий между внутренней и наружной сторонами клеточной мембраны, находящейся в невозбужденном состоянии.
Потенциалом покоя называется мембранный потенциал, возникающий между внутренней и наружной сторонами клеточной мембраны, находящейся в невозбужденном состоянии.


