1) Растворы сильных электролитов. Особенности процессов диссоциации. Расчет активности ионов в растворах сильных электролитов. Экспериментальное определение активности ионов в растворах сильных электролитов. Ионная сила растворов NaCl (0,15М) и KCl (0,146 M). Влияние ионной силы этих электролитов на процессы диссоциации слабых электролитов.
В водных растворах сильные электролиты (например, HCl, NaCl, KOH) полностью диссоциированы, причем гидратированные ионы, образующиеся при их диссоциации, обычно не ассоциируются в молекулы.
HCl à H++ Cl-
NaCl à Na++Cl-
Диссоциация сильных электролитов необратима, следовательно, значение константы диссоциации будет зависеть от концентрации раствора.
Активность иона a (X i) – эффективная концентрация иона Xi, соответственно которой он участвует во взаимодействиях, протекающих в растворах сильных электролитов.
a(Xi) = y(Xi)c(Xi)
Коэффициент активности иона y (X i) показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита.
Гилберт Ньютон Льюис в 1907 году ввел понятие ионной силы раствора электролита.
Ионная сила раствора – величина, характеризующая интенсивность электростатического поля всех ионов в растворе, которая равна полусумме произведений молярной концентрации (ci) каждого иона на квадрат его заряда (zi).
I= 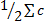 izi2
izi2
I=  (0,15 * 12) + (0,15 * 12) = 0,15 моль/л.
(0,15 * 12) + (0,15 * 12) = 0,15 моль/л.
I=  (0,146 * 12) + (0,146 * 12) = 0,146 моль/л.
(0,146 * 12) + (0,146 * 12) = 0,146 моль/л.
Учебник: 159 – 162.
2) Вода как слабый электролит. Константа диссоциации и ионное произведение воды. Водородный показатель как единица измерения кислотности водных растворов биологических сред. Способы расчет и экспериментального определения кислотности среды в единицах pH.
Вода является очень слабым электролитом. Ее электролитическая диссоциации выражается равновесием:
H2O + H2O⇌ H3O++ OH- или упрощенно H2O⇌ H+ + OH-
Ka = 1,82*10-16
Это означает, что из 5,6 * 108 молекул воды диссоциирована на ионы только одна. Следовательно, равновесную концентрацию недиссоциированной воды можно считать равной ее исходной молярной концентрации, т.е. числу молей H2O в 1 л воды: [H2O] = 1000/18 = 55,56 моль/л = const. Объединив две постоянные величина Ka и [H2O], получим новую постоянную, которая называется ионным произведением воды KH2O.
KH2O=Ka[H2O] = [H+][OH-] = const.
Ионное произведение воды KH 2 O – величина постоянная (при данной температуре) для воды и любых водных растворов, равная произведению концентрации ионов водорода [H+] и гидроксид-ионов [OH-].
KH2O= [H+][OH-] = Ka[H2O] =1,82 * 10-16 * 55,56 = 1,0 * 10-14
Для удобства оценки характера водный среды используют безразмерную величину – водородный показатель pH.
Водородный показатель – количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода в растворе:
pH = - lg [H+]
pH + pOH = 14
в Нейтральной среде pH=7,0
в Кислой среде pH< 7,0
в Основной среде pH> 7,0
При вычислении pH раствора сильной кислоты или сильного основания необходимо знать молярную концентрацию эквивалента данного веществ и коэффициент активности соответствующего иона (y(H+) или y(OH-)) в заданном растворе. Для расчетом пользуют следующие уравнения:
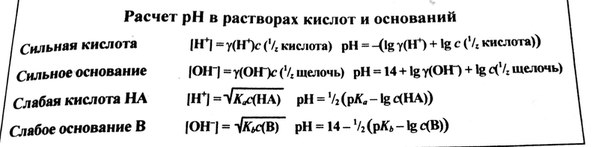
Учебник: 162 – 165.



 izi2
izi2 (0,15 * 12) + (0,15 * 12) = 0,15 моль/л.
(0,15 * 12) + (0,15 * 12) = 0,15 моль/л.