

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...
Топ:
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Интересное:
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
1) Свободная поверхностная энергия. Причины ее возникновения и факторы, влияющие на ее величину. Удельная свободная поверхностная энергия. Зависимость ее от природы межфазных границ и от температуры. Термодинамическое условие самопроизвольного протекания поверхностных явлений.
Свободной поверхностной энергией называется термодинамическая функция, характеризующая энергию межмолекулярного взаимодействия частиц на поверхности раздела фаз с частицами каждой из контактирующих фаз.
Причины возникновения: силы межмолекулярного взаимодействия молекул, расположенных на поверхности, не скомпенсированы, их равнодействующая не равна нулю и направлена в сторону жидкости, следовательно, потенциальная энергия молекул на поверхности раздела фаз выше, чем у молекул внутри фазы.
Факторы, влияющие на величину Gs: количество частиц на поверхности раздела, а потому прямо пропорциональна площади раздела фаз и удельной энергии межфазного взаимодействия: G= σ S, где σ – удельная свободная поверхностная энергия, которая характеризует энергию межфазного взаимодействия единицы площади поверхности раздела фаз, кДж/м2. S – площадь поверхности раздела фаз, м2.
Удельная свободная поверхностнаяэнергияσ равна работе образования единицы поверхности раздела и зависит от природы контактирующих фаз и температуры. Она характеризует энергию межфазного взаимодействия единицы площади поверхности раздела фаз.
Зависимость: с повышением температуры σ снижается, так как уменьшается различие в энергии межмолекулярного взаимодействия контактирующих фаз. В зависимости от агрегатного состояния контактирующих фаз различают поверхностные явления на подвижной и неподвижной поверхности раздела г – ж и ж – ж – поверхность раздела подвижна, так как частицы поверхности раздела постоянно обновляются вследствие теплового движения молекул каждой фазы. С помощью сталагмометра и другими способами можно определить данную величину.
|
|
Удельную свободную поверхностную энергию для подвижных поверхностей раздела фаз называют коэффициентом поверхностного натяжения и обозначают σ г/ж или σ ж/ж. Для полярных жидкостей вследствие более сильного межмолекулярного взаимодействия коэффициент поверхностного натяжения больше, чем для неполярных жидкостей. При критической температуре и выше, когда исчезает различие между газом, паром и жидкость, а энергия межмолекулярного взаимодействия в системе выравнивается, σ = 0. В системах г –тв или ж – тв поверхность раздела неподвижна, ее можно определить по способности твердой поверхности к смачиванию.
Термодинамическое условие – все поверхностные явления протекают самопроизвольно только тогда, когда Gs системы уменьшается. Все поверхностные явления совершаются самопроизвольно, если снижается энергия Гиббса.
Учебник: 681 – 683.
2) Сорбционные равновесия. Абсорбция. Константа абсорбционного равновесия и факторы на нее влияющие. Закон Генри. Закон Сеченова. Физико – химические основы кессонной болезни.
Сорбция – гетерогенный процесс самопроизвеольного поглощения твердым телом или жидкостью веществ из окружающей среды.
Сорбент – твердые тела или жидкости, способным поглощать веществ из окружающей среды.
Сорбат – поглощаемое вещество.
Сорбция может быть обратимой и необратимой (чаще обратимой).
При достижении и установлении состояния равновесия скорость сорбции равна скорость десорбции. Это равновесное состояние характеризуется константой сорбционного равновесия Kc обычно довольно большим временем установления равновесия
Если Kc> 1, то в основном наблюдается процесс сорбции.
|
|
Если Kc< 1, то преобладает процесс десорбции.
Абсорбцией называется самопроизвольное поглощение веществ, при котором поглощаемые вещества (абсорбаты) в результате диффузии распределятся по всему объему вещества – поглотителя (абсорбента).
Константа абсорбционного равновесия – константа распределения (Kраспр).
Kраспр = 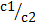 , где c1, c2 – концентрация поглощаемого вещества в абсорбенте и в окружающей среде соответственно.
, где c1, c2 – концентрация поглощаемого вещества в абсорбенте и в окружающей среде соответственно.
Факторы, влияющие на Kраспр: природа контактирующих фаз и температура.
Если поглощаемое вещество – газ, то его абсорбция сопровождается резким изменением объема системы в целом. Поэтому в соответствии с принципом Ле Шателье абсорбция газов в жидкости при увеличении давления возрастает и подчиняется закону Генри:
При постоянной температуре абсорбция газа в единице объема жидкости прямо пропорциональна парциальному давлению этого газа в газовой смеси над жидкостью.
C = kp((x), (при T = const.), где c – концентрация газа в жидкости, моль/л; p(X) – парциальное давление газа в смеси, Па или мм рт. ст.; k – константа абсорбционного равновесия.
Закон Генри позволяет понять возникновение профессиональных заболеваний у водолазов, рабочих в кессонах, летчиков, космонавтов, которые должны переходить из газовой среды с большим давлением в среду с меньшим давлением. Во время пребывания человека в среде с высоким давлением кровь и ткани насыщаются газовыми компонентами среды, а при резком понижении давления снижается растворимость абсорбированных газов в крови. В результате снижения растворимости газов из крови выделяются пузырьки этих газов, которые закупоривают капиллярные кровеносные сосуды, вызывая кессонную болезнь. При этом особенно велик вклад азота, так как его объемная доля в воздухе составляет 78%. Лучше брать газовую смесь на основе гелия. 80% гелия, 20% кислорода, так как растворимость гелия в крови почти в три раза меньше, чем азота.
Абсорбируемость газа жидкостью зависит не только от природы газа, его давления и температуры, но и от состава жидкости. Абсорбция газов в растворах электролитов подчиняется закону Сеченова:
Растворимость газов в жидкостях в присутствии электролитов понижается вследствие высаливания газов.
ln(c0/c) = kCcэл,
где c0 – растворимость газа в чистой воде
c – Растворимость газа в присутствии электролита
|
|
cэл – концентрация электролита
kс – константа Сеченова.
Учебник: 684 – 687.
3) Адсорбция, физическая и химическая, их особенности. Закономерности адсорбции газов и паров на неподвижной поверхности раздела фаз. Изотермы адсорбции. Теория Лэнгмюра. Полимолекулярная адсорбция.
Адсорбция – процесс поглощение вещества, концентрация которого происходит на поверхности раздела контактирующих фаз.
Адсорбент – компонент, на поверхности которого идет адсорбция.
Адсорбат – компонент, который концентрируется на поверхности адсорбента.
Физическая адсорбция обусловлена межмолекулярным взаимодействием за счет сил Ван-дер-Ваальса: ориентационных, индукционных и дисперсионных – или водородной связи.
Особенности: обратимость (адсорбция – десорбция), неспецифичность («подобное о подобном»), экзотермичность (выделение теплоты).
Способствует: снижение температуры, увеличение концентрации поглощаемого вещества или повышение давления в системе при адсорбции газа или пара.
Химическая адсорбция происходит при взаимодействии адсорбента с адсорбатом с образованием химической связи.
Особенности: необратима, специфична и локализована. Повышение температуры при хемосорбции приводит обычно к большему связыванию адсорбата. При любом виде адсорбции изменяются химический состав и свойства поверхности раздела фаз, причем это приводит к уменьшению удельной свободной поверхностной энергии и тем самым обеспечивает самопроизвольное протекание адсорбции.
Удельная адсорбция – это равновесное количество поглощаемого вещества, приходящееся на единицу поверхности или массы твердого адсорбента.
Г=  (моль/г)
(моль/г)
Адсорбция газов и паров на твердых адсорбентах является число поверхностным процессом, который заключается во взаимодействии молекул адсорбента с поверхностью адсорбента за счет сил Ван-дер-Ваальса и водородных связей.
Количество поглощенного газа или пара твердым адсорбентом в результате адсорбции зависит от следующих факторов:
- Природы и площади поверхности адсорбента;
- Природы поглощаемого газа или пара;
- Концентрации или давления газа или пара;
|
|
- Температуры;
Адсорбция газов и паров на твердых адсорбентах зависит прежде всего от свободной поверхностной энергии, которая весьма велика для адсорбентов с аморфной структурой (активированный уголь) на выступах, впадинах и в капиллярах, а для кристаллических (оксиды кремния, алюминия) – на ребрах, углах и в трещинах кристаллов. Поэтому адсорбент тем эффективней, чем мельче измельчен и чем выше его пористость. Важной характеристикой твердых адсорбентов является удельная поверхность Sуд (м2/г). в зависимости от природы адсорбенты подразделяются на неполярные (гидрофобные) – сажа, активированный уголь, тальк (3MgO * H2O *4SiO2), фторопласт – и полярные (гидрофильные) – силикагель ((SiO2)n), алюмогель ((Al2O3)n), глины, цеолиты.
Адсорбируемость газа или пара определяется его сродством к поверхности адсорбента. Полярные вещества лучше адсорбируются на полярных адсорбентах, а неполярные – на неполярных адсорбентах. При этом, чем больше адсорбат склонен к межмолекулярным взаимодействиям, тем лучше он адсорбируется.
При физической адсорбции из смеси газов или паров лучше адсобируется тот компонент, который легче сжимается, поскольку его молекулы более склонны к межмолекулярным взаимодействиям.
Влияние концентрации (или давления) газов или паров на процесс адсорбции имеет сложный характер. Одновременно с адсорбцией протекает десорбция адсорбированных молекул в газовую фазу. При равенстве скоростей этих процессов наступает адсорбционное равновесие.
Скорость адсорбции на легкодоступной поверхности больше, а в порах пористых адсорбентом – меньше, причем чем тоньше поры адсорбентам, тем меньше скорости адсорбции.
Графическая зависимость удельной адсорбции Г от концентрации поглощаемого вещества в системе при постоянной температуре называется изотермой адсорбции.
Теория Ленгмюра. Основные положения:
- Адсорбция молекул происходит не на всей поверхности адсорбента, а только на адсорбционных центрах (вершины неровностей и узкие поры), где имеются участки с наиболее нескомпенсированными силовыми полями, т.е. Gsàmax.
- Каждый адсорбционный центр может удерживать только одну молекулу адсорбата, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что и приводит к образованию мономолекулярного слоя поглощаемого вещества.
- Процесс адсорбции обратим и носит динамический характер, так как адсорбированные молекулы удерживаются адсорбционными центрами только в течение определенного промежутка времени, после чего происходит десорбция этих молекул и адсорбция того же числа новых молекул.
При больших концентрациях адсорбата в системе на изотерме адсорбции после участка, соответствующего насыщению поверхности, обычно наблюдается резкое увеличении удельной адсорбции. Это происходит из-за перехода от мономолекулярной адсорбции к полимолекулярной вследствие взаимодействия между адсорбированными молекулами и наслаивания их друг на друга. Для пористых адсорбентов полимолекулярная адсорбция наблюдается при адсорбции паров, сопровождающейся их капиллярной конденсацией. Сначала пар адсорбируется в порах, а затем конденсируется в жидкость, заполняя самые тонки капилляры с образованием вогнутого мениска.
|
|
Учебник: 688 – 692.
4) Молекулярная адсорбция из растворов на твердых адсорбентах. Факторы, влияющие на этот процесс. Основные правила молекулярной адсорбции из растворов (Шилова и Ребиндера). Выбора эффективного адсорбента. Понятие о лимфосорбции и гемосорбции.
Существенное отличие адсорбции веществ из раствора от адсорбции из газовой фазы заключается в конкуренции между растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. Молекулярная адсорбция зависит от следующих факторов:
1) Природы адсорбента;
2) Природы растворителя;
3) Природы поглощаемого вещества (адсорбата);
4) Концентрации раствора;
5) Температуры.
Влияние природы адсорбента на процесс молекулярной адсорбции из раствора определяется, как и в случае адсорбции газов, удельной поверхностью адсорбента и его сродством к поглощаемому веществу. Гидрофильные адсорбенты (силикагель, глины, пористые стекла) хорошо поглощают полярные вещества, а гидрофобные (сажа, активированный уголь) – неполярные вещества.
Природа растворителя должна сильно отличаться от природы растворенного вещества и природы адсорбента. Только в этом случае адсорбция вещества из раствора будет эффективной. Другими словами: чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества.
Влияние природы поглощаемого вещества определяется несколькими правилами. Во-первых, правилом «подобное взаимодействует с подобным», которое указывает на необходимость сродства между адсорбируемым веществом и адсорбентом. Во-вторых, правилом Николая Александровича Шилова: «Чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента». В-третьих, правилом выравнивания полярностей контактирующих фаз, сформулированными Петром Александровичем Ребиндером: «на поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причем с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает».
Поэтому эффективней всего адсорбируются вещества, молекулы которых дифильны (головастик).
Влияние концентрации растворенного вещества на процесс его адсорбции из раствора при постоянной температуре также описывается уравнением Ленгмюра.
При повышении температуры адсорбция веществ из растворов обычно уменьшается.
При отравлениях используется активированный уголь, способный адсорбировать газы, алкалоиды, барбитураты, токсины из пищеварительной системы. Одна таблетка активированного угля массой 0,25 г имеет адсорбционную поверхность около 100 м2. С его помощью осуществляют также сорбционную детоксикацию крови и лимфы больного путем перфузии (пропуская их через активированный уголь). При гемосорбции и лимфосорбции биологические системы очищаются от барбитуратов, дихлорэтана, фосфорорганических соединений, алкалоидов и токсинов.
Учебник: 692 – 694.
5) Закономерности ионной адсорбции. Ионная избирательная адсорбция. Правило Панета – Фаянса - Пескова. Особенности ионной – обменной адсорбции катиониты и аниониты. Применение ионно – обменных смол для очистки жидких сред от электролитов.
В зависимости от природы адсорбента процессы адсорбции ионов электролитов подразделяются на ионную адсорбцию и ионообменную адсорбцию.
Ионная адсорбция заключатся в адсорбции ионов из растворов электролитов на поверхности твердых веществ, кристаллическая решетка которых состоит из ионов или полярных молекул, т.е. на полярных адсорбентах. Ионная адсорбция имеет ряд характерных особенностей:
1) При ионной адсорбции на поверхности адсорбента вследствие адсорбции ионов, называемых потенциалопределяющими, возникает определённый заряд, который притягивает из раствора противоположно заряженные ионы – противоионы; в результате на границе раздела фаз возникает двойной электрический слой (ДЭС).
2) Скорость ионной адсорбции меньше скорости молекулярной адсорбции
3) Ионная адсорбция не всегда обратима, так как может сопровождаться хемосорбцией, приводящей, например, к образованию малорастворимого вещества.
4) Адсорбируемость ионов определяется величиной их заряда, радиуса и степенью сольватации. При равенстве заряда лучше адсорбируются ионы с большим радиусом, так как они менее сольватированы. По величине адсорбции ионы располагаются в так называемые лиотропные ряда, которые для водных систем выглядят так:
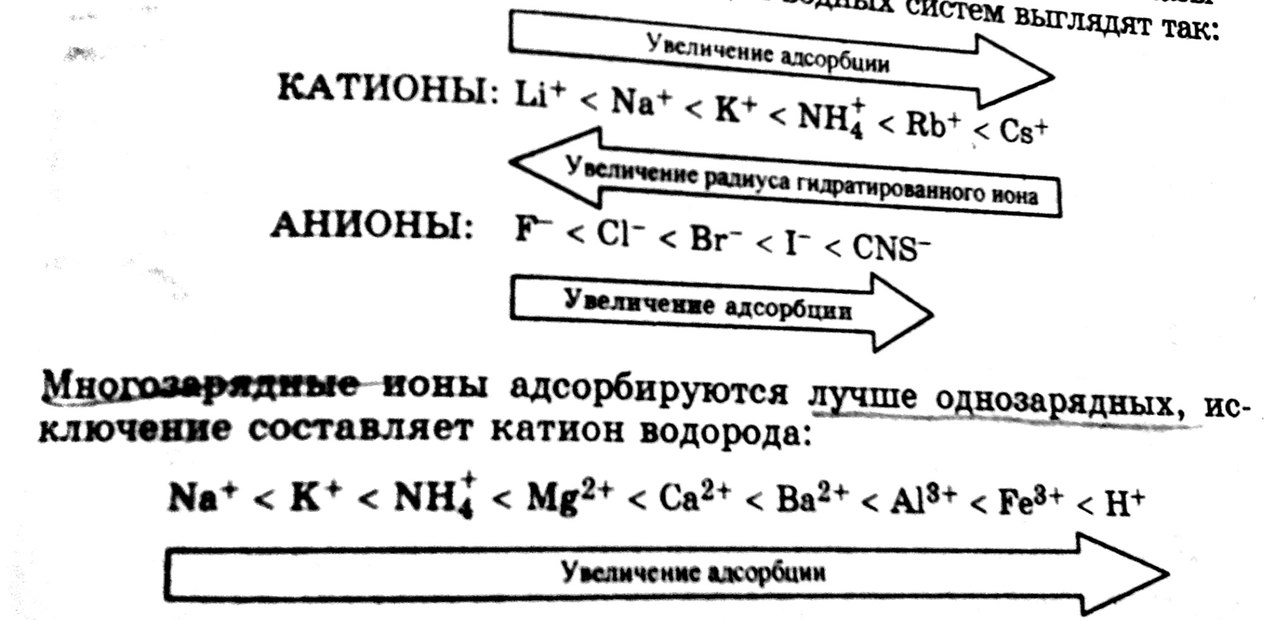
5) Если в растворе электролита имеются такие же ионы, как и в составе твердого адсорбента, то ионная адсорбция принимает строго избирательный характер, описываемый правило Панета – Фаянса – Пескова об избирательной ионной адсорбции: «На поверхности кристалла, преимущественно адсорбируются те ионы, которые входят в состав кристаллической решетки адсорбента или изоморфны им по строению и могут достроить кристаллическую решетку».
Следовательно, потенциалопределяющие ионы, внедряясь в кристаллическую структуру, в результате избирательной адсорбции сообщают соответствующий заряд поверхности кристалла, а противоионы нейтрализуют этот заряд, оставаясь в растворе. Избирательная ионная адсорбция имеет место при формировании кристаллической решетки электролитов и способствует очистке таких веществ путем перекристаллизации.
Ионообменная адсорбция протекает только на тех адсорбентах, которые являются практически нерастворимыми полиэлектролитами.
Ионообменной адсорбцией называется процесс эквивалентного обмена собственных ионов нерастворимого адсорбента, посылаемых в раствор, на другие ионы того же знака, находящиеся в растворе.
Адсорбенты, способные к обмену ионов с раствором, называют ионитами. Иониты подразделяются на катиониты и аниониты.
Катиониты представляют собой нерастворимые многоосновные полимерные кислоты, способные к обмены катионов H+. В них катион водорода при адсорбции замещается на катион металла. В общем виде: [Кат]Hn⇌ [Kat]n- + nH+.
Катиониты широко применяются для уменьшения жесткости воды путем связывания катионов кальция и магния, содержащихся в природных водах.
Аниониты представляют собой нерастворимые многокислотные полимеры основания, способные к обмену анионов:
[An](OH)n + nCl-⇌ [An]Cln + nOH-.
Катиониты и аниониты можно использовать неоднократно. (Катиониты обрабатывают кислотой, переводя их в H+ форму, а аниониты – раствором щелочи, переводя из в OH- форму).
Учебник: 694 – 697.
6) Адсорбция на подвижной поверхности раздела фаз. Уравнение Гиббса. ПАВ, их классификация, особенности строения. Правило Дюкло – Траубе. Адсорбция ПАВ на границе раздела двух жидкостей.
 Адсорбция растворенных веществ на поверхности жидких адсорбентов описывается уравнением Гиббса, отражающим зависимость между концентрацией вещества на единице поверхности раздела фаз и концентрацией его в объеме раствора:
Адсорбция растворенных веществ на поверхности жидких адсорбентов описывается уравнением Гиббса, отражающим зависимость между концентрацией вещества на единице поверхности раздела фаз и концентрацией его в объеме раствора:
Величина d σ /dc, называемая поверхностной активностью, служит характеристикой поведения растворенного вещества при его адсорбции поверхностью раздела. Поверхностная активность может быть положительной или отрицательной. Если с увеличением концентрации вещества удельное поверхностное натяжение на границе раздела фаз понижается, т.е. d σ /dc< 0, то такое вещество называют поверхностно – активным (ПАВ). В этом случае адсорбция растворенного вещества положительна (Г > 0); это означает, что концентрация растворенного вещества в поверхностном слое больше, чем в объеме раствора.
Вещества, повышающие удельное поверхностное натяжение на границе раздела фаз с увеличением концентрации, называют поверхностно – инактивными (ПИВ, для них d σ /dc> 0 а адсорбция отрицательна (Г < 0).
 Молекулы ПАВ имеют асимметричное строение, так как содержат два четко выраженных фрагмента: гидрофобный (неполярный) и гидрофильный (полярный), т.е. их структура дифильна. В зависимости от характера полярной группы различают три вида ПАВ:
Молекулы ПАВ имеют асимметричное строение, так как содержат два четко выраженных фрагмента: гидрофобный (неполярный) и гидрофильный (полярный), т.е. их структура дифильна. В зависимости от характера полярной группы различают три вида ПАВ:
У дифильных молекул с короткой углеводородной цепью и эффективной полярной головкой преобладают гидрофильные свойства, и поэтому такие вещества хорошо растворимы в воде, например, CH3OH, CH3COOH, C2H5OH. С удлинением углеводородной цепи усиливаются гидрофобные свойства молекул и понижается растворимость веществ в воде, при этом молекулы вытесняются на поверхность, снижая поверхностное натяжение.
Влияние природы ПАВ на их поверхностную активность описывает правилом Дюкло – Траубе: «Поверхностная активность ПАВ в разбавленных водных растворах при одинаковой молярной концентрации увеличивается в 3-3,5 раза при удлинении гидрофобной части на одну метиленовую группу (-CH2-).
В зависимости от поверхностной активности молекул ПАВ отличие в их поведении на границе раздела фаз особенно четко проявляется на границе раздела двух несмешивающихся жидкостей. Жидкости, резко отличающиеся по полярности, например, вода и масло (машинное или растительное), при смешивании всегда расслоятся с образованием границы раздела между ними. Если в эту систему ввести водорастворимое ПАВ, то его молекулы своей полярной, гидрофильной частью будут ориентированы к воде, а гидрофобной – к маслу (неполярной жидкости).
Учебник: 697 – 702.
|
|
|

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!