1) Особенности строения молекулы воды и особенности жидкого состояния воды, ее уникальные физико – химические свойства и ее роль в жизнедеятельности организма. Вода – растворитель газообразных, жидких и твердых веществ.
Большая роль воды в живой природе связана с рядом уникальных ее свойств, благодаря которым вода является средой, растворителем и метаболитом для живых организмов. Вследствие высокой теплоемкости (75,3 Дж/(моль * К)) и большой теплоты испарения (40,8 кДж/моль) вода обеспечивает термостатирование нашего организма. Высокая диэлектрическая проницаемость воды (ԑ=78,5) способствует растворению солей, кислот, основания и их диссоциации на ионы, так как сила электростатического взаимодействия между ионами обратно пропорциональна диэлектрической проницаемости среды.
Высокий дипольный момент молекулы воды (1,82 Д) и способность образовывать четыре водородные связи: две – как донор протонов и две – как акцептор протонов, не только увеличивают растворяющую способность воды по отношению к полярным веществам, но и благоприятствуют формированию определенных структур водных ассоциатов в самой воде, а также у молекул биополимеров в водных растворах. Перечисленные особенности воды и ее низкая вязкость (0,001 Па * с при 293 К) способствуют выполнению ею транспортных функций.
Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений
Наличие в воде различных ассоциатов, имеющих разную структуру и разное время жизни, позволяет обосновать еще одну особенность воды – структурно – информационную память.
Вода – амфолит.
В зависимости от сродства к воде функциональные группы подразделяют на гидрофильные и гидрофобные. К гидрофильным относятся ионы и полярные группы: гидроксильная, амино, карбоксильная, нитро, фосфатная, сульфо. К гидрофобным относятся неполярные группы: углеводородные радикалы предельных и непредельных и ароматических соединений.
Вода является лучшим растворителем для твердых, жидких и газообразных веществ. Мы привыкли к тому, что вода свободно растворяет соли и сахар, и никто этому не удивляется. А что вода растворяет металл, или вместо гниения мертвой органики происходит на самом деле ее растворение - никто над этим даже не задумывается. А ведь все происходит именно так!
Сверхтонкие частицы фемтополя воды, имея высокий энергетический уровень, проникают в твердое пространство и, благодаря отталкивающим силам, возникающим при взаимодействии полей, разрушают его - растворяют. Так, проникая например, в черный металл, частицы фемтополя воды вызывают постепенное разрушение верхнего слоя, а затем происходит его окисление.
В живом организме фемтополе свободной (капиллярной) влаги, взаимодействуя с энергетикой клеток, продвигает по капиллярам питательную среду и обеспечивает биохимический процесс. В мертвой же органике с прекращением биохимического процесса фемтополе внешней влаги, а потом и капиллярной, начинает разрушать клетки - растворять первичную органическую материю клетки проникновением частиц фемтополя воды. Начинается процесс, который принято называть гниением.
Достаточно прекратить доступ внешней и капиллярной влаги к клеткам мертвой органики, как процесс их растворения прекращается. Для длительного сохранения органики необходимо кроме изоляции ее от внешней влаги, удалить полностью капиллярную гигроскопическую воду.
Учебник: 125-134.
2) Понятие о диффузии. Осмос. Осмотическое давление и факторы, влияющие на его величину. Закон Вант-Гоффа. Изотонический коэффициент, его значения для разбавленных растворов различных веществ. Сравните при одинаковой температуре и молярной концентрации осмотическое давление растворов следующих веществ:
а)NaCl, C6H12O6, CaCl2;
б)CH3COOH, KCl, C2H5OH
Диффузией в растворе называется самопроизвольный направленный процесс переноса частиц растворенного веществ и растворителя, который осуществляется при наличии градиента концентрации растворенного вещества и приводит к выравниванию концентрации этого вещества по всему объему раствора.
Осмосом называется самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью.
Осмотическим давлением (π) называют избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.
Факторы: число частиц в растворе, температура.
Закон Вант-Гоффа: «Осмотическое давление подчиняется объединенному газовому закону Менделеева – Клайперона π =icRT»
Изотонический коэффициент – для учета межмолекулярных взаимодействий в реальных растворах
i= 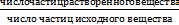
Для растворов неэлетролитов, молекулы которых не диссонируют и мало склонны к ассоциации, i = 1.
Для водных растворов электролитов вследствие диссоциации I> 1, причем максимальное его значении (Imax) для данного электролита равно числу ионов в его молекуле. NaClimax= 2, CaCl2imax=3, Na3PO4imax=4, Al2(SO4)3 = 5.
Для растворов, в которых вещество находится в виде ассоциатов, i< 1, что характерно для коллоидных растворов. Для растворов белков и ВМС величина i зависит от концентрации и природы этих веществ.
Сравните при одинаковой температуре и молярной концентрации осмотическое давление растворов следующих веществ:
а)NaCl, C6H12O6, CaCl2 (по изотоническому коэффициенту) NaCl и CaCl2 – электролиты, i для электролитов всегда > 1, следовательно, осмотическое давление электролитов NaCl и CaCl2 будет больше осмотического давления неэлетролита C6H12O6, потому что i для неэлетролитов всегда = 1. (π =icRT). Осмотическое давление CaCl2 (3) <NaCl (2) (по количеству ионов). CaCl2>NaCl>C6H12O6
б)CH3COOH, KCl, C2H5OH Осмотическое давление KCl> осмотического давления CH3COOH и C2H5OH. CH3COOH > 2, HCl = 2, C2H5OH <1. CH3COOH > HCl > C2H5OH.
Учебник: 140-142.
3) Фазовые равновесия. Диаграмма состояния воды. Давление насыщенного пара над растворами. I – ый закон Рауля. Температура кипения и кристаллизации растворов. II – ой закон Рауля, его применение к реальным системам.
Фазовые равновесия:
1) При температуре кипения в равновесии сосуществуют две фазы: жидкая и пар.
Температура кипения жидкости – это температура, при которой давление насыщенного пара над жидкостью становится равным внешнему давлению.
2) При температуре замерзания в равновесии сосуществуют три фазы: твердая, жидкая и пар.
Температура замерзания жидкости – это температура, при которой давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над кристаллами этой жидкости.
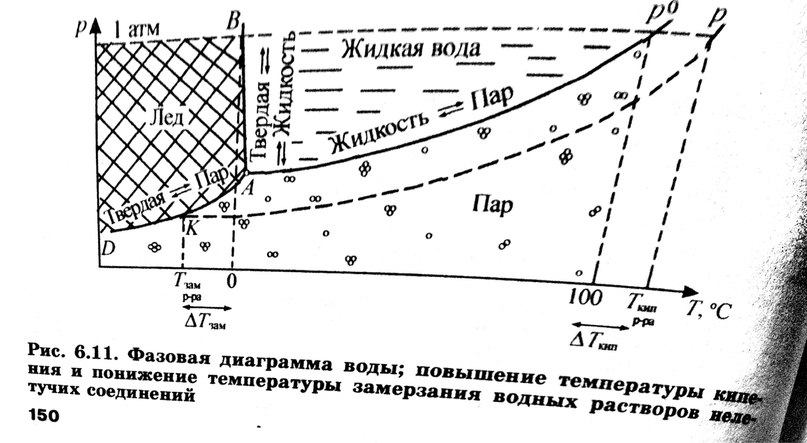
Фазовая диаграмма воды
Линия A p 0 – линия испарения, разделяющая жидкое и парообразное состояния, - определяет значение давления и температуры, при которых осуществляется кипение чистой воды.
Линия AB – линия плавление – показывает условия существования двухфазной жидкой системы лед – жидкая вода.
Линия AD – линия сублимации – разграничивает твердое и парообразное состояния воды.
В тройной точке A, отвечающей температуре замерзания воды или плавления льда при внешнем давлении, равном давлению насыщенного пара (+0,01o С; 0,006 атм), находясь в равновесии друг за другом, одновременно сосуществуют все три фазы: твердая, жидкая и парообразная.
Давление пара, при котором при данной температуре в системе «жидкость – пар» наступает динамическое равновесие, характеризующееся равенством скоростей испарений и конденсации (Uисп=Uконд), называется давлением насыщенного пара.
Франсуа Мари Рауль (1886) сформировал свой первый закон следующим образом:
«При постоянной температуре относительное понижение давления насыщенного пара растворителя над идеальным раствором нелетучего вещества равно молярной доле растворенного вещества».
(p0 – p)/p0 = n/(n+N)
Температура кипения раствора нелетучего вещества всегда выше, чем температура кипения чистого растворителя.
Температура замерзания вещества всегда ниже, чем температура замерзания чистого растворителя.
Второй закон Франсуа Мари Рауля:
«повышение температуры кипения или понижение температуры замерзания идеальных растворов нелетучих веществ прямо пропорционально моляльной концентрации раствора:
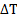 кип=Kэбb(X) (Kэб – эбулиоскопическая константа)
кип=Kэбb(X) (Kэб – эбулиоскопическая константа)
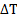 зам=Kкрb(X) (Kкр – криоскопическая константа)
зам=Kкрb(X) (Kкр – криоскопическая константа)
Для реальных растворов в формулы вводится изотонический коэффициент, так как для реальных растворов нужно учитывать межмолекулярные взаимодействия:
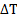 кип=iKэбb(X)
кип=iKэбb(X)
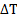 зам=iKкрb(X)
зам=iKкрb(X)
Законы Франсуа Мари Рауля используются для экспериментальных методов определения молярных масс растворимых веществ – эбулиоскопии и криоскопии основанных на измерении температуры кипения и температуре замерзания растворов этих веществ.
Учебник: 149-152.



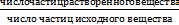

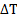 кип=Kэбb(X) (Kэб – эбулиоскопическая константа)
кип=Kэбb(X) (Kэб – эбулиоскопическая константа)

