

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Дисциплины:
|
из
5.00
|
Заказать работу |
Повышение температуры обычно приводит к резкому увеличению скорости реакции. Согласно эмпирическому правилу Вант-Гоффа, скорость большинства реакций увеличивается в среднем в 2-4 раза при повышении температуры на 100С.
Отношение констант скорости при (T + 100) и T называется температурным коэффициентом Вант-Гоффа, т.е.

Для того чтобы рассчитать величину температурного коэффициента химической реакции γ, необходимо определить скорость реакции при двух значениях температуры, отличающихся на величину D T:
 , где х =
, где х = 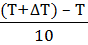
Зависимость скорости реакции от температуры описывается также уравнением Аррениуса:
 ,
,
где T - температура, К; R – универсальная газовая постоянная, Дж/моль . К, Еакт – энергия активации, Дж/моль.
Уравнение Аррениуса в экспоненциальной форме имеет вид:
k = Ae - E акт/ RT,
где А – эмпирическая постоянная, называемая предэкспоненциальным множителем и численно равная константе скорости при Т → ∞ (Еакт → 0).
Скорость реакции пропорциональна частоте столкновений между молекулами. Энергией активации реакции согласно теории активных соударений называется минимальная энергия (в расчете на 1 моль), которой должны обладать реагирующие частицы, чтобы столкновение между ними привело к взаимодействию между частицами. Частицы, энергия которых больше или равна Еакт, называются активными (реакционноспособными).
Примеры решения типовых задач
Пример 1. Рассчитайте константу скорости реакции 2NO2=2NO + O2. Данные для расчета представлены в табл. 4.
Таблица 4
Зависимость концентрации вещества от температуры
| t, 0 C | c.103, моль/л | t, 0 C | c.103, моль/л |
| 0 | 1.000 | 150 | 0.6632 |
| 60 | 0.8308 | 180 | 0.6212 |
| 120 | 0.7108 | 300 | 0.4954 |
Решение. Так как реакция 2NO2=2NO + O2 является реакцией второго порядка, константу скорости химической реакции рассчитываем по уравнению, записанного относительно времени
 , (конц.-1. время-1), (9)
, (конц.-1. время-1), (9)

Константа скорости не зависит от времени, остается примерно постоянной, Таким образом, среднее значение константы скорости k = 3,39 c-1. моль -1. л.
Пример 2. Рассчитайте время, за которое прореагирует 10 % исходного вещества в реакции 2NO2=2NO + O2.
Решение. Если к моменту времени t прореагировало 10 % исходного вещества, то не прореагировшая часть исходного вещества к этому моменту времени составляет С=0,9С0 моль/л. Подстановка полученного выражения в уравнение для данной реакции [реакции второго порядка, уравнение (9)], записанного относительно времени, позволяет рассчитать время:

Пример 3. Определите энергию активации химической реакции 2NO2=2NO +O2, используя значение констант скоростей k 1 и k 2 при двух значениях температуры Т1 и Т2 (табл.5).
Таблица 5
Эспериментальные данные
| T 1, K | k 1, л/моль . с | T 2, k | k 2, л/моль . с | T 3, K | Δ T,K |
| 656 | 7,700 | 592 | 0,844 | 667 | 25 |
Решение. Энергию активации химической реакции можно определить используя значение констант скоростей k1 и k2 при двух значениях температуры Т1 и Т2, по уравнению:

Ea кт = 8,314 . 656 . 592 . ln (7,700/0,844) = 110981 Дж/моль
656-592
Пример 4. Определить температурный коэффициент Вант-Гоффа ɣ для скорости реакции 2NO2=2NO + O2, в интервале температур Т1–Т2.
| T1, K | k1, л/моль . с | T2, k | k 2, л/моль . с |
| 656 | 7,700 | 592 | 0,844 |
Решение:
Температурный коэффициент Ван-Гоффа γ для скорости реакции в интервале температур Т1 /Т2 может быть рассчитан по формуле:
k 1 / k 2 = γ T 1 - T 2 / 10
или для данной реакции: k 1 / k 2 = 7,700/0,844 = γ 656-592/10, отсюда γ= 1.4

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!