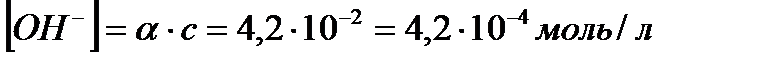Электролиты — это вещества, растворы или расплавы которых проводят электрический ток. Носителями зарядов являются положительно заряженные ионы – катионы и отрицательно заряженные ионы – анионы. Заряженные частицы в растворах электролитов появляются в результате распада (диссоциации) молекул электролита на ионы, которые несут положительный или отрицательный заряд. Этот процесс называется электролитической диссоциацией и описывается уравнение вида: AxBy ↔ xA + + yB - или конкретно Al2(SO4)3↔ 2Al3+ +3SO42-. Число положительных зарядов равно числу отрицательных зарядов, поэтому раствор в целом остается электронейтральным.
Электролитической диссоциации подвержены вещества с сильной полярной или ионной связью (соли, кислоты, основания) в растворителях с полярными молекулами.
Диссоциация молекул электролита на ионы происходит за счет электростатического взаимодействия между полярными молекулами растворенного вещества и растворителя. Образовавшиеся ионы окружаются молекулами воды, т.е. происходит гидратация ионов.
Гидратация ионов является экзотермическим процессом, т.е. происходит с выделением тепла, причем данный тепловой эффект сравним с тепловыми эффектами химических реакций. Взаимодействие между ионами в растворе зависит от диэлектрической проницаемости растворителя – ε. Диэлектрическая проницаемость растворителя показывает во сколько раз сила взаимодействия между двумя зарядами в данной среде меньше чем в вакууме.
Например, диэлектрическая проницаемость воды равна 81, т.е. взаимодействие между двумя зарядами в воде будет в 81 раз меньше чем в вакууме. Поэтому чем выше диэлектрическая проницаемость растворителя, тем легче молекулы электролита распадаются на ионы. По своей способности к диссоциации электролиты условно делятся на сильные и слабые. В растворах слабых электролитов очень малая часть молекул распадается на ионы, в то время как сильные электролиты диссоциированы почти полностью. К сильным электролитам относятся почти все соли, сильные кислоты (HCl, HNO3, HClO3, HClO4), гидроксиды щелочных и щелочно-земельных металлов (кроме Be(OH)2, Mg(OH)2).
К слабым электролитам относятся: вода, большинство органических оснований и кислот, фенолы, аммиак, амины, угольная кислота и т.д. В растворах слабых электролитов устанавливается равновесие между продуктами диссоциации – ионами и недиссоциированными молекулами [1].
Например, равновесие в растворе уксусной кислоты выражается следующим образом:
CH3COOH↔CH3COO- + H+
Количественно распад молекул слабого электролита на ионы характеризуется степенью диссоциации – α (альфа):
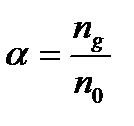 ,
,
где 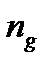 - число молекул распавшихся на ионы, n 0 - общее число молекул растворенного вещества в растворе.
- число молекул распавшихся на ионы, n 0 - общее число молекул растворенного вещества в растворе.
Степень диссоциации зависит от многих факторов, в частности, от концентрации слабого электролита, поэтому для суждения о силе слабого электролита ввели понятие константы диссоциации.
Константа диссоциации в соответствие с законом действия масс для реакции CH3COOH↔CH3COO- + H+ выражается следующим уравнением:
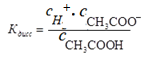
Константа диссоциации зависит от природы растворителя и от температуры. Выражение для константы диссоциации можно записать, используя степень диссоциации и концентрацию слабого электролита:
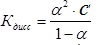
Если степень диссоциации α ≪ 1, то для приближенных расчетов получим:
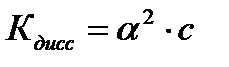 или
или 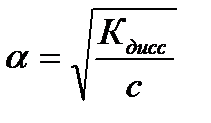 ,
,
где c – концентрация слабого электролита, моль/л.
Анализ этого уравнения позволяет сделать вывод о том, что с уменьшением концентрации слабого электролита степень диссоциации электролита возрастает. Зная значение α можно рассчитать равновесные концентрации ионов и недиссоциированных молекул слабого электролита в растворе:
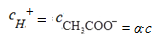
С CH3COOH = с - α . с= (1- α) с
Сильные электролиты при растворении в воде полностью распадаются на ионы. Сильное взаимодействие между ионами и полярными молекулами воды приводит к тому, что свойства раствора сильных электролитов значительно отличаются от свойства слабых электролитов, где межионным взаимодействием можно пренебречь. В связи с этим вместо термина «концентрация» введено понятие «активность».
Активность (а) – это эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую величину γ:
а = с∙γ,
где с - молярная концентрация, моль/л, γ- коэффициент активности
В сильно разбавленных растворах электролитов коэффициент активности стремится к единице.
Выражение для констант диссоциации (ионизации) слабого электролита целесообразно писать, используя соответствующие активности:
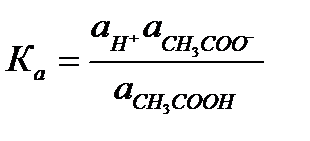
Химически чистая вода является слабым электролитом и незначительная часть молекул воды диссоциирует по уравнению:
H2O ↔ OН- + H+.
Поэтому выражение для константы диссоциации воды будет следующим:
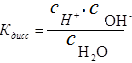
Термодинамические расчеты показывают, что диссоциации подвержена лишь очень малая часть молекул воды. Поэтому можно считать, что равновесная концентрация недиссоциированных молекул воды практически равна общей концентрации, т.е.
cH 2 O = 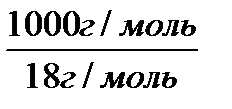 =55,56 моль/л.
=55,56 моль/л.
Следовательно, 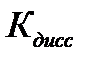 . cH 2 O =
. cH 2 O = 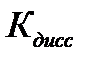 . 55,56 = К w
. 55,56 = К w
К w – константа, которая называется ионным произведением воды.
При t=250С К w = 10-14. Это означает, что если cH + = 10-2 моль/л, то
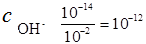 моль/л
моль/л
Таким образом, по значению Кw можно легко определить концентрацию ионов водорода при известной концентрации ОН- и наоборот.
В чистой воде с H + = с ОН - = 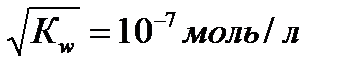 .
.
Для количественной характеристики реакции среды предложено использовать водородный показатель рН раствора (рН= - lg с H +). Аналогично существует и рОН раствора (pOH = - lg с ОН-), соответственно: рКw = рН + pOH = 14. Таким образом, в нейтральной среде рН =7, кислой рН < 7, щелочной рН > 7.
Гидролиз солей
Гидролизом называется обменное взаимодействие некоторых солей с водой, приводящее к образованию малодиссоциированных соединений (слабых кислот, слабых оснований или сложных ионов).
Гидролизу подвергаются соли, образованные:
- слабой кислотой и сильным основанием пример: CH3COONа - CH3COOН слабая кислота, NаОН – сильное основание; KCN - НСN - слабая кислота (цианистоводородная кислота), КОН – сильное основание);
- слабым основанием и сильной кислотой - NH4Cl, AgNО3
- слабой кислотой и слабым основанием - NH4CH3COO, Zn (CH3COO)2.
Пример: рассмотрим реакцию гидролиза:
NH4Cl +H2О↔NH4ОН + НCl
NH4+ + Cl-+ H2О↔NH4ОН+ Н++Cl-
Сокращенное ионно-молекулярное уравнение реакции гидролиза:
NH4+ + H2О↔NH4ОН+ Н+
Наличие Н+ в правой части уравнения говорит о том, что реакция среды кислая, т.е. рН<7. Процесс гидролиза характеризуется константой гидролизаКг.
В случае слабой кислоты: 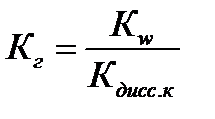 ,
, 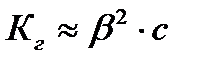 ,
,
где  - степень гидролиза соли;
- степень гидролиза соли;
с - концентрация раствора соли, моль/л;
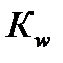 - ионное произведение воды.
- ионное произведение воды.
В случае слабого основания:
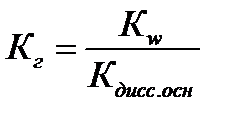
В случае, если соль образована слабой кислотой и слабым основанием:
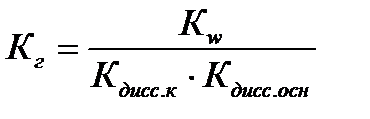
Примеры решения типовых задач
Пример 1. В каком направлении произойдет смещение равновесия в системе H2 +S ⇄ H2S если увеличить концентрацию водорода?
Решение. Если увеличить концентрацию водорода, то увеличится скорость прямой реакции и произойдет сдвиг равновесия вправо, но константа равновесия при этом не изменится.
Пример 2. В каком направлении произойдет смещение равновесия при повышении давления в системе 2NO + O2 ⇄ 2NO2?
Решение. При повышении давления равновесие смещается в сторону тех реагентов, которые занимают меньший объем (т.е. в сторону реагентов – исходных или конечных – где меньше общее число моль газообразных веществ). В нашем случае равновесие смещается вправо, т.к. там общее число моль равно 2, а слева – общее число моль равно 3.
Пример 3. В каком направлении произойдет смещение равновесия при повышении температуры системы COCl2 ⇄ CO+Cl2? Δ H 0 298 =113кДж
Решение. Прямая реакция протекает с поглощением тепла, поэтому равновесие будет смещено вправо, т.к. в этом случае реакционная система уменьшает внешнее воздействие температуры.
Пример 4. В какую сторону сместится равновесие реакции PCl5 ⇄ PCl3+ Cl2, ΔH0298 = 92,45 кДж, если повысить температуру на 30°С. Температурный коэффициент прямой реакции равен 2.5, а обратной – 3.2?
Решение. Так как температурные коэффициенты прямой и обратной реакций не равны, повышение температуры по-разному скажется на изменении скоростей этих реакций. При повышении температуры на 30°С скорость прямой реакции:
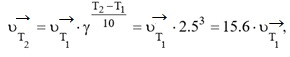
скорость обратной реакции:
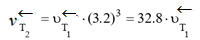
Таким образом, при повышении температуры скорость прямой реакции возросла в 15.6 раза, а обратной – в 32.8 раза. Следовательно, равновесие сместится в сторону обратной реакции.
Пример 5. Как изменится равновесие реакции
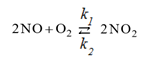 ,
,
если увеличить давление в реакционной системе в 2 раза?
Решение. До увеличения давления в системе выражения для скоростей прямой и обратной реакции будут следующими:
для прямой реакции: 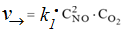 ,
,
для обратной реакции: 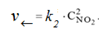
При увеличении давления в 2 раза концентрации всех реагирующих веществ увеличились в 2 раза, так как общий объем системы уменьшился в 2 раза. Тогда скорости прямой и обратной реакций станут равными:
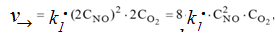
В результате увеличения давления скорости прямой и обратной реакций
увеличились соответственно в 8 раз и 4 раза.
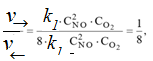
Таким образом, скорость прямой реакции будет в 2 раза больше чем скорость обратной реакции. Следовательно, смещение равновесия произойдет слева направо, т.е. в сторону образования NО2.
Пример 6. Определить концентрацию гидроксид-ионов и рН в 0,01 М растворе гидроксида аммония.
Решение. Значение константы диссоциации NH4ОН Кд=1,77 . 10-5. Электролитическая диссоциация гидроксида аммония описывается уравнением:
NH4ОН ↔ NH4++ ОН-
т.к. имеем разбавленный раствор слабого электролита, то закон разбавления Оствальда можно использовать в виде  , откуда степень диссоциации NH4ОН равна:
, откуда степень диссоциации NH4ОН равна:
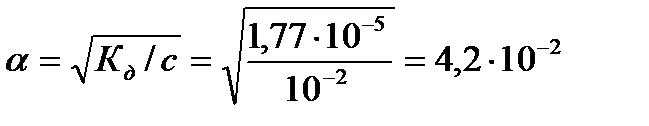 ,
,
тогда концентрация гидроксид-ионов:
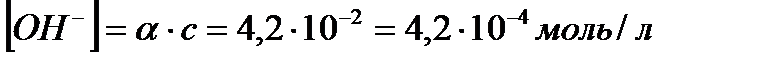
или рОН = -lg[ОH-]= - lg(4,2 . 10-4) = 3,38
рН =14 -рОН= 14-3,38 = 10,62



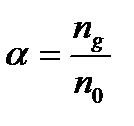 ,
,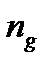 - число молекул распавшихся на ионы, n 0 - общее число молекул растворенного вещества в растворе.
- число молекул распавшихся на ионы, n 0 - общее число молекул растворенного вещества в растворе.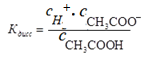
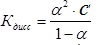
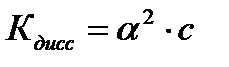 или
или 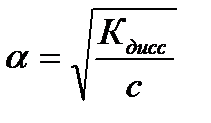 ,
, 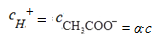
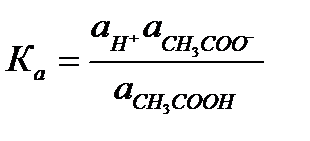
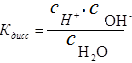
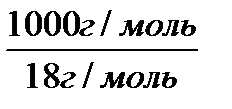 =55,56 моль/л.
=55,56 моль/л. . cH 2 O =
. cH 2 O = 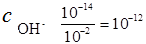 моль/л
моль/л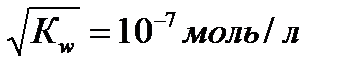 .
.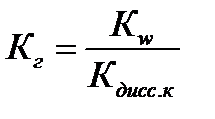 ,
, 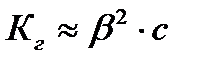 ,
,  - степень гидролиза соли;
- степень гидролиза соли;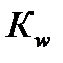 - ионное произведение воды.
- ионное произведение воды.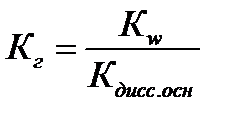
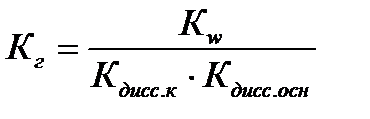
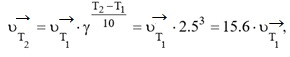
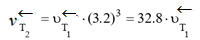
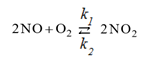 ,
,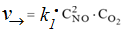 ,
,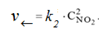
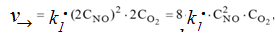
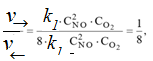
 , откуда степень диссоциации NH4ОН равна:
, откуда степень диссоциации NH4ОН равна: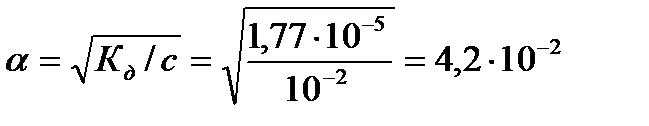 ,
,