

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Интересное:
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Изменение температуры системы, находящейся в состоянии равновесия, концентрации ее составных частей приводит к нарушению равенства скоростей прямой и обратной реакций. Такое состояние продолжается недолго. Через некоторое время равенство скоростей вновь восстанавливается. Однако новое состояние равновесия смещено относительно первоначального в направлении той реакции, которая временно протекала с большей скоростью. Такой переход от одного равновесного состояния к другому называется смещением или сдвигом равновесия.
Направление, в котором происходит смещение равновесия при изменении температуры, можно определить, руководствуясь правилом Вант-Гоффа, согласно которому повышение температуры вызывает смещение равновесия в сторону реакции, идущей с поглощением теплоты, а понижение температуры смещает равновесие в сторону реакции, идущей с выделением теплоты.
Например, реакция взаимодействия йода и водорода:
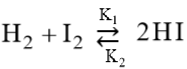 , ΔHo 298 = 51,9 кДж
, ΔHo 298 = 51,9 кДж
идет с поглощением тепла, а, следовательно, обратная реакция идет с выделением тепла, то при повышении температуры новое состояние равновесия окажется смещенным вправо, а при понижении температуры – влево.
Так как с повышением температуры константы скорости прямой и обратной реакций k1 и k 2 увеличиваются в различное число раз, то в новом состоянии равновесия константа Кравн.=k1/k2 будет иметь другое значение.
Направление, в котором происходит сдвиг равновесия при изменении концентрации составных частей системы, можно определить исходя из следующих соображений: при увеличении концентрации исходных веществ происходит сдвиг равновесия в сторону прямой реакции, а увеличении концентрации продуктов реакции вызывает смещения равновесия в обратном направлении.
|
|
Например, если в реакционной системе: 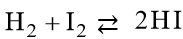
увеличить концентрацию йода, то увеличится скорость прямой реакции, т.е. реакции образования HI. Концентрация же водорода уменьшится, поскольку, он расходуется на образование HI. В реакционной системе произойдет сдвиг равновесия вправо, константа равновесия при этом не изменится. К этому выводу можно прийти исходя из выражения Кравн =k1/k2.
Константы скорости прямой и обратной реакций не зависят от концентраций, и, следовательно, их отношение сохранит своё прежнее значение. Изменение давления так же может вызвать смещение равновесия в том случае, если в процессе реакции уменьшается или увеличивается объем системы. Для определения направления, в котором происходит сдвиг равновесия при изменении давления, следует помнить, что увеличение давления смещает равновесие в сторону образования тех продуктов, которые занимают меньший объем, и наоборот, уменьшение давления способствует, смещению равновесия в сторону образования продуктов, занимающих больший объем. Так как в системе:
N2 + 3H2 →2 NH3
объем образующегося аммиака в 2 раза меньше объема исходных газов, то увеличение давления вызывает смещение равновесия вправо, а уменьшение давления будет способствовать разложению аммиака на водород и азот.
Направление, в котором происходит сдвиг равновесия системы, может быть определено исходя из принципа Ле-Шателье: если изменить одно из условий состояния системы, находящейся в равновесии, – температуру, концентрацию, давление, то в системе усиливается процесс, стремящийся свести это изменение к минимуму, т.е. ослабить его.
|
|
|

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!