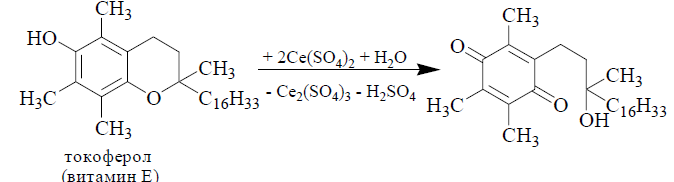·K2Cr2O7 легко получить химически чистым. Стандартный раствор готовят по точной навеске; Для очистки K2Cr2O7 от примесей его дважды перекристаллизовывают из водного раствора; полученный препарат высушивают в сушильном шкафу при 150 – 200°С и сохраняют в закрытой склянке. Высушенная соль негигроскопична, и ее можно использовать непосредственно для приготовления рабочего раствора. Для приготовления 1 л раствора 0,100 молярной концентрации эквивалента отвешивают на аналитических весах 4,9040 г K2Cr2O7, навеску растворяют в воде и раствор разбавляют до 1 л.
·растворы K2Cr2O7 устойчивы. Титр не изменяется в течение долгого времени независимо от температуры, действия О2 или СО2 воздуха и т.д.;
·титрование дихроматом калия можно проводить в солянокислой среде, тогда как титрование перманганатом в присутствии HCl невозможно из-за окисления хлорид-ионов;
·дихромат калия труднее, чем перманганат, восстанавливается органическими веществами, попадающими в дистиллированную или деионизированную воду;
·в отличие от более слабых окислителей, например йода, дихромат-ионы окисляют многие органические соединения;
·в ряде случаев титрование дихроматом можно проводить на холоде;
·кроме титрования восстановителей K2Cr2O7 широко применяется для определения окислителей путем предварительного восстановления их солями железа (II) и последующего титрования избытка Fe2+ стандартным раствором дихромата калия.
Недостатки хроматометрического метода
·дихромат калия менее сильный окислитель, чем перманганат, и поэтому он используется значительно реже;
·окислительно-восстановительная реакция с участием K2Cr2O7 протекает относительно медленно. Скорость реакций повышается в сильнокислых средах, так как потенциал системы Cr6+/Cr3+ возрастает по мере увеличения концентрации ионов водорода и ряда лигандов;
·конечную точку титрования по изменению окраски раствора, вызываемому избытком реагента, относительно трудно установить, поэтому титрование проводят предпочтительно индикаторным способом;
Безиндикаторный метод. Метод основан на изменении окраски титруемого раствора, вызываемым избытком реагента. При этом зеленый цвет, присущий ионам Cr3+, переходит в желто-зеленый. Иногда изменение окраски вызывается окислением определяемого вещества, изменяющего окраску при действии дихромата.
Индикаторный метод. В основе метода лежит применение внутренних ред-окс индикаторов (дифениламин, дифениламиносульфокислота, фенилантраниловая кислота), хемилюминесцентных индикаторов (силоксен), а также внешних индикаторов (лейкометиленовый голубой).
·вследствие того что со многими восстановителями дихромат калия реагирует медленно, прямой метод титрования часто невозможен, поэтому применяют обратный метод титрования.
Перманганатометрия
Перманганатометрия относится к методам титриметрического анализа, основанных на окислительно-восстановительных процессах. В качестве рабочего раствора применяется раствор перманганата калия (KMnO4) обычно 0,0200 – 0,100 молярной концентрации эквивалента.
В процессе титрования анализируемого раствора малиново-фиолетовая окраска раствора перманганата обесцвечивается. Однако после достижения точки эквивалентности первая же избыточная капля раствора перманганата окрашивает титруемую жидкость в бледно-малиновый цвет. Индикатором в данном случае является сам перманганат калия. Поэтому при перманганатометрических определениях индикаторы не добавляют.
Окисление перманганатом калия может проводиться как в кислой, так и в щелочной среде. В кислой среде окисление происходит по следующей реакции:
MnO4- + 8H+ + 5ē ↔ Mn2+ + 4H2O, Е0MnO4-/Mn2+ =1,52 В
В щелочной или нейтральной среде окисление происходит по следующей реакции:
MnO4 - + 2H2О + 3ē ↔ MnО2 + 4OН- Е0MnO4-/MnO2=0,60 В
Образующийся диоксид марганца представляет собой бурый осадок, присутствие которого в растворе затрудняет определение точки эквивалентности. Кроме того, окислительная активность перманганата калия в кислой среде значительно выше, чем в щелочной и нейтральной средах. По этим соображениям титрование перманганатом калия чаще всего производят в кислых растворах.
Перманганатометрию используют не только для количественного определения восстановителей, но и окислителей. Восстановители, за редким исключением, определяют путем прямого титрования рабочим раствором перманганата. Определяя окислители, пользуются способом обратного титрования, т.е. к анализируемому раствору окислителя приливают заведомый избыток вспомогательного раствора восстановителя с известным титром; а затем избыток восстановителя оттитровывают раствором перманганата калия.
Цериметрическое титрование
Цериметрическое титрование - титриметрический метод анализа, в котором титрантом является соль Сe(+4), обычно Сe(SO4)2.
В процессе титрования происходит восстановление Сe4+ до Сe3+:

Гидратированые ионы церия, особенно Сe4+, обладают выраженными кислотными свойствами и образуют малорастворимые гидроксокомплексы, поэтому цериметрическое титрование проводится в сильнокислой среде. Формальный электродный потенциал пары Се4+/ Се3+ зависит от природы кислоты.

В цериметрическом титровании обычно используют серную кислоту. Растворы Ce4+ в HNO3 и HClO4 при хранении менее устойчивы, потому что Ce4+ в таких растворах является более сильным окислителем и может окислять воду. Растворы церия Ce4+ в HCl также недостаточно устойчивы вследствие возможного окисления хлорид-ионов.
Стандартный раствор Ce(SO4)2 готовят из Ce(SO4)2·4H2O или Ce(SO4)2·2(NH4)2SO4·2H2O путём растворения навески в 1 М серной кислоте. Стандартный раствор Ce(SO4)2 обычно является вторичным. Для его стандартизации используют Na2C2O4, соль Мора, заместительное иодометрическое титрование и т.д.
Обнаружение конечной точки цериметрического титрования может проводиться по собственной окраске титранта (гидратированный ион Ce4+ - жёлтый, а Ce3+ - бесцветный). Однако чаще для этой цели используют окислительно-восстановительные индикаторы - дифениламин, ферроин и др.
Прямое цериметрическое титрованиеиспользуется для определения различных восстановителей: как неорганических (Fe2+, H2O2, SO32- и др.), так и органических. В отличие от перманганатометрического или дихроматометрического титрования окисление органических веществ Сe4+ протекает более мягко и может быть использовано для определения конкретной функциональной группы. Например, цериметрическое титрование, основанное на окислении фенола до хинона, используется для определения витамина Е:
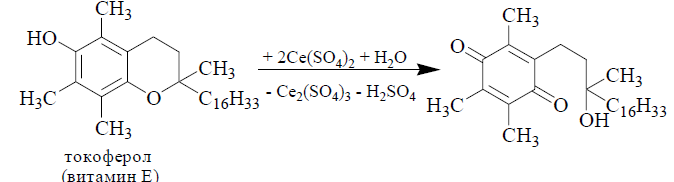
В случае обратного цериметрического титрования вторым стандартным раствором обычно является раствор Fe2+. Известны методики цериметрического титрования, в которых проводится титрование заместителя. Таким образом определяют сильные восстановители, легко окисляющиеся кислородом воздуха. Цериметрическое титрование может быть использовано и для определения некоторых окислителей, например, персульфат-ионов. К исследуемому раствору вначале добавляют избыток стандартного раствора Fe2+, а затем титруют избыток Fe2+ стандартным раствором Ce(SO4)2.
Индикаторы, применяемые для установления конечной точки титрования в методе редоксиметрии. Примеры. Интервал перехода окраски индикатора. Выбор индикатора.
Окислительно-восстановительные индикаторы - вещества, способные окисляться или восстанавливаться с изменением окраски в точке эквивалентности либо вблизи неё. Такие индикаторы реагируют не на изменение концентрации определённого вещества, а на изменение потенциала системы.

Наиболее часто применяемыми окислительно-восстановительными индикаторами являются дифениламин и его производные, а также хелаты ионов железа с фенантролином или с замещёнными фенантролинами.
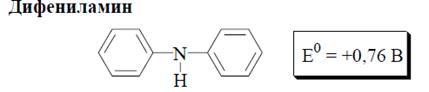
Дифениламин малорастворим в воде (для приготовления его растворов используют концентрированную серную кислоту). Более удобными для практического применения являются водорастворимые аналоги дифениламина, применяемые в виде различных солей.
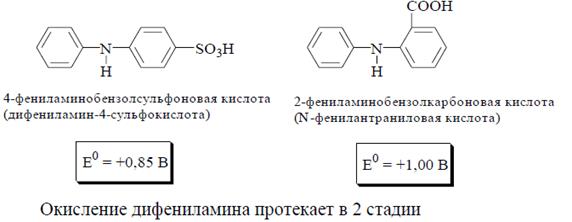

Дифениламин и его производные являются одноцветными индикаторами. Их окисленная форма фиолетовая с различными оттенками в зависимости от заместителей, восстановленная - бесцветна. В процессе восстановления индикаторов из группы дифениламина участвуют протоны, поэтому величина электродного потенциала у этих веществ зависит от рН (рядом с формулами приведены значения E0 для рН 0).
Ферроин – это комплекс катионов железа с фенантролином. Ферроин - двухцветный индикатор, но интенсивность окраски у различных его форм неодинакова. Восстановленная форма имеет интенсивную красно-оранжевую окраску, окисленная – бледно-голубую. В отличие от дифениламина его окислительно-восстановительные свойства в значительно меньшей степени зависят от рН.

Изменение окраски окислительно-восстановительных индикаторов происходит в некотором интервале, определяемого с их помощью свойства системы, в данном случае электродного потенциала. Рассмотрим двухцветный индикатор, в полуреакцию с участием которого не входят протоны (либо их концентрация равна 1 моль/л).

Будем считать, что для того, чтобы изменение окраски было заметным, концентрация одной окрашенной формы должна стать в 10 раз больше, чем другой. Таким образом, переход окраски индикатора будет происходить в диапазоне:

Так, изменение окраски одноэлектронного индикатора будет происходить в пределах 120 мВ, двухэлектронного – 60 мВ. Полученная формула описывает идеальный случай, когда окраски различных форм индикатора имеют одинаковую интенсивность и одинаково воспринимаются глазом. В действительности это обычно не так. Например, переход окраски ферроина в 1 М H 2 SO 4 происходит в интервале 1,08 – 1,20 В, при том, что величина формального потенциала данного индикатора при этих условиях равна 1,06 В. Из-за того что восстановленная форма ферроина имеет значительно более интенсивную окраску, чем окисленная, начало перехода окраски визуально обнаруживается лишь тогда, когда концентрация окисленной формы более чем в 2 раза превысит концентрацию восстановленной формы.
В случае одноцветного индикатора, так же, как и в случае одноцветного кислотно-основного индикатора переход окраски зависит ещё и от общей концентрации индикатора в растворе.

Как и при других видах титрования конечная точка титрования, обнаруживаемая с помощью индикатора, может в той или иной степени не совпадать с точкой эквивалентности, что приводит к возникновению систематической индикаторной погрешности. Принцип оценки величины такой погрешности при окислительно-восстановительном титровании заключается в сравнении потенциалов в точке эквивалентности и в конечной точке титрования и дальнейшем определении величины f для конечной точки титрования.
Практически ОВ индикатор выбирают таким образом, чтобы Ео индикатора совпало или было максимально близким к потенциалу в точке эквивалентности и обязательно входило в интервал потенциалов, соответствующий скачку титрования.