1. Ионная теория индикаторов
Индикаторы – это слабые органические кислоты или основания, ионизированные (диссоциированные) и неионизированные(молекулярные) формы которых окрашены в разный цвет.
Индикаторы - это протолиты, образующие сопряженные кислоты и основания, которые в водных растворах окрашены в разный цвет. Например, раствор фенолфталеина в нейтральной (кислой) и щелочных средах:
HInd + H2O → Ind- + H3O+
кислота (бесцвет.) сопряженное основание (малинов.)
(неионизированная) форма ионизированная форма
Равновесия в растворе метилового оранжевого:
Ind- + H2O → HInd + OH-
основание (желт.) сопряженная кислота (розов.)
Ионная теория достаточно просто и хорошо объясняет изменение цветов индикаторов: при изменении pH среды кислотно-основные индикаторы участвуют в протолитических равновесиях, сопровождающихся изменением структуры индикаторов, что приводит к исчезновению, появлению или изменению окраски. Теория имеет недостаток: она не связывает изменение цвета индикатора с молекулярной структурой индикатора.
2. Хромофорная теория индикаторов
Хромофорная теория была предложена немецким ученым О. Виттом в 1878 г.: «Цветность органических соединений, в частности кислотно-основных индикаторов, обусловлена наличием в молекулярной структуре индикаторов ненасыщенных групп атомов (хромофорные группы). К хромофорам относят:
- азогруппу -N=N-,
- нитрогруппу -NO2,
- нитрозогруппу -N=O,
- азометиновую группу >С=N-;
- карбонильную группу >С=О,
- сопряжённые системы двойных связей,
- хиноидные группировки и др.
Усиление окраски (интенсивности окраски) индикатора связано с наличием в их структуре групп атомов: -NH2, -OH, -NHR, -OCH3, пиридин, -SO3H, -C6H5 (фенил), нафтил, называемых ауксохромами. Ауксохромы – группировки, которые сами по себе не окрашены, но влияют на глубину окраски. Сочетание хромофорных и ауксохромных групп обеспечивает окраску индикаторов.
Реакции протонного переноса для таких соединений сопровождаются структурными изменениями с образованием, исчезновением или изменением структуры хромофорных групп. Изменение окраски индикатора происходит вследствие изомерного превращения – внутримолекулярной перегруппировки соединения. Как следствие замена одних ауксохром другими или возникновение новых группировок. Таким образом, помимо протолитических равновесий могут быть и различные таутомерные равновесия. Различные таутомерные формы, обладающие различной окраской, находятся в равновесии. При сдвиге равновесия преобладает одна из таутомерных форм. Например, равновесия в растворе п-нитрофенола.


бензоидная структура хиноидная структура
Молекулярная (недиссоциированная) форма бесцветная и поглощает при λ = 315 нм (ближняя УФ-область), а диссоциированная молекула приобретает желтый цвет и поглощает в видимой области спектра (λ = 400 нм). В случае кислотно-основных равновесий в растворе п-нитрофенола происходит бензоидно-хиноидная перегруппировка.
3. Ионно-хромофорная теория
Обе теории (ионная и хромофорная) слились в одну – ионно-хромофорную теорию индикаторов, согласно которой: для кислотно-основных индикаторов наиболее характерными факторами, вызывающими изменение окраски, являются:
1) изменение соотношения количеств молекулярной и ионной форм индикатора, происходящее под влиянием кислот и щелочей (т.е. протолитические равновесия);
2) появление или исчезновение хромофорных групп или превращение одних хромофорных групп в другие.
А в целом появление или углубление окраски органического соединения связано с введением в их молекулы хромофоров и ауксохромов, увеличением числа сопряженных связей, диссоциацией или ассоциацией их молекул, образованием ВКС.
Характеристики индикаторов
Изменение окраски метилового оранжевого и любых других кислотно-основных индикаторов происходит в определённом интервале рН, называемом интервалом перехода окраски индикатора. Каждый индикатор имеет свой интервал перехода, который зависит от особенностей структуры индикатора и его способности к ионизации.
 (25)
(25)
В среднем, человеческий глаз замечает изменение окраски, когда концентрация одной окрашенной формы становится в 10 раз больше, чем другой.
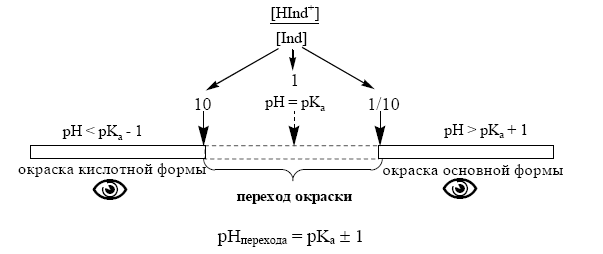
Табл. 1

Кроме интервала перехода окраски, индикаторы характеризуются показателем титрования рТ. Показатель титрования рТ – это значение рН в пределах интервала перехода окраски, при котором наблюдается наиболее резкое изменение цвета индикатора и заканчивается титрование. Показатель титрования рТ обычно равен рН раствора, при котором концентрации обеих окрашенных форм индикатора равны, т.е. [HInd] = [Ind-], в этом случае соблюдается равенство: рТ = рН = рКInd. В химических справочниках обычно указываются окраски кислотной и основной форм индикатора, значения интервала перехода окраски и методика приготовления раствора индикатора.
Величина показателя титрования находится примерно в середине интервала перехода окраски индикатора, например, у метилового оранжевого рТ ≈ 4.
Интервал перехода окраски индикаторов зависит от:
• температуры;
• ионной силы;
• присутствия в растворе посторонних веществ (например, этанола), влияющих на кислотно-основные свойства индикатора.
Приведем примеры.
Интервал перехода окраски индикатора метилового оранжевого находится в пределах рН от 3,1 до 4,4. При рН > 4,4 метиловый оранжевый окрашивает раствор в желтый цвет, при рН < 3,1 – в розовый, в интервале от рН 3,1 до рН 4,4 окраска его постепенно изменяется из розовой в желтую. Показатель титрования метилового оранжевого равен 4,0.
Другой индикатор – фенолфталеин – при рН < 8 бесцветный, в интервале рН от 8,0 до 10,0 окраска из бледно-розовой постепенно переходит в ярко-малиновую. Показатель титрования для фенолфталеина равен 9.
Интервал перехода окраски индикатора метилового красного от рН 4,4 до рН 6,2. При рН < 4,4 этот индикатор имеет красный цвет, при рН > 6,2 – желтый. Показатель титрования для этого индикатора равен 5.
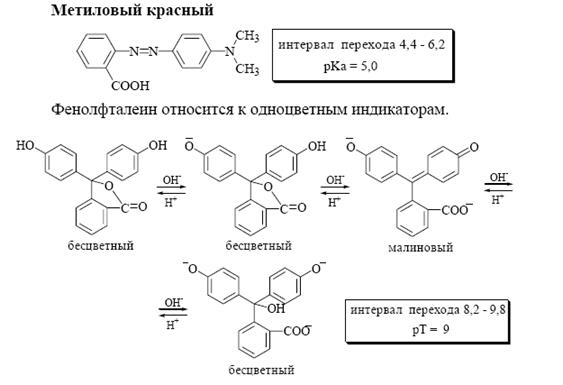
Лактонная форма фенолфталеина не имеет окраски, дианион -окрашен в малиновый цвет, что связано со значительной степенью делокализации электронов в последнем. В сильнощелочной среде образуется трианион фенолфталеина (карбинольная форма), и его раствор вновь становится бесцветным. При ионной силе 0,2: рKa1 = 8,83; рKa2 = 9,32; рKa3 = 11,73.
Для повышения контрастности изменения окраски используют смешанные и контрастные индикаторы.





 (25)
(25)





