Кривые титрования являются графическим изображением изменения pH раствора при постепенном прибавлении рабочего раствора к определенному количеству исследуемого раствора. Выражают зависимость изменения рН среды от объема добавленного в процессе титрования титранта. Кривые кислотно-основного титрования позволяют проследить за качественными и количественными изменениями титруемого раствора в процессе титрования.
Они являются логарифмическими кривыми, на которых по оси ординат откладываются значения величин, линейно связанных с логарифмами концентраций участвующих в реакции веществ (к таким величинам относится величина рН), а по оси абсцисс – объем прибавленного титранта (VT) или степень оттитрованности:

Ст и Со – концентрации титранта и титруемого вещества,
VT и Vо – объем добавленного титранта и объем титруемого вещества.
Факторы, влияющие на величину скачка титрования
• концентрация титруемого вещества и титранта (при уменьшении концентрации титруемого вещества и титранта величина скачка титрования уменьшается, поэтому кислотно-основное титрование нельзя использовать для определения веществ в сильно разбавленных растворах),
• сила титруемой кислоты или основания (величина скачка титрования также становится меньше при уменьшении силы титруемой кислоты или основания. Если концентрация титруемого раствора и титранта меньше 1,0·10-3 моль/л и К ≤ 10-7 скачка титрования не наблюдается, а на кривых титрования имеется только точка перегиба),
• температура (при повышении температуры константа автопротолиза воды увеличивается, при этом сужается естественная шкала кислотности воды, поэтому величина скачка кислотно-основного титрования в водном растворе уменьшается.),
• ионная сила раствора (аналогично температуре).

Кривые титрования 0,1М CH3COOH 0,1М NaOH (1), 0,001М HCl 0,001М NaOH (2) и
0,1М HCl 0,1М NaOH (для факторов, влияющих на величину скачка)
Кривые титрования:
Расчёты для построения кривой титрования 0,10 М HCl
М раствором NaOH и наоборот
Рассмотрим кривую титрования 0,10 М раствора HCl при использовании в качестве титранта 0,10 М NaOH. В любой кривой титрования можно условно выделить 4 участка:
• до начала титрования;
• титрование до точки эквивалентности (50%, 90%, 99%; 99,9% добавленного титранта);
• точка эквивалентности;
• участок после токи эквивалентности (100,1%, 101%, 110%, 150% избытка добавленного титранта).
Расчёты, необходимые для построения кривой титрования, удобно представить в виде таблицы (табл. 1). Исходный объём раствора HCl составляет 100,0 мл. Полученная кривая титрования представлена на рис.. На этом же рисунке представлена кривая титрования 0,10 М NaOH 0,10 M раствором HCl. Кривые титрования сильной кислоты сильным основанием и сильного основания сильной кислотой симметричны друг другу (рис 1). Точка эквивалентности совпадает с точкой нейтральности.


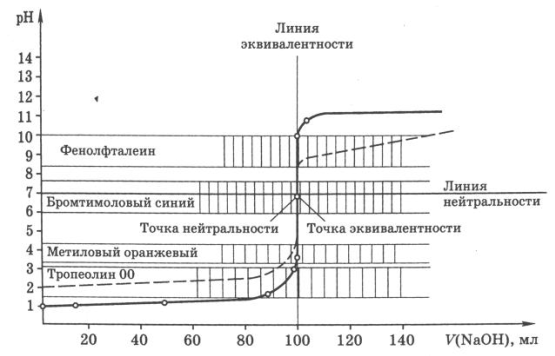
Рис. 1. Кривая титрования 100,0 мл 0,1 М раствора HCl 0,1 М раствором NaOH.

Рис. 2. Кривая титрования 100,0 мл 0,1 М раствора NaOH 0,1 М раствором HCl.
Кривые титрования сильных одноосновных протолитов характеризуются большим скачком титрования (5 – 6 единиц pH), а также совпадением т.э. с т.н. (точкой нейтральности) – pH = 7. Поэтому в качестве индикаторов можно использовать метилоранж (ИПО: 3,1 - 4,4); метилрот (ИПО: 4,4 – 6,2); фенолфталеин (ИПО: 8 – 10)
Кривые титрования 0,1 М раствора CH3COOH 0,1 М раствором NaOH и
0,1 М раствора NH4OH 0,1 М раствором HCl
Теперь рассмотрим кривую титрования слабой кислоты сильным основанием и кривую титрования слабого основания сильной кислотой
При титровании слабой кислоты сильным основанием, например, уксусной кислоты раствором гидроксида натрия (СН3СООН+NaOH → CH3COONa+Н2О) образуется соль слабой кислоты и вода, поэтому до т.э. в растворе находится буферная смесь, состоящая из слабой кислоты и ее соли.
В т.э. вся слабая кислота переходит в соль слабой кислоты, анион которой подвергается гидролизу: СН3СОО-+Н2О → СНзСООН + ОН-, поэтому в т.э. среда щелочная. Ацетат натрия по протолитической теории является слабым основанием.
После т.э. в растворе имеется избыток титранта (щелочи), который подавляет гидролиз аниона слабой кислоты.
При титровании слабого основания сильной кислотой исходный раствор слабого основания имеет щелочную реакцию. При добавлении к нему титранта образуется соль, содержащая катион слабого основания. Если, например, слабое основание – аммиак, то при прибавлении к нему раствора НС1 образуется хлорид аммония и вода: NH3∙Н2О + HCI → NH4C1+Н2О. После начала титрования в растворе присутствуют как слабое основание, так и соль, образованная катионом слабого основания, т.е. образуется буферная система.
В т.э. в растворе присутствует только соль, образованная катионом слабого основания, который подвергается гидролизу, что и определяет величину рН раствора. После т.э. в растворе имеется избыток прибавленной сильной кислоты, которая подавляет гидролиз образовавшейся соли.
Рассчитаем значения рН раствора в различные моменты титрования. При этом используем те же обозначения, которые были введены выше.


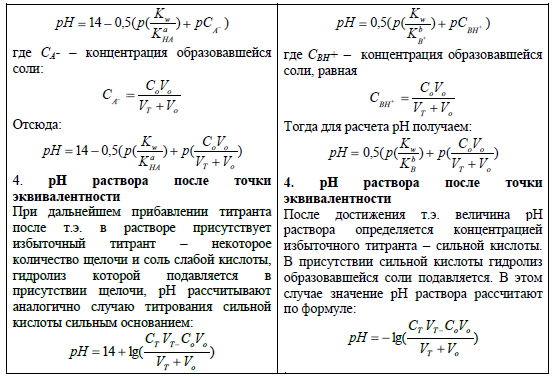

Рис. 3. Кривая титрования 100,0 мл 0,1 М раствора CH3COOH 0,1 М раствором NaOH.
При титровании более разбавленного раствора кислоты более разбавленным раствором щелочи получается аналогичная кривая, но изменение pH вблизи т.э. менее резкое и скачок титрования уменьшается. Это обстоятельство приводит к уменьшению точности титрования.

Рис. 4. Кривая титрования 100,0 мл 0,1 М раствора NH4OH 0,1 М раствором HСl
Кривые титрования слабых одноосновных кислот (однокислотных оснований) растворами сильных оснований (сильных кислот) характеризуются небольшим скачком титрования (2 – 3 ед.pH) и несовпадением т.э с т.н. (точкой нейтральности).
Титрование многопротонных протолитов. Дифференцированное титрование. Титрование смесей протолитов. Общий вид кривой титрования многопротонного протолита. Условия существования нескольких скачков на кривой титрования.
Многоосновные кислоты - обычно слабые кислоты. Их диссоциация в водном растворе протекает ступенчато, каждая из ступеней характеризуется своей константой диссоциации. На кривых титрования наблюдаются несколько перегибов. Их расположение зависит от значений и соотношения констант диссоциации, изменение pH вблизи каждой т.э. имеет менее резкий характер, чем при титровании одноосновных кислот, поэтому определение многоосновных кислот менее точное, т.е. с большей погрешностью определения.
Чтобы получить отчетливые точки эквивалентности с хорошо выраженными скачками титрования должны соблюдаться условия:
1. Значения Ка1, Ка2 и т.д. должны быть достаточно велики, т.е. Ка > 10-7 и
Ка·с > 10-8.
2. Последующие константы диссоциации должны отличаться в достаточной степени, т.е. должно выполняться соотношение: Ка1/Ка2 ≥ 104. Иначе титрование второго протона начинается до того, как заканчивается титрование первого. На кривой титрования не будет двух точек эквивалентности, а будет один скачок, соответствующий суммарному титрованию первой и второй ступеней диссоциации.
Докажем вышестоящее соотношенея расчетным способом. Представим себе, что мы титруем двухосновную кислоту H2A, превращение которой в НА- характеризуется константой Ka1, а превращение НА- в A2- - константой Ka2.
 (29)
(29)
Определим, при каком соотношении данных констант, H2A можно оттитровать вначале до HA-, а затем до A2-, т.е. можно получить кривую титрования с двумя отчётливыми скачками титрования. Допустим, что нас удовлетворяет погрешность титрования H2A по первой ступени менее 1%, иначе говоря, к концу титрования степень превращения H2A в НА- составит более 99%, а НА- в A2- менее 1%.
 (30)
(30)
Таким образом, чтобы оттитровать двухосновную кислоту по первой ступени с погрешностью менее 1%, необходимо, чтобы константы кислотности по первой и второй ступени отличались на 4 порядка и более. При допустимой погрешности 0,1% константы должны отличаться на 6 порядков и т.д.

Поэтому фосфорную кислоту можно оттитровать по ступеням, а в случае титрования щавелевой кислоты будет только наблюдаться один скачок.
В качестве примера рассмотрим титрование раствора, содержащего карбонат-ион (например, 0,10 М Na2CO3). Карбонат натрия представляет собой двухкислотное основание, протолиз которых в водных растворах проходит ступенчато:
CO32- + H2O ↔ HCO3- + OH- KB,1 = 2,0 ∙ 10-4
HCO3- + H2O ↔ H2CO3 + OH- KB,2 = 2,2 ∙ 10-8
Расчёт рН для основных точек кривой титрования приведен в табл. 4. Кривая титрования показана на рис. 6. На кривой имеются 2 скачка титрования; первый скачок можно обнаружить при использовании фенолфталеина, а второй - метилового оранжевого.
Табл. 4
Расчёты для построения кривой титрования 0,1 М Na2CO3
0,1 М раствором HCl


Рис. 6. Кривая титрования титрования 0,1 М Na2CO3 0,1 М раствором HCl
Ортофосфорная кислота является трехосновной и диссоциирует в водном растворе по трем стадиям:
1 стадия: H3PO4  H+ + H2PO4-
H+ + H2PO4-
2 стадия: H2PO4-  H+ + HPO42-
H+ + HPO42-
3 стадия: HPO42-  H+ + PO43-.
H+ + PO43-.
Соответствующие константы диссоциации равны:
К1(H3PO4) =7,1·10-3; (рК1 = 2,15);
К2(H3PO4) = 6,2·10-8; (рК2 = 7,21);
К3(H3PO4) = 5,0·10-13; (рК3 = 12,30).
Титрование фосфорной кислоты представляет собой титрование смеси трех кислот – H3PO4, H2PO4-, HPO42-. Сначала нейтрализуется более сильная кислота H3PO4, отличающаяся большей константой диссоциации, во вторую очередь нейтрализуется H2PO4-, а затем уже - HPO42-.
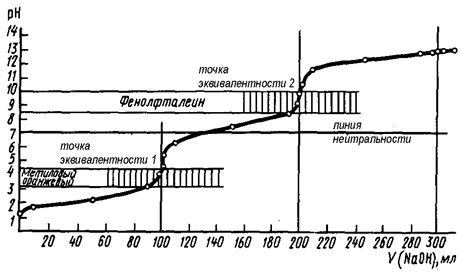
Рис. 7. Кривая титрования 0,1 М раствора H3PO4 0,1 М раствором NaOH
Таким образом, фосфорная кислота оттитровывается как двухосновная (fэкв = ½): по первой ступени – с индикатором метиловым оранжевым (ИПО: 3,1 – 4,4) и по второй ступени – с фенолфталеином (ИПО: 8,0 – 10,0). У третьей точки эквивалентности скачок титрования отсутствует по следующим причинам:
1) в области pH ~ 13 трудно подобрать индикатор;
2) константа диссоциации К3(H3PO4) = 5,0·10-13 достаточно мала и не выполняется условие Ка > 10-7, поэтому такие кислоты не оттитровываюся прямым методом;
3) если на кривой титрования наблюдается 3 скачка и для проявления каждого необходимо около 4-6 единиц pH, тогда третий скачок не сможет проявиться в водных растворах нормальной шкалы pH (0-14).
При необходимости можно оттитровать Н3PO4 по всем трём стадиям. Для этого в исследуемый раствор вводят CaCl2, в результате чего образуется малорастворимый Ca3(PO4)2:
2H3PO4 + 3 CaCl2 = Ca3(PO4)2↓ + 6HCl,
а выделившееся эквивалентное количество соляной кислоты титруют раствором NaOH.














 (29)
(29) (30)
(30)


 H+ + H2PO4-
H+ + H2PO4-



