Стандартным раствором называют раствор реагента с точно известной концентрацией. Массу титриметрически определяемого компонента А вычисляют по объему и концентрации стандартного раствора реагента В – титранта, израсходованного на титрование раствора этого компонента.
По способу приготовления различают первичные и вторичные стандартные растворы. В качестве титрантов обычно применяют разбавленные растворы реагентов с концентрацией 0,1 – 0,01 моль-экв/л, которые готовят либо разбавлением концентрированных растворов (например, HCl, NaOH), либо растворением соответствующей приблизительной навески реагента, взвешанной на технических весах (например, KMnO4, Na2S2O3). Такие растворы должны быть стандартизованы (установление точной концентрации) с помощью установочных веществ, которые являются первичными стандартами.
Первичный стандартный раствор готовят растворением точного количества (приготовлен по точной навеске) чистого химического вещества известного стехиометрического состава в определенном объеме раствора (в мерной колбе). Реагент для приготовления первичного стандарта (установочное вещество) должен отвечать ряду требований:
1. иметь состав, строго соответствующий химической формуле;
2. быть химически чистым (т.е. квалификация чистоты не ниже х.ч.);
3. быть химически устойчивым как в твердом виде, так и в растворе (быть нелетучим; негигроскопичным; не поглощать CO2 и другие компоненты из атмосферы; не претерпевать изменений при высушивании);
4. обладать по возможности большой молярной массой эквивалента, так как при этом уменьшается относительная ошибка при взвешиавании.
Этим требованиям отвечают, например, следующие вещества: Na2B4O7∙10H2O, Na2CO3, щавелевая кислота (H2C2O4∙2H2O), бензойная кислота (C6H5COOH), (NH4)2C2O4∙H2O, K2Cr2O7, KBrO3, CaCO3, Zn, ZnO.
Точно взвешанную навеску (на часовом стекле, кальке, в бюксе, стакане) растворяют в мерной колбе и разбавляют до требуемого объема. Например, приготовление первичного стандарта – раствора K2Cr2O7 с концентрацией 0,05 моль-экв/л в мерной колбе на 100 мл. На основании уравнения полуреакции:
Сr2O72- + 6ê + 14H+ ↔ 2Cr3+ + 7H2O (5)
Находят молярную массу эквивалента K2Cr2O7
М( К2С r 2 O 7) = М ( K2Cr2O7)∙fэкв. (K2Cr2O7) = 294,19∙
К2С r 2 O 7) = М ( K2Cr2O7)∙fэкв. (K2Cr2O7) = 294,19∙  = 49,03.
= 49,03.
Расчет навески K2Cr2O7 будем осуществлять на основе формулы молярной концентрации эквивалентов:
 г
г
Если взять навеску не точно – 0,2452, а допустим – 0,2646 г, то введем поправочный коэффициент:

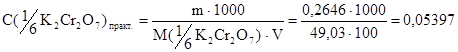 моль-экв/л
моль-экв/л
Для приготовления многих стандартных растворов применяют фиксаналы. Фиксаналы – точно отвешенные массы твердых веществ или точно отмеренные объемы их растворов, помещенные в запаянные стеклянные ампулы. Фиксаналы (стандарт-титры) служат для приготовления первичных стандартов. Фиксанал - это запаянная стеклянная ампула с количеством вещества, необходимого для приготовления 1 дм3 раствора с молярной концентрацией эквивалентов, равной 0,1 моль/дм3. Промышленность выпускает фиксаналы с различными веществами как в виде растворов (серная, соляная кислоты; гидроксиды калия и натрия), так и в виде сухих веществ (перманганат калия, карбонат или оксалат калия). В коробочке с фиксаналами имеется стеклянный боек и острая стеклянная палочка. Приготовление раствора из фиксанала заключается в том, чтобы количественно перенести содержимое ампулы в мерную колбу емкостью 1дм3, растворить, довести объем до метки дистиллированной водой и тщательно перемешать.
Вторичные стандарты
Часто используют растворы, которые невозможно приготовить с точной концентрацией, т.е. по точной навеске. Такие растворы называют вторичные стандартные растворы – титрованные, стандартизованные рабочие растворы.
Если нужно приготовит раствор точно известной концентрации из вещества, не удовлетворяющего требованиям первичного стандарта, то готовят раствор с приблизительной концентрацией, близкой к требуемой, либо разбавлением концентрированных растворов (растворы HCl, H2SO4, NaOH), либо по приблизительной навеске (растворы KMnO4, Na2S2O3, I2, ЭДТА и др.), и затем с помощью первичных стандартов титриметрически определяют точную концентрацию этого вещества (стандартизируют).
Приготовление вторичных стандартов
Для приготовления растворов разбавлением концентрированных растворов ареометром измеряют плотность исходного раствора вещества А, по таблице справочника находят соответствующую плотности процентную концентрацию (С %). Рассчитывают, какой объем (V1) раствора нужно взять для разбавления его до заданного объема V с концентрацией С:
 (12)
(12)
Например, нужно приготовить 500 мл 0,1 моль-экв/л раствора HCl из его концентрированного равствора. Плотность исходного раствора составила  ρ = 1,18 г/мл. По справочнику С % (HCl) = 36,2 %. Тогда по выше приведенной формуле получим:
ρ = 1,18 г/мл. По справочнику С % (HCl) = 36,2 %. Тогда по выше приведенной формуле получим:
 мл
мл
Рассчитанный объем отмеряют цилиндром и выливают в бутыль, в которую предварительно налито некоторое количество дистиллированной воды и затем разбавляют раствор до нужного объема дистиллированной водой и тщательно перемешивают.
Для приготовления раствора по приблизительной навеске рассчитывают массу (m) исходного вещества А, которую нужно взять для приготовления заданного объема (V) с концентрацией С(fэкв.(А), А) по формуле:
 (см. 10)
(см. 10)
Например, нужно приготовить 500 мл 0,05 моль-экв/л раствора KMnO4. На основании уравнения полуреакции:
MnO4- +5ê + 8H+↔Mn2+ + 4H2O (6)
Находят молярную массу эквивалента KMnO4:
 .
.
Далее рассчитываем навеску:
 г.
г.
Взвешивают навеску в сухом стаканчике или бюксе на технических весах, переносят в бутыль, растворяют в дистиллированной воде, доводят до заданного объема.
ВОПРОС 13
Кислотно-основное титрование в водной и неводной среде – наиболее широко применяемый в фармацевтическом анализе метод. Его используют для определения более 40% фармакопейных лекарственных препаратов.
Кислотно-основное титрование в водных средах применяется в анализе неорганических и органических веществ, обладающих кислотно-основными свойствами: сильных и слабых кислот и оснований, кислых и основных солей, а также солей, содержащих анионы слабых кислот и катионы слабых оснований. Модифицированными способами, включающими кислотно-основное титрование (обычно на заключительном этапе анализа), можно анализировать и соединения, не обладающие выраженными кислотно-основными свойствами.
Ацидиметрию применяют для определения натриевых солей неорганических и органических кислот (натрия гидрокарбонат, натрия тетраборат, калия ацетата, натрия бензоат, натрия салицилат, натрия n-аминосалицилат, кофеина-бензоат натрия и др.).
Алкалиметрию используют для количественного определения лекарственных веществ, представляющих собой неорганические (соляная, борная) и органические (уксусная, лимонная, глутаминовая, аскорбиновая, никотиновая) кислоты, а также веществ сложной гетероциклической структуры, содержащих карбоксильную группу.
С помощью кислотно-основного титрования можно определять содержание аммиака в солях аммония. Поскольку непосредственно титровать соль аммония щелочью нельзя из-за отсутствия скачка рН на кривой титрования, применяют метод обратного титрования и метод замещения.
Соли органических оснований (в том числе алкалоидов, витаминов) определяют по связанной соляной, азотной или фосфорной кислоте (хинозол, секуринина нитрат, пиридоксина гидрохлорид и др.). Титруют щелочью также лактаты, гидротартраты органических оснований.
Один из используемых в фармацевтическом анализе вариантов кислотно-основного титрования состоит в сочетании реакции нейтрализации с предварительной этерификацией или гидролизом. Так, некоторые спирты (глицерин, ментол) и производные фенолов (фенолфталеин, синэстрол) ацетилируют уксусным ангидридом. Избыток уксусного ангидрида, нагревая с водой, превращают в уксусную кислоту, которую титруют раствором гидроксида натрия.
Титрование в смешанных растворителях, состоящих из воды и органических растворителей, применяют тогда, когда препарат плохо растворим в воде или водные растворы имеют слабо выраженные кислотные (основные) свойства. Так, при алкалиметрическом титровании плохо растворимых в воде органических кислот (салициловой, ацетилсалициловой, бензойной) растворителем служит спирт, титрантом – водный раствор гидроксида натрия. В спиртоацетоновой среде титруют соляной кислотой натриевые соли сульфаниламидных препаратов.
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ
(ПРОТОЛИТОМЕТРИЯ)
Кислотно-основным называется титриметрический метод анализа, основанный на использовании протолитических реакций. Кислотно-основное титрование может проводиться как в водной среде, так и в неводных растворителях.
В основе метода кислотно-основного титрования лежит протолитическая реакция: SH2+ + S- → 2SH, где S – растворитель, в частности, в водных растворах: Н3О+ + ОН- → 2Н2О.
Метод кислотно-основного титрования применим для определения концентрации кислот (алкалиметрия), оснований (ацидиметрия), амфолитов, азота и серы в органических соединениях.

Кислотно-основные реакции – частный случай равновесия в гомогенной системе, поэтому расчеты равновесных концентраций компонентов реакции основаны на использовании закона действующих масс и условия материального баланса. Кислотность раствора является главным фактором, влияющим на протекание химических реакций. Характеризует кислотность водородный показатель (рН) – отрицательный десятичный логарифм активности ионов водорода (рН=-lgaH+). В приближенных расчетах коэффициенты активности принимаются равными единице, тогда: рН=-lg [H+], где р – символ отрицательного десятичного логарифма (рХ= -lgХ). Аналогично можно считать, что рОН=-lg [ОH-]. Таким образом, для расчета рН в исследуемом растворе нужно определить концентрацию ионов водорода [H+].
Известно, что кислоты и основания по их способности к диссоциации подразделяют на сильные (диссоциированы в растворе практически нацело) и слабые (диссоциированы незначительно). [H+] в растворе сильной кислоты равна концентрации этой сильной кислоты. Следовательно, рН=-lgСНА.
В растворе сильного основания вычисляют концентрацию ОН--ионов. [ОН-] в растворе сильного основания равна концентрации этого сильного основания. Следовательно, рОН = -lgСВ., рН=14-рОН.
Для расчета рН растворов слабых кислот, следует учитывать степень диссоциации слабой кислоты  , где
, где  – константа диссоциации слабой кислоты; СНА – концентрация слабой кислоты.
– константа диссоциации слабой кислоты; СНА – концентрация слабой кислоты.
Если степень диссоциации кислоты мала (h<5%), то можно полагать, что равновесная концентрация недиссоциированной кислоты равна ее общей концентрации. Тогда концентрация ионов водорода равна:

Если степень диссоциации кислоты h > 5%, то равновесная концентрация недиссоциированной кислоты не может быть приравнена к ее общей концентрации. Тогда концентрацию ионов водорода вычисляют по формуле:

В сильно разбавленных растворах кислот (при C < 10-4 M) следует учитывать диссоциацию растворителя, поэтому расчет концентрации ионов водорода ведут по формуле:

Для расчета рН растворов слабых оснований, следует учитывать степень диссоциации слабого основания 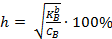 , где
, где  - константа диссоциации слабого основания, а
- константа диссоциации слабого основания, а  - концентрация слабого основания.
- концентрация слабого основания.
Если степень диссоциации основания мала (h <5 %), то можно полагать, что равновесная концентрация недиссоциированного основания равна его общей концентрации. Тогда концентрация гидроксид-ионов равна:
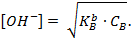
Если степень диссоциации основания h > 5%, то равновесная концентрация недиссоциированного основания не равна его общей концентрации, поэтому
 .
.
Далее идет расчет рОН = –lg[OН-] и рН=14 – рОН.
В сильно разбавленных растворах оснований (при C < 10-4 M) следует учитывать диссоциацию растворителя, поэтому расчет концентрации гидроксил-ионов ведут по формуле:
 .
.
Определение конечной точки титрования в методе кислотно-основного титрования основано на резком изменении величины рН вблизи точки эквивалентности. Конечную точку титрования устанавливают с помощью индикаторов, изменяющих свою окраску в зависимости от рН раствора.
Первичными стандартными растворами для определения концентрации кислотслужат растворы декагидрата тетрабората натрия (Na2B4O7•10H2O) и карбоната натрия (Na2CO3); для определения концентрации оснований – растворы щавелевой (Н2С2О4•2Н2О) или янтарной (С2Н4(СООН)2) кислот. В качестве вторичных стандартных растворов применяют чаще всего растворы НCl и NaOH.

Стандартные растворы HCl и H2SO4 устойчивы при хранении. Их хранят при обычных условиях в закрытой посуде. Растворы щелочей поглощают CO2 из воздуха, поэтому их следует хранить в плотноукупоренной таре. Для предотвращения взаимодействия щёлочи и CO2 растворы защищают с помощью трубки, заполненной оксидом кальция или натронной известью. Исходный образец щёлочи, например, NaOH может содержать некоторое количество карбоната в качестве примеси. Для того чтобы получить раствор, свободный от этой примеси, поступают следующим образом: в свежепрокипячённой воде растворяют определённую навеску NaOH, так чтобы получился концентрированный раствор этого вещества. Полученный раствор оставляют на некоторое время в плотно укупоренной посуде. Карбонат натрия плохо растворим в концентрированном растворе NaOH и выпадает в виде осадка. Через некоторое время прозрачный раствор сливают с осадка и разбавляют до необходимой концентрации свежепрокипячённой водой. Растворы щелочей, особенно концентрированные, не рекомендуется хранить в стеклянной посуде.



 К2С r 2 O 7) = М ( K2Cr2O7)∙fэкв. (K2Cr2O7) = 294,19∙
К2С r 2 O 7) = М ( K2Cr2O7)∙fэкв. (K2Cr2O7) = 294,19∙  г
г
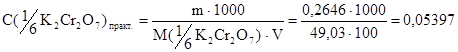 моль-экв/л
моль-экв/л (12)
(12) ρ = 1,18 г/мл. По справочнику С % (HCl) = 36,2 %. Тогда по выше приведенной формуле получим:
ρ = 1,18 г/мл. По справочнику С % (HCl) = 36,2 %. Тогда по выше приведенной формуле получим: мл
мл (см. 10)
(см. 10) .
. г.
г.
 , где
, где  – константа диссоциации слабой кислоты; СНА – концентрация слабой кислоты.
– константа диссоциации слабой кислоты; СНА – концентрация слабой кислоты.


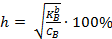 , где
, где  - константа диссоциации слабого основания, а
- константа диссоциации слабого основания, а  - концентрация слабого основания.
- концентрация слабого основания.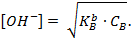
 .
. .
.


