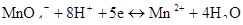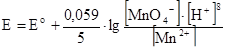1. Потенциал ОВ системы зависит от концентрации окисленной и восстановленной форм.
2. Потенциал ОВ системы зависит от ионной силы раствора.
Чем меньше ионная сила раствора и заряд ионов, тем меньше различие Ео и Еo/.
3. Потенциал ОВ системы зависит от кислотности раствора.
Если в реакции окисления-восстановления принимают участие ионы водорода, необходимо записывать их концентрацию в соответствующей степени в числителе:
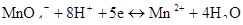
Уравнение Нернста имеет вид:
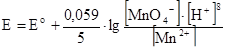
Таким образом, увеличение концентрации ионов водорода приводит к возрастанию ОВ потенциала.
4. Потенциал ОВ системы зависит от конкурирующих реакций.
Существенное влияние на потенциал оказывают любые побочные химические реакции, в которых участвует окисленная и восстановленная формы. Наиболее часто такими реакциями являются реакции комплексообразования. Довольно часто более склонны к реакциям комплексообразования окисленная форма, в результате чего потенциал системы, и следовательно окисленные свойства уменьшаются.
Механизм и кинетика окислительно-восстановительных реакций. Каталитические и индуцированные реакции. Примеры. Чем индуктор отличается от катализатора?
Химические реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. В этих реакциях происходит обмен (перенос) электронов от одних реагирующих веществ к другим.
Степень окисления – условный заряд элемента в соединении, который вычисляется в предположении, что химические связи между элементами являются ионными. Заряды атомов кислорода принимают равными -2, в пероксидных соединениях – равным -1; заряд элементов первой группы +1, заряд атома водорода +1, а в гидридах металлов -1.
Принято обозначать степень окисления цифрой с указанием: «плюс», «минус».
В качестве примера окислительно-восстановительной реакции приведем уравнение реакции взаимодействия между H2S и HClO:
-2 +1 -1 0
H2S и HClO=HCl+S↓+H2O
В приведенной реакции происходит понижение степени окисления окислителя (Cl++2ē= Cl-) и повышение степени окисления восстановителя
(S2--2 ē=S0). В приведенном примере HClO является окислителем, а H2S- восстановителем.
Восстановитель - это частица, отдающая электрон, окислитель - принимающая электрон. Окисление - процесс отдачи электронов, восстановление - процесс приема электрона.
Окисление и восстановление – взаимосвязанные процессы, так как вещества могут отдавать электроны только в том случае, если в реакции участвует другое вещество, способное электроны принимать, что определяет закон сохранения заряда в химических реакциях.
Окислительные свойства могут проявлять как простые, так и сложные вещества. К типичным (сильным) окислителям относятся фтор, галогены, кислород, а так же КClO3, НClO3, HNO3, H2SO4 (конц), MnO2, KMnO4, K2Cr2O7, PbO2 и др.
Восстановителями являются металлы, Н2, С (графит), HCl(конц), KI, KBr, H2S, CO, FeSO4.
Всегда восстановитель – это атом (частица) с максимально возможным числом электронов. Окислитель - это атом (частица) с минимально возможным числом электронов.
Пример:
| Мn0
| Мn+2, Мn+3, Мn+4, Мn+5, Мn+6 ,
| Мn+7
|
| всегда восстановитель
| состояние атома в окислительно-восстановительной двойственности
| всегда окислитель
|
Есть вещества, способные проявлять и окислительные и восстановительные свойства. К ним относятся вещества, в состав которых входят атомы элементов в промежуточных степенях окисления. Под действием окислителей они могут повышать свою степень окисления, проявляя восстановительные свойства, а при реакциях с восстановителями – понижать степень окисления, проявляя окислительные свойства. К таким веществам относятся KNO2, H2O2, SO2, Na2SO3 и др.
Катализом называют явление изменения скорости термодинамически возможной химической реакции под влиянием катализаторов — веществ, участвующих в реакции, но остающихся в неизменном составе и количестве после ее завершения.
Все каталитические процессы подразделяют на две группы: гомогенные и гетерогенные. К гомогенным относятся процессы, в которых реагирующие вещества и катализатор находятся в одной фазе и образуют гомогенную систему.
Гомогенный катализ можно разделить на кислотно-основной,окислительно-восстановительный,координационный, газофазный и ферментативный.
Примером газофазного катализа является окисление SO2 кислородом в присутствии катализатора NO2:
кат NO2
2SO2 + O2 → 2SO3
Окислительно-восстановительныереакции, в которых участвуют несколько окислительных форм, часто протекают по механизму автокаталитических. Катализатором в таких реакциях является один из ее продуктов.
В качестве примера автокаталитической реакции можно рассмотреть окисление щавелевой кислоты перманганатом калия:
2KMnO4 + 5H2C2O4 + 3H2SO4 →2MnSO4 + K2SO4 + 10CO2 + 8H2O
или в ионной форме
+ 2+
2MnO−4 + 5H2C2O4 + 6H → 2Mn + 10CO2 + 8H2O
Реакция является многостадийной, одна из промежуточных стадий — образование иона Mn3+:
MnO−4 + 4Mn2+ + 8H+ → 5Mn3+ + 4H2O
который окисляет щавелевую кислоту H2C2O4.
Стадия окисления H2C2O4 ионом Mn3+ является лимитирующей для реакции в целом:
H2C2O4 + 2Mn3+ → 2Mn2+ + 2CO2 + 2H+
Введение в реакционную смесь дополнительного количества иона Mn2+ приводит к увеличению концентрации иона Mn3+ и тем самым ускоряет реакцию.
В гетерогенных процессах катализатор представляет собой самостоятельную фазу, граничащую с фазой реагентов. В этом случае каталитическая реакция протекает на поверхности раздела фаз: газ — твердое тело, жидкость — твердое тело, жидкость — газ. Наибольшее практическое значение имеют каталитические реакции, в которых катализатор находится в твердой фазе, а реагенты — в жидкой или газообразной.
69
Примером гетерогенного каталитического процесса является окисление оксида серы (IV) кислородом в присутствии твердого оксида ванадия (V):
кат V2O5
2SO2 + O2 → 2SO3
Переходные металлы (Pt, Fe, V, Mn, Ni и др.) и их соединения обладают хорошими каталитическими свойствами, что объясняется недостроенностью их электронных d-оболочек.
Можно выделить следующие общие закономерности каталитических реакций.
Катализатор не влияет на положение термодинамического равновесия. Он в одинаковой степени изменяет константы скорости прямой и обратной реакций и только ускоряет наступление равновесия. Катализатор не входит ни в состав исходных веществ, ни в продукты реакции, поэтому он не оказывает влияние на изменение энергии Гиббса реакции ∆rG0, являющейся функцией состояния. Следовательно, катализатор не может вызвать протекание реакций, которые в данных условиях термодинамически невозможны (∆rG0 > 0), а может увеличить скорость реакции лишь в том случае, если ∆rG0 < 0.
Действие катализатора заключается в том, что он образует с реагирующими веществами промежуточный комплекс, который затем разрушается с образованием продуктов реакции, а сам катализатор освобождается и переходит в исходное состояние.
Основной причиной увеличения скорости в каталитической реакции является значительное уменьшение энергии активации реакции Еакт.
Скорость каталитической реакции, как правило, пропорциональна концентрации катализатора (гомогенный катализ) или площади поверхности катализатора (гетерогенный катализ). Например, пероксид водорода в водном растворе медленно разлагается на воду и кислород по уравнению:
Н2О2 → Н2О + 1/2 О2
Энергия активации этой реакции составляет 75,6 кДж/моль. В присутствии ионов трехвалентного железа Fe3+ энергия активации уменьшается до 54,6 кДж/моль. Наименьшее значение энергии ак-
70
тивации соответствует каталитическому разложению в присутствии биологического катализатора фермента каталазы — 20 кДж/моль. В его присутствии скорость реакции увеличивается приблизительно в 108 раз по сравнению с некаталитической реакцией.
Катализаторы по своему действию селективны, т. е. избирательны. Катализатор увеличивает скорость преимущественно одной из возможных реакций, не оказывая заметного влияния на скорость других реакций.

Индуцированные реакции. Явление «химической индукции» заключается в том, что реакция (индуцированная), протекающая в данных условиях чрезвычайно медленно, вызывается только одновременным протеканием другой реакции (первичной). Различаются два класса индуцированных реакций: индуцированные цепные и сопряженные реакции