При популяционных исследованиях и для распознавания таксономических групп рыб в современной ихтиологии используется несколько методов, в том числе вариационно-статистический, цитогенетический, генетико-биохимический и популяционно-фенетический.
Вариационно-статистический метод
Достаточно надежным средством для распознавания таксономических групп рыб является вариационно-статистический метод, включающий описательную характеристику рыб и математическую оценку каждого признака (Аббакумов, 1997; Кириллов, 2002).
Методы вариационной статистики освещены в руководствах и учебниках (Майр и др., 1956; Майр, 1971; Плохинский, 1980; Андреев и Решетников, 1977; Снедекор, 1961; и др.), которыми пользуются отечественные ихтиологи. Этими методами можно характеризовать любую выборку (группу рыб) по основным статистическим показателям, используя метод случайного отбора рыб для биологического анализа.
Обычно, если материала достаточно, анализируют однородные выборки, включающие 50 экз. Такой объем позволяет получить достоверные статистические показатели биологических характеристик при заданном уровне значимости, достаточно обоснованно оценить общую изменчивость вида, а также выяснить природу и степень внутри- и межпопуляционной его изменчивости.
Первоначальная интерпретация исходной цифровой информации сводится к изучению распределения признака в выборке, построению вариационных рядов, определению величины классового промежутка и частоты встречаемости особей по каждому классу и по каждому признаку.
Построение вариационных рядов и анализ кривых распределений позволяет лучше увидеть свой материал и оценить его биологическую сущность.
Построение простых кривых распределения общеизвестно. Обычно по оси абсцисс откладываются абсолютные показатели признака, по оси координат - относительные (встречаемость этого признака в %).
Когда вариационная кривая имеет не одну, а, например две-три вершины, можно предположить, что исследуемый материал представляет собой генетически неоднородную группу особей. Анализ кривых распределения признака всегда полезен как контроль математической оценки результатов измерений.
В биологических исследованиях для статистической обработки большой исходной цифровой информации применяются математические формулы, которые являются алгоритмами многих программ, разрабатываемых ЭВМ разных систем.
Для оценки степени сходства двух и более популяций рыб применяется показатель трансгрессии, который выражает долю перекрывающихся наблюдений в сумме обоих распределений при попарном сравнении морфологических признаков у одновозрастных выборок.
Изучению достоверности различий двух или нескольких выборок в последнее время придается большое значение, поскольку не выработана единая оценка достоверности различий между выборками, а это осложняет сравнение литературных материалов разных авторов и использование их в таксономических работах.
Критерии Mdiff (Правдин, 1966), которым пользовались отечественные ихтиологи много лет, становится неубедительным, так как применяется в основном только для проверки гипотезы о равенстве средних значений признака в двух выборках и не может быть использован в качестве показателя таксономической близости или расхождения (Андреев, Решетников, 1977). Поэтому при выборе оценки достоверности различий между выборками рассмотрен ряд параметрических критериев: критерий Стьюдента, НСР или LSD (наименьшая существенная разность), и коэффициент различия CD. Все эти критерии имеют существенные недостатки, поскольку ни один из них не может охарактеризовать границу генеральной средней для данной выборки.
Критерий Стьюдента (tst) является традиционным- им пользуются многие авторы. Критерий рассчитывается по формуле (64):
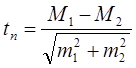 (64)
(64)
или (согласно обозначениям статистических показателей, применяемых нами):
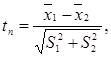
где М 1 и М 2 или 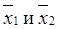 – средние значения признака;
– средние значения признака;
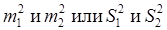 – квадраты стандартной ошибки (или ошибки средней).
– квадраты стандартной ошибки (или ошибки средней).
Критерий Стьюдента только показывает, существуют ли различия между двумя вариантами (выборками), но не оценивает величины различий и не определяет их границ.
Наименьшая существенная разность (НСР), определяемая по формуле
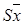 ·tp·
·tp· 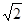 , где Sx - стандартная ошибка, tp - критерий Стьюдента при заданной вероятности, оценивает только разницу между средними.
, где Sx - стандартная ошибка, tp - критерий Стьюдента при заданной вероятности, оценивает только разницу между средними.
Факторный анализ одновременно оценивает дисперсию или разброс, многих признаков, или объектов и, концентрируя информацию большого числа признаков в нескольких факторах, существенно облегчает решение проблем классификации. Используя факторный анализ, можно отделить существенные признаки от несущественных, определить их информативность, взаимосвязь и заменяемость, количественно охарактеризовать диагностическую ценность и т. д.
Факторный анализ практически реализуют только с помощью ЭВМ. Коэффициент различия (coefficient of difference, CD) представляет собой отношение разности средних к сумме стандартных (среднеквадратических) отклонений выборок и определяется по формуле (65):
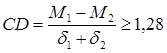 (65)
(65)
или (согласно нашим обозначениям средних и стандартных отклонений):
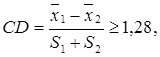
где М 1 и М 2 или 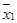 и
и 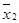 – средние значения признаков двух сравниваемых выборок;
– средние значения признаков двух сравниваемых выборок;
δ 1 и δ 2 или S 1 и S 2 – стандартные (среднеквадратические) отклонения этих признаков;
1,28 – принятый показатель подвидового различия.
Коэффициент различия в отличие от критерия Стьюдента (tst) оценивает величину различия, а поэтому широко применяется в популяционных исследованиях. Сейчас принято считать выделение подвида оправданным при CD более 1,28 и, вероятно, не менее 1,5.
Для более строгой и точной оценки существенности различий между выборками и установления границ генеральной средней по изучаемым признакам используется доверительный интервал, который рассчитывается по формуле (66):
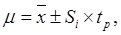 (66)
(66)
где μ – средняя генеральной совокупности;
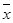 – средняя выборки;
– средняя выборки;
Si – стандартная ошибка;
tp – критерий Стьюдента при заданной вероятности и в соответствии со степенями свободы.
Средние значения признаков и границы доверительных интервалов генеральной средней позволяют более точно определить значения каждого признака в отдельности и выявить достоверные различия между выборками по изучаемым признакам. Именно эти показатели наряду с другими статистическими показателями могут быть в комплексе использованы в качестве критерий для выявления информативных таксономических критерий для выявления информативных таксономических признаков, характеризующих морфологическую специфику вида при изучении систематики рыб.
Имея натурный материал и зная математическое обеспечение, составляются компьютерные программы для статистической обработки. Окончательный этап работы заключается в научной интерпретации полученных данных.
Цитогенетический метод (цит. по А.Н. Макоедову)
Как известно, термин «кариотип» предложил отечественный цитолог и ботаник Г. А. Левитский, опубликовав в 1931 г. работу «Морфология хромосом и понятие «кариотипа» в систематике». Макоедов А.Н.(1999) на основании собственных и литературных данных высказал мысль, что эволюция организмов обычно идет двумя путями. В первом случае кариотип может оставаться практически неизменным у сильно дивергировавших групп. Во втором, существенные кариологические отличия могут проявляться у близких видов. По мере развития техники кариотипирования и расширения работ в этом направлении стало ясно, что в эволюционных преобразованиях хромосомного набора определяющее значение имеет наличие системы запретов и разрешений на те или иные типы хромосомных перестроек (White, 1973; Викторовский, 1978). Исследования последних лет еще раз показали, что кариотип в ряде случаев может выступать интегрирующим признаком для целых родов и даже семейств (Анбиндер, 1980, Васильев, 1985; Макоедов, 1987а, 1999). Известны примеры противоположных ситуаций, когда внутри родов (например, Oncorhynchus) виды четко дифференцированы по кариологическим признакам.
До сих пор остается дискуссионным вопрос о селективной значимости наблюдаемых изменений хромосомных наборов. Часть авторов придерживается мнения о том, что кариотип выступает как автономная система, не подверженная непосредственному адаптивному воздействию факторов среды (Воронцов, 1958; Орлов, 1974; Викторовский, 1978). В ряде публикаций, напротив, содержатся предположения, согласно которым признаки кариотипа связаны со степенью специализации форм (Воронцов, 1966), с географической зональностью и некоторыми другими факторами среды (Никольский, Васильев, 1973; Васильев, 1985). При обсуждении упомянутой проблемы речь обычно идет о таких признаках кариотипа, как число хромосом и количество хромосомных плеч. Тем не менее, есть основания полагать, что интерес к данному вопросу проявится с новой силой по мере накопления сведений, полученных с использованием методик дифференциального окрашивания хромосом. По крайней мере, установлено, что у некоторых видов гетерохроматиновые районы полиморфны (Craig-Holmes et al., 1971; Chen, Ruddle, 1971; Shaw, 1971; Дыбан, Удалова, 1974; Yosida, 1977; MacGregor, Homer, 1980). Это, в свою очередь, может приводить к изменчивости положения хиазм, а, следовательно, и точек рекомбинаций. Высказано предположение, что изменения, вызываемые преобразованиями генома в результате перераспределения хиазм и рекомбинаций генов, могут в большей мере влиять на изменчивость особей в популяции, чем мутационный процесс (Прокофьева-Бельговская, 1986). Различие в содержании гетерохроматина в гетерохроматических районах хромосом, как следует из цитируемой работы, носит отчетливый приспособительный характер.
В основном эволюция кариотипа может идти двумя путями. Во-первых, за счет уменьшения или увеличения количества хромосом в наборе при неизменном числе хромосомных плеч. Во-вторых, за счет увеличения или уменьшения числа хромосомных плеч при постоянстве числа хромосом. Надо отметить, что в действительности эти тенденции в различной степени дополняют друг друга в ходе эволюции хромосомных наборов той или иной группы. Одним из наиболее распространенных механизмов эволюционных изменений кариотипа являются робертсоновские преобразования. В общем виде процесс можно изобразить как А+А=М. То есть, две акроцентрические (одноплечие) хромосомы, соединяясь своими центромерными участками, формируют одну двуплечую (метацентрическую) хромосому, или одна двуплечая хромосома разделяется на две акроцентрические. Представления о самом механизме этих процессов долгое время были весьма противоречивыми, так как отсутствовали данные о способности центромеры к разрывам или слияниям без потери ее активности. Поэтому некоторые исследователи считали, что разделению двуплечих хромосом должно было предшествовать появление в наборе сверхкомплектной хромосомы (Навашин, Чуксанова, 1970; White, 1973). С другой стороны, достаточно распространенным стало мнение (Викторовский, 1978) о том, что перестройки, ведущие к образованию метацентрических хромосом, происходят в эволюции сравнительно легко, так как для этого не требуется возникновения центромер de novo (Навашин, 1985). Более детальное обсуждение возможных эволюционных преобразований кариотипа, связанных с робертсоновским процессом, выходит за рамки данной paботы. По этому вопросу существуют специальные публикации (Hsu, Mead, 1969; Hsu et al., 1975; Раджабли, Графодатский, 1977; Сафронова,Лемин, 1978; Раджабли и др., 1979; Демин и др., 1984).
Кроме робертсоновских преобразований, изменение кариотипа может идти за счет теломерных соединений хромосом. Как показали исследования, выполненные на млекопитающих (Hsu et al., 1975), хромосомы могут соединяться не только своими теломерными концами, но и теломерными концами с центромерными участками. В результате таких перестроек не было обнаружено утери каких-либо сегментов (Therman et al., 1974), а вновь возникшая хромосома в большинстве случаев имела лишь одну центрическую перетяжку. Однако в некоторых клетках такая хромосома оказывалась дицентрической (Прокофьева-Бельговская, 1986). Теломерные соединения хромосом могут вызывать различные варианты изменений, происходящих в процессе эволюции кариотипа: изменение числа и морфологии хромосом, изменение количества хромосомных плеч. Число плеч может изменяться также за счет перицентрических инверсий.
Выше были перечислены основные механизмы эволюционных преобразований кариотипа, которые обуславливают лишь перераспределение хромосомного материала и не связаны с нарушением генетического баланса. Тем не менее, существует ряд публикаций, в которых исследователи объясняют те или иные изменения кариотипа элиминациями хромосом или целых групп хромосом. Достаточно сослаться лишь на некоторые работы по кариологии лососевидных рыб (Баршене, 1980; Горшкова, 1980; Черненко, 1980; Северин, 1986). Высказаны предположения о наличии у данной группы рыб неких уникальных механизмов, обуславливающих эволюционные преобразования кариотипа, что, по мнению некоторых авторов (Митрофанов, 1983), отличает лососевидных от других рыб. Не прибегая к подробному анализу упомянутых точек зрения, следует все-таки заметить, что в основе таких рассуждений лежат данные, полученные с использованием недостаточно совершенных методик тотального окрашивания хромосом.
Обсуждая вопрос об эволюционных преобразованиях кариотипа, невозможно оставить без внимания проблему хромосомной изменчивости на видовом и популяционном уровнях. Для некоторых видов доказано, что в клетках, связанных общностью своего происхождения, относительное расположение хромосом не случайно. Более того, каждая хромосома устойчиво сохраняет свое положение относительно прочих не только в метафазе, но и в промежутках между делениями. Вне зависимости от убедительности той или иной модели, объясняющей порядок расположения хромосом (Щапова, 1969; Беннет, 1986), можно с достаточной уверенностью считать, что высокоупорядоченное относительное расположение каждой хромосомы в гаплоидном геноме определяется, прежде всего, размером ее плеч. Полиморфизм допустим, но в пределах правил, которым подчинен общий порядок (Беннет, 1986). Можно заметить, что все изменения, связанные с робертсоновскими перестройками и перицентрическими инверсиями (то есть те, которые выявляются при тотальном окрашивании хромосом), в эти правила не укладываются. Отсюда следовало бы ожидать, что случаи полиморфизма по робертсоновским слияниям-разделениям и перицентрическим инверсиям на видовом и популяционном уровнях должны встречаться довольно редко. По-видимому, так оно и есть. Во всяком случае, В.П. Васильев (1985) считает, что хромосомный полиморфизм доказан лишь у 12 видов рыб из почти 1400 исследованных кариологически к середине 80-х годов. Достаточно надежным заключениям о распространении хромосомного полиморфизма у рыб должен предшествовать тщательный критический анализ опубликованного первичного материала, то есть фотографий метафазных пластинок.
Кроме того, нельзя не учитывать, что отклонения количества хромосом на получаемых метафазных пластинках от модального значения могут быть обусловлены влиянием используемых методик. В частности, известно, что под воздействием колхицина возможны отставания в ходе митоза отдельных хромосом или их групп (Залкинд, 1966). К тому же, не исключена возможность неравномерного перехода хромосом из метафазы в анафазу (Босток, Самнер, 1981), а также гетероцикличность родительских хромосом (Прокофьева-Бельговская, 1946). В том случае, если продвижение хромосом в митотическом цикле асинхронно, на разных метафазных пластинках может быть зафиксировано различное количество хромосом. При опережающем переходе в анафазу части двуплечих хромосом на фоне неизменного числа плеч будет отмечено увеличение числа хромосом. В такой ситуации довольно легко сделать ошибочные заключения о полиморфизме по центрическим слияниям Если же в первую очередь расхождение к полюсам начнут одноплечие хромосомы, то на фиксированных метафазных пластинках измененным кажется и число хромосомных плеч. Каков бы ни был генезис асинпонности в митотическом цикле, следует ожидать большую выраженность вызванных ею изменений числа и морфологии элементов у многохромосомных объектов. На метафазных пластинках, полученных с использованием колхициновых методик, асинхронность будет проявляться лишь в период начала расхождения к полюсам делящейся клетки самых «быстрых» хромосом. В принципе, нельзя, конечно, исключить, что асинхронность находится под контролем определенных генов. Если это так, то речь может идти о полиморфизме именно по моменту разделения тех или иных хромосом, что вряд ли тождественно отмеченному в упомянутых выше работах полиморфизму по числу хромосом и хромосомных плеч. Однако в любом случае предполагаемая асинхронность представляется вполне вероятной, так как она дает удовлетворительное объяснение многим наблюдаемым изменениям кариотипа, не вступая в противоречия с представлениями о сбалансированности генома.
Из всего изложенного выше становится понятно, какие разнообразные препятствия стоят на пути возникновения и выявления любых изменений кариотипа. Отсюда очевидна и та сложность, с которой сталкивается исследователь при решении вопроса о наличии или отсутствии цитогенетических различий между особями, популяциями, кариологически близкими видами. Кроме отсутствия отчетливых представлений о многих особенностях митотического цикла, всегда следует учитывать реально существующую ошибку метода. Понятно, что величина такой ошибки зависит от количества хромосом в кариотипах интересующих объектов и качества получаемых препаратов. В то же время вряд ли следует отрицать саму возможность существования изменчивости в пределах популяции или вида. Наиболее безупречными доказательствами здесь пока являются примеры описания полиморфизма по числу добавочных хромосом (Hafez et al., 1981; Pauls, Bertollo, 1983; Falcao et al., 1984; Фролов, 1986а, б). Кроме того, хромосомная изменчивость может быть обусловлена различиями между полами (Uyeno, Miller, 1971, 1972; Thorgaard, 1978, 1983; Bertollo et al., 1983; Pezold, 1984; Фролов, 1991, 1997) или являться отражением эффекта расширения генотипического разнообразия на ранних стадиях онтогенеза (Животовский, 1984). Можно также согласиться с мнением С. В. Фролова (1988), который считает, что у лососевидных рыб встречаются еще два типа хромосомной изменчивости: робертсоновский полиморфизм и изменчивость размеров ядрышкообразующих районов хромосом. Вероятно, именно перечисленные типы определяют как хромосомный полиморфизм у лососевидных, так и являются наиболее распространенными в процессе эволюции этой группы рыб.
Отловленной рыбе производили инъекцию 0,5%-ного раствора колхицина в мышцу спины и выдерживали в живом виде от 6 до 12 часов. Затем рыбу забивали и обескровливали. Извлекали надпочечник и жаберные лепестки. Эти ткани гипотонировали либо в 0,9%-ном растворе трехзамещенного цитрата натрия, либо в дистиллированной воде. Среднее время гипотонирования для жаберных лепестков – 20-30 минут, для кусочков надпочечника – 45-60 минут. После этого материал помещали в фиксатор, состоящий из трех частей 96%-ного этилового спирта и одной части ледяной уксусной кислоты.
При изготовлении давленых препаратов на покровных стеклах окраску обычно проводили 2%-ным раствором орсеина в 60%-ной уксусной кислоте с последующим проведением через изобутиловый спирт и ксилол. Затем подсушенные препараты заключали в канадский бальзам. Материал, нанесенный на предметные стекла, окрашивали азур-эозином по Романовскому, следуя методике, подробно изложенной в работе Д. Хаймена и А. Полдинга (1976). Поиск метафаз производили под микроскопом. Большинство исследованных нами рыб имели, как правило, очень низкую митотическую активность в клетках жаберного эпителия и надпочечника. Отобранные для последующего анализа метафазные пластинки фотографировали на пленку «Микрат-300» или «Микрат-200». По изготовленным фотоотпечаткам проводили составление кариограмм, придерживаясь общепринятой классификации морфологических типов хромосом (Levan et al., 1964).
Генетико-биохимический метод
Начальные этапы развития биохимической генетики связаны с работами, выполненными во второй половине 50-х годов нашего столетия (Smithies, 1955, Hunter, Markert, 1957; Meller, 1959). Именно тогда были разработаны способы, позволяющие проводить электрофоретическое разделение белков и гистохимическое окрашивание электрофореграмм. Был предложен новый метод, достаточно надежный, простой и пригодный для массовых анализов. Оказалось, что большинство ферментов (которые и являются основой для изучения генетической изменчивости хариусов в нашем случае) представлены у животных и растений несколькими формами, называемыми изозимами или изоферментами. По определению, изоферменты – это молекулярные формы ферментов, выявляемые у особей одного и того же вида, обладающие субстратной специфичностью, но различающиеся своей первичной структурой и физико-химическими свойствами, подвижностью в электрическом поле, сродством к субстрату и ингибиторам, термостабильностью и так далее (JUPAC - JUB..., 1977). Современная трактовка изозимов подразумевает генетически обусловленные варианты ферментов, в отличие от ненаследуемых изменений белков – конформаций (Markert, 1975; Корочкин и др., 1977; Кирпичников, 1987). Кроме изоферментов, как известно, существуют белки, не обладающие ферментативной активностью. Аллельные варианты их называют обычно аллоформами. Использование электрофореза для выявления вариантов белков позволяет достаточно надежно определять гетерозиготы и гомозиготы в исследуемой выборке. К сожалению, не всегда просто на основе электрофореграмм идентифицировать генотипы. Затруднения обычно связаны с наличием нескольких конформационных состояний одного изозима. Весьма трудно поддаются расшифровке электрофореграммы, на которых зоны активности в гелях, соответствующие разным изозимам, сильно сближены или даже полностью совпадают. Наиболее эффективным способом, позволяющим выйти на определение генного контроля того или иного полиморфного фокуса, является гибридологический анализ. Для этого проводят скрещивание особей с различными белковыми фенотипами и последующее электрофоретическое исследование потомства.
Преимущества изучения генетической изменчивости, связанные с электрофоретическим разделением белков, привели к быстрому проникновению этого метода в популяционно-генетические исследования.
Собранный материал замораживали. Для электрофоретическото анализа брали пробы белой скелетной мышцы, печени, сердца и глаза. Электрофорез проводили в полиакриламидном геле в камерах (системы Трувеллера и Нефедова, 1964) с вертикальными блоками. Как основу использовали две основные методики: 1) диск-электрофорез (Davis, 1964), трис-HCl-буфер для разделяющего геля (рН=8,9); 2) трис-HCl-ЭДТА-боратная буферная система (рН=8,5) (Peacock et al., 1965). Хорошее разрешение большинство исследованных ферментативных систем давали в 7%-ном разделяющем геле. Для окраски использовали инкубационные смеси, согласно описаниям (Корочкин и др., 1977).
Таблица 43
Ферментные и неферментные белки различных форм хариусов
| БЕЛКИ
| КФ
| Кол-во локусов
| Формы
|
|
|
|
|
| Лактатдегидрогеназа
| 1.1.1.27
| 1-3
| +
| +
| +
|
| Малатдегидрогеназа
| 1.1.1.37
|
| +
| +
| +
|
| Малик-энзим
| 1.1.1.40
|
| +
| +
| -
|
| α-глицерофосфатдегидрогеназа
| 1.1.1.8
| 1-3
| +
| +
| +
|
| 6-фосфоглюконатдегидрогеназа
| 1.1.1.44
|
| +
| +
| +
|
| Изоцитратдегидрогеназа
| 1.1.1.42
|
| +
| -
| +
|
| Глутатионредуктаза
| 1.6.4.2
|
| -
| -
| +
|
| Супероксиддисмутаза
| 1.15.1.1
|
| +
| +
| +
|
| Аспартатаминотрансфераза
| 2.6.1.1
|
| +
| +
| +
|
| Глутаматпируваттрансаминаза
| 2.6.1.2
|
| -•
| -
| +
|
| Креатинкиназа
| 2.7.3.2
|
| +
| -
| -
|
| Фосфоглюкомутаза
| 2.7.5.1
|
| +
| +
| +
|
| Эстераза
| 3.1.1.-
|
| +
| +
| +
|
| Эстераза-D
| 3.1.1.-
|
| +
| +
| +
|
| Миогены
|
| 6-8
| +
| -
| -
|
| Общее количество исследованных локусов
|
| 27-30
| 25-28
| 13-16
| 19-21
|
Примечание: «+» – исследовано, «-» – не исследовано
Обозначения форм хариусов: 1 – восточносибирский, 2 – камчатский, 3 – амурский
Всего проанализировано 14 систем (от 7-ми до 13-ти у каждой из форм), которые кодируются 27-30 локусами. Сведения об изученных системах приведены в таблице 43. У части исследованных локусов,хотя ибыла выявлена изменчивость, невозможно было определить однозначно ее генетический контроль. Поэтому такие локусы исключены при вычислении средней гетерозиготности. Для сравнения форм применены два варианта. В первом рассчитывали индекс сходства и критерий идентичности (Животовский, 1982, 1983), используя частоты полученных электрофоретических вариантов. Во втором определяли генетические расстояния (Nei, 1972; Ней, 1981), оперируя аллельными частотами.
При проведении генетико-биохимических исследований кеты использован материал из 17-ти локальных популяций (более 50-ти выборок); горбуши – из 14-ти (около 60-ти выборок); нерки - из пяти (семь выборок); симы – из одной (одна выборка). В общей сложности исследовано более 30-ти локусов.
Популяционно-фенетический метод
Фенетический подход заключается в выявлении и изучении дискретных вариаций любых признаков (морфологических, физиологических и т.д.), маркирующих своим присутствием генетические особенности разных групп особей внутри вида (Яблоков, Ларина, 1985). Роль фенетики популяций и связь ее с другими разделами популяционной биологии рассмотрены довольно подробно в специальной литературе. По определению, фены – это дискретные альтернативные вариации какого-то признака или свойства (Яблоков, 1980, 1982).
Более подробно все перечисленные методы излагаются в специальных руководствах (Аббакумов, 1997; Макоедов, 1999; Макоедов, Коротаева, 1999).
Контрольные вопросы и задания
1. Методы исследования популяций и таксономических групп.
2. Вариационно-статистический метод.
3. Цитогенетический метод.
4. Генетико-биохимический метод.
5. Популяционно-фенетический метод.



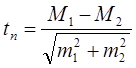 (64)
(64)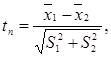
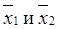 – средние значения признака;
– средние значения признака;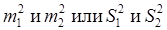 – квадраты стандартной ошибки (или ошибки средней).
– квадраты стандартной ошибки (или ошибки средней).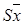 ·tp·
·tp· 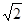 , где Sx - стандартная ошибка, tp - критерий Стьюдента при заданной вероятности, оценивает только разницу между средними.
, где Sx - стандартная ошибка, tp - критерий Стьюдента при заданной вероятности, оценивает только разницу между средними.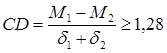 (65)
(65)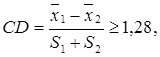
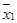 и
и 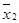 – средние значения признаков двух сравниваемых выборок;
– средние значения признаков двух сравниваемых выборок;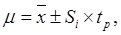 (66)
(66)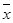 – средняя выборки;
– средняя выборки;


