

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
Топ:
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Интересное:
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Глава 4. Основы кинетики биохимических реакций и химического равновесия. (5-8)
1) Скорость химических реакции. Понятие о средней и истинной скорости реакции, о простых и сложных реакциях. Виды сложных реакций. Влияние концентрации реагентов на скорость химической реакции. Закон действующих масс, его применении к простым и сложным реакциям.
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени.
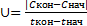 =
= 
Истинная скорость химической реакции характеризуется скорость в данный момент времени (Δtà 0)
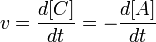
Средня я скорость химической реации по данному компоненту является усредненной скоростью за данный промежуток времени.
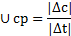
Простые, или элементарные, реакции – это реакции, протекающие в одну стадию.
Сложные реакции – это реакции, протекающие в несколько стадий, каждая из которых является простой реакцией.
Виды сложных реакций:
Учебник: 112-114.
4) Влияние температуры, давления, концентрации реагентов и катализатора на состояние равновесия (смещение равновесия, Кравн). Принцип Ле-Шателье, примените его к следующим обратимым процессам
а) N 2 (г.) + 3 H 2 (г.) ⇌ 2 NH 3 (г.), 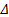 H <0
H <0
б) 2PH3 (г.) ⇌ 2P (т.) + 3H2 (г.), 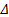 H>0
H>0
Повышение температуры вызывает смещение равновесия в сторону эндотермической реакции (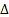 H>0), а понижение температуры – в сторону экзотермической реакции (
H>0), а понижение температуры – в сторону экзотермической реакции (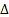 H<0). Кравн изменяется.
H<0). Кравн изменяется.
Давление в системе изменяет концентрацию только газообразных веществ, что вызывает смещение равновесия. Повышение давления в системе смещает химическое равновесие в направлении реакции, идущей с образованием меньшего числа молей газообразных веществ, т.е. в сторону уменьшения объема, а понижение давления в системе вызывает сдвиг равновесия в противоположную сторону. При равном числе молей газообразных исходных и конечных продуктов изменение давления не смещает химическое равновесие. При изменении давления, как и при изменении концентрации реагентов, величина Кравн не изменяется.
|
|
Увеличениеконцентрации исходных веществ вызывает смещение равновесия в сторону образования конечных продуктов. В то же время увеличение концентрации конечных продуктов вызывает смещение равновесия в сторону исходных веществ. Кравн не изменяется.
Принцип Ле-Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказывать воздействие путем изменения концентрации реагентов, давления или температуры в системе, то равновесие всегда смещается в направлении той реакции, протекание которой ослабляет это воздействие».
а) N2 (г.) + 3H2 (г.)⇌ 2NH3 (г.), 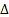 H<0 (экзотермическая реакция)
H<0 (экзотермическая реакция)
1) Наша система состоит из газов, следовательно, изменения давление будет влиять на смешение равновесия. При повышении давления равновесие системы будет смещаться в сторону, где находится меньшее количество молей газообразного вещества, т. е. в сторону NH3 (конечных продуктов). При понижении давления равновесия системы будет смещаться в сторону реакции, идущей с образование большего числа молей газа, следовательно, в сторону исходных веществ.
2) При повышении температуры равновесие смещается в сторону эндотермической реакции, в сторону исходных веществ. При понижении температуры равновесие смещается в сторону экзотермической реакции, в сторону конечных продуктов.
3) Увеличение концентрации исходных веществ смещает равновесие в сторону конечных продуктов =>NH3, и наоборот.
б) 2PH3 (г.) ⇌2P (т.) + 3H2 (г.), 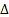 H>0 (эндотермическая реакция)
H>0 (эндотермическая реакция)
1) При повышении температуры равновесие смещается в сторону эндотермической реакции, следовательно, в сторону конечных продуктов реакции. При понижении температуры равновесие смещается в сторону экзотермической реакции, то есть в сторону исходных веществ.
|
|
2) Увеличение концентрации исходных веществ смещает равновесие в сторону конечных продуктов реакции, и наоборот, уменьшение концентрации исходных веществ смещает равновесие в сторону исходных веществ.
3) Так как в системе присутствует твердое вещество, то давление не будет влиять на смещение равновесия.
Учебник: 114-115
Учебник: 125-134.
2) Понятие о диффузии. Осмос. Осмотическое давление и факторы, влияющие на его величину. Закон Вант-Гоффа. Изотонический коэффициент, его значения для разбавленных растворов различных веществ. Сравните при одинаковой температуре и молярной концентрации осмотическое давление растворов следующих веществ:
а)NaCl, C6H12O6, CaCl2;
б)CH3COOH, KCl, C2H5OH
Диффузией в растворе называется самопроизвольный направленный процесс переноса частиц растворенного веществ и растворителя, который осуществляется при наличии градиента концентрации растворенного вещества и приводит к выравниванию концентрации этого вещества по всему объему раствора.
Осмосом называется самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью.
Осмотическим давлением (π) называют избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.
Факторы: число частиц в растворе, температура.
Закон Вант-Гоффа: «Осмотическое давление подчиняется объединенному газовому закону Менделеева – Клайперона π =icRT»
Изотонический коэффициент – для учета межмолекулярных взаимодействий в реальных растворах
i= 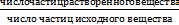
Для растворов неэлетролитов, молекулы которых не диссонируют и мало склонны к ассоциации, i = 1.
Для водных растворов электролитов вследствие диссоциации I> 1, причем максимальное его значении (Imax) для данного электролита равно числу ионов в его молекуле. NaClimax= 2, CaCl2imax=3, Na3PO4imax=4, Al2(SO4)3 = 5.
Для растворов, в которых вещество находится в виде ассоциатов, i< 1, что характерно для коллоидных растворов. Для растворов белков и ВМС величина i зависит от концентрации и природы этих веществ.
Сравните при одинаковой температуре и молярной концентрации осмотическое давление растворов следующих веществ:
|
|
а)NaCl, C6H12O6, CaCl2 (по изотоническому коэффициенту) NaCl и CaCl2 – электролиты, i для электролитов всегда > 1, следовательно, осмотическое давление электролитов NaCl и CaCl2 будет больше осмотического давления неэлетролита C6H12O6, потому что i для неэлетролитов всегда = 1. (π =icRT). Осмотическое давление CaCl2 (3) <NaCl (2) (по количеству ионов). CaCl2>NaCl>C6H12O6
б)CH3COOH, KCl, C2H5OH Осмотическое давление KCl> осмотического давления CH3COOH и C2H5OH. CH3COOH > 2, HCl = 2, C2H5OH <1. CH3COOH > HCl > C2H5OH.
Учебник: 140-142.
3) Фазовые равновесия. Диаграмма состояния воды. Давление насыщенного пара над растворами. I – ый закон Рауля. Температура кипения и кристаллизации растворов. II – ой закон Рауля, его применение к реальным системам.
Фазовые равновесия:
1) При температуре кипения в равновесии сосуществуют две фазы: жидкая и пар.
Температура кипения жидкости – это температура, при которой давление насыщенного пара над жидкостью становится равным внешнему давлению.
2) При температуре замерзания в равновесии сосуществуют три фазы: твердая, жидкая и пар.
Температура замерзания жидкости – это температура, при которой давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над кристаллами этой жидкости.
Фазовая диаграмма воды
Линия A p 0 – линия испарения, разделяющая жидкое и парообразное состояния, - определяет значение давления и температуры, при которых осуществляется кипение чистой воды.
Линия AB – линия плавление – показывает условия существования двухфазной жидкой системы лед – жидкая вода.
Линия AD – линия сублимации – разграничивает твердое и парообразное состояния воды.
В тройной точке A, отвечающей температуре замерзания воды или плавления льда при внешнем давлении, равном давлению насыщенного пара (+0,01o С; 0,006 атм), находясь в равновесии друг за другом, одновременно сосуществуют все три фазы: твердая, жидкая и парообразная.
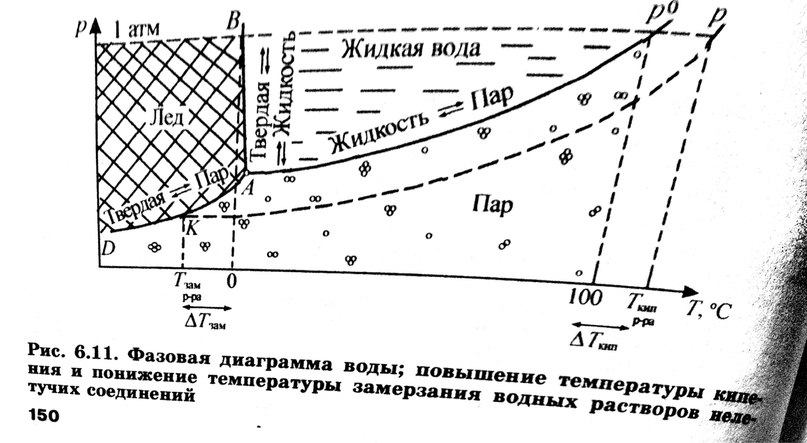
Давление пара, при котором при данной температуре в системе «жидкость – пар» наступает динамическое равновесие, характеризующееся равенством скоростей испарений и конденсации (Uисп=Uконд), называется давлением насыщенного пара.
|
|
Франсуа Мари Рауль (1886) сформировал свой первый закон следующим образом:
«При постоянной температуре относительное понижение давления насыщенного пара растворителя над идеальным раствором нелетучего вещества равно молярной доле растворенного вещества».
(p0 – p)/p0 = n/(n+N)
Температура кипения раствора нелетучего вещества всегда выше, чем температура кипения чистого растворителя.
Температура замерзания вещества всегда ниже, чем температура замерзания чистого растворителя.
Второй закон Франсуа Мари Рауля:
«повышение температуры кипения или понижение температуры замерзания идеальных растворов нелетучих веществ прямо пропорционально моляльной концентрации раствора:
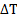 кип=Kэбb(X) (Kэб – эбулиоскопическая константа)
кип=Kэбb(X) (Kэб – эбулиоскопическая константа)
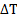 зам=Kкрb(X) (Kкр – криоскопическая константа)
зам=Kкрb(X) (Kкр – криоскопическая константа)
Для реальных растворов в формулы вводится изотонический коэффициент, так как для реальных растворов нужно учитывать межмолекулярные взаимодействия:
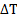 кип=iKэбb(X)
кип=iKэбb(X)
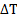 зам=iKкрb(X)
зам=iKкрb(X)
Законы Франсуа Мари Рауля используются для экспериментальных методов определения молярных масс растворимых веществ – эбулиоскопии и криоскопии основанных на измерении температуры кипения и температуре замерзания растворов этих веществ.
Учебник: 149-152.
Физиологические условия:
Ka*I = 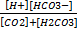 = 7, 95 * 10-7 pKa*I=6,1
= 7, 95 * 10-7 pKa*I=6,1
Стандартные условия:
KaI =  = 4,45 * 10-7 pKaI=6,36
= 4,45 * 10-7 pKaI=6,36
pH=pKa(BH)+ + lg  = 6,1 + lg
= 6,1 + lg 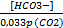
Если в кровь поступает кислота и увеличивается концентрация иона водорода, то он, взаимодействуя с HCO3-, смещает равновесие в сторону H2CO3 и приводит к выделению газообразного CO2, который выводится из организма в процессе дыхания через легкие.
H+ + HCO3- ⇌H2CO3⇌CO2 ↑ + H2O
Если в кровь поступает основание, оно связывается с угольной кислотой, и равновесие смещается в сторону HCO3-:
OH- + H2CO3⇌HCO3- + H2O
Главное значение гидрокарбонатного буфера заключается в нейтрализации кислот + обеспечивает 55 % буферной ёмкости крови.
Белковые (протеиновые) буферные системы бывают:
- Анионного типа. Анионный белковый буфер работает при pH>pIбелка и состоит из донора протонов – молекулы белка HProt и акцептора протонов –аниона белка (Prot)-.
H3N+-Prot-COO-⇌ H+ +H2N-Prot-COO-
При добавлении кислоты это равновесие смещается в сторону образования молекулы белка, а при добавлении основания в системе увеличивается содержание аниона белка.
- Катионного типа. Катионный белковый буфер работает при pH<pIбелка и состоит из донора протонов – катиона белка (H2Prot)+ и акцептора протона – молекулы белка HProt.
H3N+-Prot-COOH ⇌ H+ +H3N+-Prot-COO-
Глава 3. Основы химической термодинамики и биоэнергетики (1-4)
1) Основные термодинамические понятия: система, фаза, виды систем и их состояний. Экстенсивные и интенсивные параметры состояния системы. Термодинамические процессы и их характеристики.
|
|
Системой называют тело или группу взаимодействующих тел, фактически или мысленно выделяемых из окружающей среды.
В зависимости от однородности различают гомогенные и гетерогенные системы.
Гомогенная система – это однородная система, в которой нет частей, различающихся по свойства и разделенных поверхностями раздела. (Воздух, вода, истинные растворы).
Гетерогенные система – это разнородная система, состоящая из двух или более частей, отличающихся по свойствам, между которыми есть поверхность раздела, где свойства систем резко меняются. (Молоко, цельная кровь, смеси воды и льда, воды и масла).
В зависимости от характера взаимодействия с окружающей средой различают системы:
Изолированная система характеризуется отсутствием обмена энергией и веществом с окружающей средой.
Закрытая система обменивается с окружающей средой энергией, а обмен веществом исключен.
Открытая система обменивается с окружающей средой энергией и веществом, а, следовательно, и информацией.
Термодинамическая фаза — термодинамически равновесное состояние вещества, качественно отличное по своим свойствам от других равновесных состояний того же вещества. Подразумевается способность вещества переходить из одной фазы в другую. Разные фазы вещества могут иметь границу (поверхность) раздела между собой.
Термодинамическое равновесное состояние системы характеризуется постоянством всех свойств во времени в любой точке системы и отсутствием потоков вещества и энергии в системе.
Стационарное состояние системы характеризуется постоянством свойств во времени, которое поддерживается за счет непрерывного обмена веществом, энергией и информацией между системой и окружающей средой.
Переходное состояние характеризуется изменением свойств системы во времени.
Экстенсивные параметры – параметры, значения которых пропорциональны числу частиц в системе (масса, объем, количество вещества).
Интенсивные параметры – параметры, значения которых не зависят от числа частиц в системе (температура, давление, концентрация).
Термодинамические процессы:
- Изотермический процесс, T=const, Δ T =0
- Изобарический процесс, p = const, Δ p =0
- Изохорический процесс, V = const, Δ V =0
Учебник: 73-79.
2) Энтальпия системы и стандартная энтальпия образования простых и сложных веществ. Какие факторы влияют на энтальпию образования вещества? Энтальпия химической реакции. Закон Гесса и следствия из него.
Энтальпия – ТД функция, характеризуется энергетическое состояние системы при изобарно-изотермических условиях.
Стандартная энтальпия образования простых веществ в их наиболее термодинамически устойчивом агрегатном и аллотропном состоянии при стандартных условиях принимается равной нулю.
Стандартная энтальпия образования сложно вещества равна энтальпии реакции получения 1 моль этого вещества из простых веществ при стандартных условиях.
Закон Г.И. Гесса: «Энтальпия реакции, т. Е. тепловой эффект реакции, зависит только от природы и состояния исходных веществ и конечных продуктов и не зависит от пути, по которому протекает реакция».
Первое следствие: Энтальпия реакции равна разности алгебраической суммы энтальпий образования всех продуктов реакции и алгебраической суммы энтальпий образования всех исходных веществ.
Второе следствие: «Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком».
Учебник: 80-81.
3) Энтропия системы. Факторы, влияющие на энтропию системы. Стандартная энтропия образования вещества и энтропия химической реакции. Формулировка II закона термодинамики для изолированных систем.
Энтропия (S) – термодинамическая функция, характеризующая меру неупорядоченности системы, т.е. неоднородности расположения и движения ее частиц.
Энтропия простых веществ зависит от аллотропной формы. S(Cграфит) > S(Cалмаз), S(O2) <S(O3).
Энтропия системы при повышении температуры возрастает, так как увеличивается неупорядоченность движения частиц:
Если T1>T2, то S1>S2
Энтропия системы при повышении давления уменьшается, так как снижается неупорядоченность движения частиц:
Если p1>p2, то S1<S2
Энтропия системы с увеличением ее сложности повышается, так как возрастает число видов частиц и вариантов их расположения.
Стандартная энтропия S0, т.е. энтропия при давлении р =1,01·105 Па (1 атм);
Стандартная энтропия химической реакции 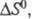 т.е. разница стандартных энтропий продуктов и реагентов.
т.е. разница стандартных энтропий продуктов и реагентов.
Формулировка II закона термодинамики для изолированных систем: «В Изолированных системах самопроизвольно могут совершать только такие необратимые процессы, при которых энтропия системы возрастает, т.е. ΔS>0
Учебник: 85-86.
4) Энергия Гиббса системы, стандартная энергия Гиббса образования вещества. Термодинамические критерии самопроизвольного протекания процесса – общая формулировка II -го закона термодинамики для любых систем.
Энергия Гиббса является обобщенной термодинамической функцией состояния системы, учитывающей энергетику и неупорядоченность системы при изобарно-изотермических условиях.
G = H - TS
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Термодинамический критерий самопроизвольности протекания процесса:
ΔG< 0 – экзэргонические (самопроизвольные) процессы
ΔG> 0 – эндэргонические процессы
ΔG = 0 – химическое равновесие
Общая формулировка II -го закона термодинамики для любых систем: «В системе при постоянной температуре и давлении самопроизвольно могут совершать только такие процессы, в результате которых энергия Гиббса уменьшается, т.е. ΔGкон < ΔGнач, или ΔG<0.
Учебник: 86 – 88.
|
|
|

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!