-Внутрикомплексные соединения (ВКС) — координационные соединения металлов с одинаковыми или различными бидентатными (обычно - органическими) ацидолигандами, связанными с одним и тем же атомом металла-комплексообразователя через одну отрицательно заряженную и одну нейтральную донорные группы с образованием одинаковых или различных внутренних металлоциклов (хелатных циклов), не содержащие внешнесферных ионов и являющиеся комплексами-неэлектролитами. Примером ВКС могут служить глицинат меди(П) и оксихинолинат цинка: О — Zn—О. ВКС представляют собой частный случай хелатных комплексных соединений (хелатов) металлов (ХКС), т. е. координационных соединений металлов с одинаковыми или различными отрицательно заряженными или нейтральными полидентатными лигандами (органическими или неорганическими), имеющих один или несколько одинаковых или раз личных хелатных циклов. ХКС обладают различными растворимостью и окраской, зависящими от природы как металла-комплексообразователя, так и лигандов, внешней сферы. ВКС и ХКС более устойчивы при диссоциации в растворах (табл. 7.2), чем комплексы тех же металлов с монодентатными лигандами, образующими аналогичные координационные связи. Комплексонаты металлов — частный случай ХКС — используются в количественном анализе для определения катионов различных металлов. Комплексонаты — координационные соединения металлов с анионами комплексонов — полиосновных аминокарбоновых или аминофосфорных кислот. Анионы комплексонов обычно выступают в роли полидентатных лигандов. Примеры комплексоиов: а) Комплексен I или нитрилотриуксусная кислота
Аммины, или амминокомплексы, или аммиакаты, или аммиачные комплексы металлов — координационные соединения металлов, содержащие молекулы координированного (т. е. связанного с атомом металла) аммиака. Молекулу аммиака, выступающую в роли монодентатного лиганда, называют аммином. Молекула аммиака связана с атомом металла донорно-акцепторной координационной связью через атом азота по схеме: М <- NH3. Донор электронной пары — атом азота, акцептор элек тронов — атом металла. Аминокомплексы — координационные соединения металлов с ней тральными лигандами.
Ацидокомплексы — координационные соединения, содержащие во внутренней сфере только ацидогруппы, т. е. отрицательно заряженные лиганды, в роли которых обычно выступают анионы кислот. Ацидокомплексы чаще всего относятся к комплексам-электролитам анионного типа, например: K4[Fe(CN)6], Na3[Co(N02)6], K[Sb(OH)6] и т.д. Для ацидо- комплексов характерны реакции внутрисферного замещения ацидогрупп на другие лиганды или молекулы растворителя, реакции гидролиза (соль волиза), изомеризации, обмена внешнесферных" ионов и другие реакции, определяющиеся природой центрального атома металла, ацидогрупп и внешними условиями.
34.Применение комплексных соединений в химическом анализе Осаждение катионов и анионов из растворов.
Катионы калия К+ осаждают с помощью гексахлороплатината натрия Na2[PtCl6| или плати- нахлористоводородной кислоты:
2К + +[PtCl6]2" -> K 2[PtCl6] 1 (желтый осадок)
Осаждение катионов аммония NH4 можно осуществить растворами гексахлороплатината натрия Na2[PtCl6] или платинахлористоводородной кислоты H2[PtCl6] (как и катионов калия):
2NH4 + [PtCl6]2" ->(N H 4)2[PtCl6] i (желтый осадок)
Растворение осад ков.
Для растворения осадка хлорида серебра AgCl используют реакцию образования растворимого комплекса
[Ag(NH3)2]Cl: AgCl + 2NH3 -> [Ag(NH3)2]+ + Cl-
Разделение ионов путем дробного осаждения или дробного рас творения. Ионы кадмия Cd2+ и цинка Zn2+ обладающие близкими свойствами, можно разделить дробным осаждением с последующим их определением. Для этого в раствор, содержащий смесь катионов кадмия и цинка, вводят тиокарбамид SC(NH2)2 и затем комплекс хрома(Ш) [Cr(NCS)4]-.
Образующийся растворимый тиокарбамидный комплекс кадмия Cd2+ + 2L = [CdL2 ]2+ где L — молекула тиокарбамида, осаждается в форме малорастворимого осадка красного цвета — комплекса состава [CdL2][Cr(NCS)4]2:
[CdL2]2+ + 2[Cr(NCS)4]- ->[CdL2][Cr(NCS)4]2
Осадок кадмиевого комплекса можно отделить от маточника, в котором остаются катионы цинка.
Открытие ионов по изменению окраски раствора вследствие об разования окрашенных комплексов.
Многие комплексные соединения обладают характерной окраской, что позволяет использовать их для открытия ионов в растворе. Так, катионы Fe2+ или Fe3+ можно открыть по образованию темно-синих осадков «турнбулевой сини» Fe"[Fen,(CN)6]2 и «берлинской лазури» Fe4I[Fe1,(CN)6]3 при реакциях с феррицианид- ионом [Fe(CN)6]3- и ферроцианид-ионом [Fe(CN)6]4" соответственно: 3Fe2+ +2[Fe(CN)6]3" -> F e3[Fe(CN)6]2 4> (турнбулева синь) 4Fe3+ +3[Fe(CN)6]4' -> F e4[Fe(CN)6]3 4- (берлинская лазурь.
36.Реакции,основанные на образовании комплексный соединений металлов с органическими реагентами.
При таких аналитических реакциях преимущественно применяются циклообразующие лиганды, способные к построению хелатных комплексов, особенно — внутрикомплексных соединений и комплексонатов металлов. Молекулы подобных лигандов должны содержать функционально-аналитические группы (ФАГ), способные образовывать с атомами металлов-комплексообразователей относительно прочные координационные связи, чаще всего — устойчивые металлоциклы. В состав ФАГ могут входить группы ОН, SH, NH, С=0, C=S, гетероатомы азота и др. Так, например, ионы меди(П) Си2+ при взаимодействии с органическими соединениями — а-ацилоиноксимами — образуют комплексы зеленого цвета, содержащие пятичленные металлоциклы: При реакциях ионов кадмия Cd2+ с органическими реагентами соста ва Ar-N=N-NH-Ar' (Аг и Ат' — арильные радикалы), содержащими в качестве ФАГ диазоаминогруппу, образуются комплексы красного цвета. Сурьма(Ш) дает малорастворимые белые осадки комплексов с ли гандами, имеющими в качестве ФАГ две соседние фенольные группы в ароматическом ядре, например, с пирогалолом.
37. Реакции без участия комплексных соединений металлов: образование окрашенных соединений с открываемыми веществами; образование органических соединений, обладающих специфическими свойствами.
Образование окрашенных соединений с открываемыми веществами
Дифениламин (C6H5)2NH) при реакциях в кислой среде с соединениями, содержащими окислители (NO2ˉ, NO3ˉ, BrO3ˉ, CrO42ˉ, MnO4ˉ, Fe3+ и др.) Окрашивает раствор в синий цвет вследствие необратимого окисления дифениламина в синий дифенилдифенохинондиимин. Эта реакция – фармакопейная, используется для открытия, например, нитратов и нитритов. С нитратами реакция протекает по схеме:
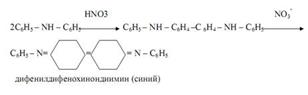
При выдерживании смеси синяя окраска постепенно переходит в бурую, а затем в жёлтую. Определению мешают сильные восстановители – такие, как сульфид-ион S2ˉ, сульльфит-ион SO32ˉ, тиосульфат-ион S2O32ˉ, иодид-ион Iˉ.
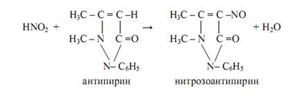
Антипирин используют для открытия нитрит-ионов NO2ˉ (реакция фармакопейная). В кислой среде (HCl, H2SO4) нитриты образуют с антипирином нитрозоантипирин изумрудно-зелёного цвета:
NO2ˉ + H3O+ = HNO2 + H2O
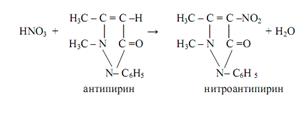
Нитраты образуют с антипирином в сильнокислой среде (концентрированная серная кислота) ярко-красный нитроантипирин
Образование органических соединений, обладающих специфическими свойствами
В ряде случаев в химическом анализе используют такие реакции с участием органических реагентов, в результате которых образуются продукты реакции, обладающие специфическими свойствами – запахом, окрашиванием пламени газовой горелки и т. д. Так, реакция образования сложных эфиров используется для открытия ацетат-ионов CH3СООˉ, борат-ионы BO3ˉ, B4O72-. При реакции с этанолом уксусная кислота даёт уксусноэтиловый эфир, обладающий характерным запахом:
CH3СООˉ + Н3О+ = CH3СООН + Н2О
CH3СООН + НOC2H5 = CH3СОО C2H5 + Н2О
Реакция – фармакопейная.
Летучие сложные эфиры борной кислоты окрашивают пламя в зелёный цвет. В присутствии серной кислоты и этанола борат-ионы образуют сложные эфиры:
B4O72- + Н+ + 5Н2О = Н3BO3
Н3BO3 + 3C2H5OН→ В(ОC2H5)3 + 3Н2О
При поднесении пламени к чашке или тиглю, в которых протекает эта реакция, продукты сгорания окрашивают пламя в зелёный цвет. Реакция – фармакопейная.









