Аналитическая химия и химический анализ. Основные ные понятия аналитической химии: метод анализа вещества, методика анализа, качественный химический анализ, количественный химический анализ, элементный анализ, функциональный анализ, молекулярный анализ, фазовый анализ.
Аналитическая химия - это раздел химической науки, разрабатывающий на основе фундаментальных законов химии и физики принципиальные методы и приемы качественного и количественного анализа атомного, молекулярного и фазового состава вещества.
Химический анализ – это совокупность методов, с помощью которых определяют химический состав веществ.
Метод анализа вещества - это краткое определение принципов, положенных в основу анализа вещества.
Методика анализа - подробное описание всех условий и операций, которые обеспечивают регламентированные характеристики, в том числе - правильности и воспроизводимости, результатов анализа.
Качественный химический анализ - это определение (открытие) химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе.
Количественный химический анализ - это определение количественного состава вещества, т.е. установление количества химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе.
Функциональный анализ - это открытие и определение различных функциональных групп, например аминогруппы NH2, нитрогруппы NO2, карбонильной С=О, карбоксильной СООН, гидроксильной ОН, нитрильной CN групп и др.
Молекулярный анализ – открытие молекул и определение молекулярного состава анализируемого вещества, т.е. выяснение того, из каких молекул и в каких количественных соотношениях состоит данный анализируемый объект.
Фазовый анализ – открытие и определение различных фаз (твердых, жидких, газообразных), входящих в данную анализируемую систему.
Основные разделы современной аналитической химии. Применение методов аналитической химии в фармации. Фармацевтический анализ. Фармакопейные методы.
Современная аналитическая химия включает три раздела:
- качественный химический анализ - это определение (открытие) химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе.
- количественный химический анализ - это определение количественного состава вещества, т.е. установление количества химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе.
- инструментальные (физические и физико-химические) методы анализа - это методы, основанные на использовании зависимостей между измеряемыми физическими свойствами веществ и их качественным и количественным составом.
ЛС представляют собой сложные химические вещества как неорганической, так и органической природы, и для контроля их качества используют весь комплекс аналитических методов анализа.
Сборником обязательных общегосударственных стандартов и положений, нормирующих качество лекарственных средств, является Государственная Фармакопея (ГФ), включает не только классические химические методы определения подлинности препаратов, а так же представлены современные инструментальные методы анализа.
Аналитический контроль лекарственных средств или определенных ингредиентов в препарате необходим, чтобы гарантировать их безопасность и эффективность на протяжении всего срока годности, включая хранение, распределение и использование.
Фармацевтический анализ – это комплекс приемов и методов, позволяющих провести оценку качества ЛС. Это один из важнейших разделов фармхимии, а проведение его является основным содержанием работы провизора-аналитика.
Фармакопейный метод – это анализ ЛС и изготовленных из них лекарственных форм по фармакопейной статье (ФС, ФПС, ВФС). Итогом является вывод о возможности или невозможности использования в медицине исследуемого объекта.
Аналитические признаки веществ и аналитические реакции. Типы аналитических реакций и реагентов. Характеристика чувствительности аналитических реакций (предельное разбавление, предельная концентрация, минимальный объём предельно разбавленного раствора, предел обнаружения, показатель чувствительности).
При проведении качественного анализа используют аналитические признаки веществ и аналитические реакции.
Аналитические признаки – такие свойства анализируемого вещества или продуктов его превращения, которые позволяют судить о наличии в нем тех или иных компонентов. Характерные аналитические признаки – цвет, запах, радиоактивность и др.
Аналитическая реакция – химическое превращение анализируемого вещества при действии аналитического реагента с образованием продукта с заметными аналитическими признаками (образования окрашенных соединений, выделение или растворения осадков, газов, окрашивание пламени газовой горелки и др). На результаты проведения аналитических реакций влияют температура, концентрация растворов, рН среды, присутствие других веществ.
Аналитические реакции и аналитические реагенты часто подразделяют на специфические, селективные, групповые. Специфические реагенты и реакции позволяют обнаружить данное вещество или данный ион в присутствии других веществ или ионов. Селективные реагенты и реакции позволяют обнаружить несколько веществ или ионов. Групповые реагенты и реакции (частный случай селективных) позволяют обнаружить ионы определенной аналитической группы.
Чувствительность аналитических реакций характерезуется:
Предельным разбавлением Vlin – максимальный объем раствора, в котором может быть однозначно обнаружен один грамм данного вещества при помощи данной аналитической реакции. Предельное разбавление выражается в мл/г.
Предельная концентрация clim – наименьшая концентрация, при которой определяемое вещество может быть обнаружено в растворе данной аналитической реакции. Предельная концентрация выражается в г/мл. clim = 1/Vlim
Минимальный объем предельно разбавленного раствора Vmin – наименьший объем анализируемого вещества, необходимый для обнаружения открываемого вещества данной аналитической реакции. Выражается в мл.
Предел обнаружения m (в мкг) – наименьшая масса определяемого вещества, однозначно открываемого данной аналитической реакцией в минимальном объеме предельно разбавленного раствора. m = clim ∙Vmin ∙106 = Vmin ∙106/Vlim
Показатель чувствительности аналитической реакции определяется как
p∙clim = –lgclim = –lg(1/Vlim) = lgVlim
4.
5..Подготовка образца к анализу. Средняя проба. Отбор средней пробы жидкости, твёрдого тела (однородного и неоднородного вещества). Масса пробы.
Объекты качественного и количественного анализа могут представлять собой как гомогенные газообразные, жидкие или твердые вещества, так и гетерогенные смеси. Для проведения анализа отбирают определенное количество анализируемого материала – пробу.
Проб а – часть анализируемого материала, представительно отражающая его химический состав.
Средняя проба – это небольшая представительная часть вещества, состав и свойства которой идентичны составу и свойствам всей массы анализируемого вещества.
Перед отбором пробы жидкость тщательно перемешивают, после чего отбирают часть ее, необходимую для проведения анализа.
Перед отбором пробы твердого вещества проводят предварительное визуальное исследование анализируемого материала для определения его цвета, степени однородности, вероятного числа составляющих компонентов, формы и величины частиц. При этом используют лупу, микроскоп и другие приборы и инструменты.
Твердое вещество однородно, если оно состоит из частиц, одинаковых по размеру и химическому составу. В этом случае отбирают часть анализируемого вещества, измельчают его, растирая в однородный порошок, и подвергают анализу.
Твердое вещество неоднородно, если оно состоит из частиц, различных по размеру и химическому составу. В этом случае отбор пробы включает три операции: измельчение анализируемого материала, просеивание частиц через сита и деление полученного порошка на части, из которых отбирается масса вещества, необходимая для проведения анализа.
Для проведения анализа твердую пробу обычно растворяют в подходящем растворителе: в воде, в водных растворах кислот, в органических растворителях, в растворах, содержащих комплексообразующие компоненты и т.д.
Масса пробы - отобранная для анализа часть объекта исследования. Она должнабыть представиельной, т. е. достаточно точно отражать хим. состав объекта.
Подготовка образца к анализу. Растворение пробы (в воде, в водных растворах кислот, в других растворителях), обработка пробы насыщенными растворами соды, поташа или её сплавление с солями.
Объекты качественного и количественного анализа могут представлять собой как гомогенные газообразные, жидкие или твердые вещества, так и гетерогенные смеси. Для проведения анализа отбирают определенное количество анализируемого материала – пробу.
Для проведения анализа твердую пробу обычно растворяют в подходящем растворителе: в воде, в водных растворах кислот, в органических растворителях, в растворах, содержащих комплексообразующие компоненты, и т.д.
Вначале проверяют растворимость пробы в дистиллированной воде при комнатной температуре, затем – при нагревании. При этом выясняют, растворяется ли проба в воде полностью или частично. Если проба не растворяется в воде, то испытывают ее растворимость в водных растворах разбавленных и концентрированных кислот: в уксусной СН3СООН, соляной НСl, азотной НNО3, серной H2SО4 и т.д. Если вещество не растворяется ни в разбавленных, ни в концентрированных кислотах, то испытывают его растворимость в царской водке – смеси концентрированных азотной и хлороводородной кислот.
При необходимости проверяют растворимость пробы в подходящих органических растворителях или в растворах, содержащих различные реагенты.
Если твердая проба не растворяется ни в одном из использованных растворителей, то в ряде случаев ее переводят в растворимое состояние обработкой при нагревании насыщенными растворами соды Na2CО3, поташа К2СО3 или же сплавлением части пробы с этими солями, гидросульфатами щелочных металлов (NaHSО4), пиросульфатом калия К2S2О7 с щелочами и другими веществами. При такой обработке, например, некоторые катионы переходят в растворимые в водных кислотах карбонаты, основные соли, гидроксиды, оксиды.
После перевода пробы в раствор последний подвергают анализу.
Применение закона действующих масс в аналитической химии. Химическое равновесие. Константа химического равновесия (истинно термодинамическая, концентрационная). Условная константа химического равновесия.
Химическое равновесие: состояние химического равновесия характеризуется постоянством соотношения равновесных концентраций всех продуктов реакции и исходных веществ при постоянной температуре, динамичностью, подвижностью, возможностью самопроизвольного достижения равновесия с разных сторон - либо со стороны исходных веществ (когда для проведения реакции берутся только исходные вещества), либо со стороны продуктов реакции (когда в систему вводятся только продукты реакции).
Конста́нта химического равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.

При постоянной ионной силе раствора концентрационная константа равновесия Кс не зависит от концентраций реагентов, коэффициентов активности ионов, а зависит только от природы рассматриваемой системы и температуры, т.е. играет роль истинной константы равновесия.
Истинная термодинамическая константа равновесия зависит только от температуры.
Константу равновесия, выраженную через концентрации частиц, называют концентрационной константой равновесия. Ее числовое значение зависит не только от температуры, но и от величины ионной силы раствора.
Условную константа равновесия выражается не через равновесные концентрации каждого участника реакции, а через их суммарные (аналитические) концентрации в растворе. Условная константа равновесия по форме напоминает концентрационную константу равновесия, однако она зависит от условий — от целого ряда параметров, таких, как температура, концентрации реагентов, ионная сила раствора, концентрации других веществ, присутствующих и растворе, рН раствора и т.
13. Гетерогенные равновесия в аналитической химии. Способы выражения растворимости малорастворимых электролитов.
Гетерогенная система - это система, состоящая из нескольких фаз, например, из двух несмешивающихся жидких фаз, из твердой и жидкой фаз и т. д.
Гетерогенное равновесие ˗ это равновесие, устанавливающееся на границе раздела фаз.
В аналитической химии часто встречаются гетерогенные системы и равновесия двух типов: осадок (твердая фаза) какого-либо вещества, находящийся в равновесии с насыщенным раствором того же вещества (жидкая фаза), и две равновесные жидкие фазы, например, водный раствор и органический растворитель, не смешивающиеся друг с другом, между которыми распределено растворенное вещество, находящееся в равновесии с обеими жидкими фазами.
Примером системы первого типа может служить насыщенный водный раствор сульфата бария ВаSO4, находящийся в равновесии с осадком сульфата бария:
ВаSO4 ↔ Ва2+ + SO42-
осадок раствор
Примером системы второго типа может служить экстракционная система, состоящая из слоя жидкого тетрахлорида углерода CCl4, над которым расположен водный слой; причем в обеих контактирующих жидких фазах растворен молекулярный иод I2, вследствие чего жидкая органическая фаза окрашена в фиолетовый цвет (основная часть иода содержится в жидкой органической фазе), а водная ˗ в желтый:
I2 (органическая фаза) ↔ I2 (водный раствор).
В гетерогенной системе при постоянной температуре рано или поздно самопроизвольно достигается состояние равновесия.
Растворимость - концентрация насыщенного раствора данного вещества при определенной температуре. Используют различные способы выражения растворимости, например, массовую растворимость вещества cm , молярную растворимость вещества S и др. Массовая растворимость вещества cm - это масса растворенного вещества в граммах, содержащаяся в одном литре его насыщенного раствора: cm = m/V, где т ˗ масса растворенного вещества, г; V ˗ объем насыщенного раствора, л. Массовая растворимость вещества выражается в г/л. Молярная растворимость вещества S ˗ это количество растворенного вещества (т. е. число молей этого вещества), содержащееся в одном литре его насыщенного раствора: S = m/(MV) где т ˗ масса растворенного вещества, г; М ˗ молярная масса растворенного вещества в г/моль; V ˗ объем насыщенного раствора, л. Молярная растворимость вещества выражается в моль/л.
14. Произведение растворимости малорастворимого сильного электролита. Условия образования осадков малорастворимых сильных электролитов.
Произведение растворимости малорастворимого сильного электролита ˗ это величина, равная произведению равновесных активностей (или равновесных концентраций) ионов данного электролита в его насыщенном растворе в степенях, равных соответствующим стехиометрическим коэффициентам. Применимо к сильным электролитам, у которых молярная растворимость S ≤ 10-2 моль/л. Обозначается символами ПР, L, Kso и т.д.
а) Произведение растворимости сульфата бария для водных растворов.
В гетерогенной системе, состоящей из находящихся в равновесии осадка сульфата бария и его насыщенного раствора, устанавливается гетерогенное равновесие ВаSO 4 ↔ Ва2+ + SO 42- (в растворе) Сульфат бария — сильный электролит. В водном растворе он полностью распадается на ионы. Непродиссоциировавшие молекулы ВаSO 4 в водном растворе не существуют. По определению
ПР (ВаSO4) = а( Ва2+) а( SO 42-) = [ Ва2+][ SO 42- ] f ( Ва2+) f ( SO 42-).
Так как растворимость сульфата бария в воде очень мала (~10-5 моль/л), то концентрация ионов бария и сульфат-ионов ничтожно мала и их коэффициенты активности практически равны единице. Тогда ПР (ВаSO4) = [ Ва2+][ SO 42- ]. При комнатной температуре ПР (ВаSO4) = 1,1 ∙ 10-10.
Условия образования осадка. Осадок образуется только тогда когда концентрация раствора становиться выше концентрации насыщенного раствора. Обычно стараются проводить осаждение в таких условиях когда степень пресыщения мала. Условия получения кристаллических осадков: осаждение следует вести из разбавленного анализируемого раствора разбавленным раствором осадителя, раствор осадителя прибавляют медленно, по каплям, выпавший осадок оставляют на некоторое время для созревания осадка. Условия получения аморфных осадков: к горячему конц. анализ. раствору +гор. конц.р-р осадителя, при необходимости вводят электролит-коагулятор. Определяют большинство катионов металлов, анионов лек. растительного сырья
Ортофосфат натрия
КН2РO4 + Nа2НРO4
ацетатный буфер - водный раствор уксусной кислоты и ацетатанатрия СН3СООН + СН3СОONa
Часто используют
-смесь слабой кислоты и ее соли (например,
муравьиная кислота и формиат натрия НСООН+ НСООNа - формиатный буфер)
-смесь слабого основания и соли этого основания аммиак и хлорид аммония NH 3 H 2 O NH 4Cl - аммиачный буфер).
Образование окрашенных соединений с открываемыми веществами
Дифениламин (C6H5)2NH) при реакциях в кислой среде с соединениями, содержащими окислители (NO2ˉ, NO3ˉ, BrO3ˉ, CrO42ˉ, MnO4ˉ, Fe3+ и др.) Окрашивает раствор в синий цвет вследствие необратимого окисления дифениламина в синий дифенилдифенохинондиимин. Эта реакция – фармакопейная, используется для открытия, например, нитратов и нитритов. С нитратами реакция протекает по схеме:
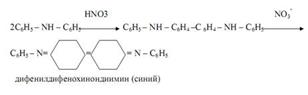
При выдерживании смеси синяя окраска постепенно переходит в бурую, а затем в жёлтую. Определению мешают сильные восстановители – такие, как сульфид-ион S2ˉ, сульльфит-ион SO32ˉ, тиосульфат-ион S2O32ˉ, иодид-ион Iˉ.
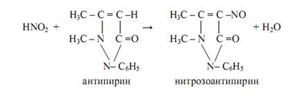
Антипирин используют для открытия нитрит-ионов NO2ˉ (реакция фармакопейная). В кислой среде (HCl, H2SO4) нитриты образуют с антипирином нитрозоантипирин изумрудно-зелёного цвета:
NO2ˉ + H3O+ = HNO2 + H2O
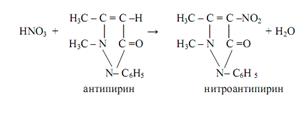
Нитраты образуют с антипирином в сильнокислой среде (концентрированная серная кислота) ярко-красный нитроантипирин
Образование органических соединений, обладающих специфическими свойствами
В ряде случаев в химическом анализе используют такие реакции с участием органических реагентов, в результате которых образуются продукты реакции, обладающие специфическими свойствами – запахом, окрашиванием пламени газовой горелки и т. д. Так, реакция образования сложных эфиров используется для открытия ацетат-ионов CH3СООˉ, борат-ионы BO3ˉ, B4O72-. При реакции с этанолом уксусная кислота даёт уксусноэтиловый эфир, обладающий характерным запахом:
CH3СООˉ + Н3О+ = CH3СООН + Н2О
CH3СООН + НOC2H5 = CH3СОО C2H5 + Н2О
Реакция – фармакопейная.
Летучие сложные эфиры борной кислоты окрашивают пламя в зелёный цвет. В присутствии серной кислоты и этанола борат-ионы образуют сложные эфиры:
B4O72- + Н+ + 5Н2О = Н3BO3
Н3BO3 + 3C2H5OН→ В(ОC2H5)3 + 3Н2О
При поднесении пламени к чашке или тиглю, в которых протекает эта реакция, продукты сгорания окрашивают пламя в зелёный цвет. Реакция – фармакопейная.
Индикаторы группы азосоединений (азоиндикаторы) - это многочисленная группа индикаторов, являющихся производными пара-аминобензола и пара-диметиламинобензола, которые сами по себе практически не растворимы в воде. При введении сульфогрупп или карбоксильных групп в молекулы этих соединений получаются растворимые в воде азокрасители, обычно имеющие красную окраску в кислой среде и жёлтую – в щелочной. К индикаторам этой группы, помимо метилового оранжевого, относятся ализариновый жёлтый, метиловый жёлтый, метиловый красный, тропеолины и др
Трифенилметановые индикаторы. Индикаторы этой группы также часто применяются в кислотно-основном титровании. Все они формально могут рассматриваться как производные трифенилметана. Из индикаторов этой группы распространены фенолфталеины, сульфофталеины, анилинсульфофталеины, бензеины, собственно трифенилметановые красители.
Нитроиндикаторы представляют собой ароматические нитропроизводные, например, паранитрофенол, который в растворе претерпевает превращения:

Интервал перехода лежит в пределах рН от 5, 6 (бесцветный) до 7, 6 (жёлтый). К этой группе индикаторов относятся также мета- и ортонит-рофенолы, динитрофенолы и некоторые другие.
Индикаторы других структурных типов. Эта групп включает все остальные индикаторы различного строения, не относящиеся к вышеописанным, например лакмус, оксиновый синий, нейтральный красный, индофенолы, экстракты растений и др. Кроме того, по способу применения индикаторы можно разделить на внутренние и внешние. Внутренние индикаторы добавляются непосредственно в титруемый раствор. Подавляющее число кислотно-основных индикаторов – внутренние. Внешние индикаторы находятся вне титруемого раствора. Примером может служить лакмусовая бумага. В парах аммиака влажная лакмусовая бумага синеет. К внешним индикаторам относится индикаторная бумага, предназначенная для приблизительного определения значения рН раствора.
39. Некоторые основные понятия (разделение, концентрирование, коэффициент (фактор) концентрирования). Классификация методов разделения и концентрирования (методы испарения, озоление, осаждение, соосаждение, кристаллизация, экстракция, избирательная адсорбция, электрохимические и хроматографические методы).
Разделение – это операция (процесс), в результате которой компоненты, составляющие исходную смесь, отделяются один от другого.
Концентрирование – операция (процесс), в результате которой повышается отношение концентрации или количества микрокомпонентов к концентрации или количеству макрокомпонента.
Коэф. концентрирования показывает, во сколько раз изменилось отношение абс. кол-в микрокомпонента и матрицы при концентрировании: где Q
к и Q
пр - абс. кол-ва матрицы соотв. в концентрате и пробе.
Методы:
Испарение – это процесс разделения и очистки веществ, при котором жидкое или твердое вещество при нагревании переходит в газообразное состояние (испаряется из смеси), а затем при охлаждении конденсируется, образуя снова жидкую или иногда твердую фазу.
Выделяют методы: отгонки, фракционного испарения (дистилляции), возгонки.
Отгонка или простое выпаривание – одноступенчатый процесс разделения и концентрирования веществ.
Дистилляция или фракционное испарение основана на разной летучести веществ. Разделение и концентрирование компонентов смеси происходит за счет различия их точек кипения и испарения отдельных компонентов при разной температуре в разное время.
Возгонка (сублимация) – это перевод вещества из твердого состояния в газообразное и его последующее осаждение в твердой форме (минуя жидкую фазу). Для сублимации микроколичеств веществ часто используют метод «холодного пальца», при котором следовый компонент конденсируется на охлажденном стержне, расположенном внутри закрытого сосуда непосредственно над обогреваемым образцом; при необходимости система вакуумируется.
Методы озоления – это методы концентрирования, заключающиеся в минерализации объектов анализа – органических и металлоорганических соединений, животных и растительных материалов, почв для последующего элементного анализа.
Осаждение – разделение (систематический ход анализа); концентрирование (осаждение определяемого иона из большого объёма анализируемого раствора и растворение осадка в малом объёме)
Соосаждение – одновременное осаждение из одного и того же раствора растворимого в данных условиях микрокомпонента с выпадающим в осадок макрокомпонентом.
Экстракция – метод извлечения вещества из раствора или сухой смеси с помощью подходящего растворителя. Для извлечения из раствора применяются растворители, не смешивающиеся с этим раствором, но в которых вещество растворяется лучше, чем в первом растворителе. Экстракция применяется в химической, нефтеперерабатывающей, пищевой, металлургической, фармацевтической отраслях.
Хроматография – динамический сорбционный метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами – неподвижной (твердая фаза или жидкость, связанная на инертном носителе) и подвижной (газовая или жидкая фаза).
40. Применение экстракции в аналитической химии. Принцип метода жидкостной экстракции. Некоторые основные понятия жидкостной экстракции: экстрагент, экстракционный реагент, экстракт, реэкстракция, реэкстрагент, реэкстракт.
Применени е экстракции для отделения определяемых ионов от ионов, мешающих определению, хорошо сочетается с физико-химическими (фотоколориметрическим, полярографическим и другими) методами определения отделенного иона в экстракте. В некоторых случаях такие определения могут быть проведены непосредственно в самом растворе после экстракции.
Жидкостная экстракция — это метод извлечения ценных компонентов из растворов, основанный на том, что при контактировании водного раствора, содержащего ценный компонент, с нерастворимыми в воде органическими жидкостями (экстрагентами) определенная часть этого компонента переходит (экстрагируется) в органическую жидкость. Обработка раствора экстрагентом может выполняться неоднократно, в результате чего достигается высокое извлечение полезного компонента.
Экстрагентом называют органический растворитель (содержащий или не содержащий другие компоненты), который извлекает вещество из водной фазы.
Реагент – это составная часть экстрагента, химически взаимодействующая с извлекаемым элементом, причем это взаимодействие является основным фактором, определяющим процесс экстракции. Реэкстракция – процесс обратного извлечения экстрагированного вещества из экстракта в водную фазу Реэкстрагент – водный раствор или вода, применяемая для извлечения экстрагированного вещества из экстракта. Реэкстракт – отделенная водная фаза, содержащая извлеченное из экстракта вещество.
Органическую фазу, содержащую извлеченное из водной фазы вещество в виде ЭС, называют экстрактом.
Классификация экстракционных систем, используемых в химическом анализе: ионные ассоциаты (металлосодержащие кислоты и их соли, минеральные кислоты, координационно-несольватированные ионные ассоциаты, гетерополисоединения, экстрагируемые кислородсодер-жащими растворителями). Использование процессов экстракции в фармацевтическом анализе.
Ионные ассоциаты могут формироваться соединениями, состоящими из крупных катионов или анионов с малым зарядом. В водных растворах эти соединения диссоциируют на ионы, а в органическую фазу переходят в неионизированном состоянии (не диссоциированны). Ионные ассоциаты характерны для следующих системы.
Минеральные кислоты – HCl, HBr, HJ, HNO3, HClO4, H2SO4 при их экстракции растворителями, обладающими основными свойствами, такими, как трибутилфосфат, амины с высокой молекулярной массой, спирты, простые и сложные эфиры.
Комплексные металлокислоты и их соли – HFeCl4, HSbCl6, H2CoCl4. Такие соединения экстрагируются кетонами, спиртами, эфирами и аминами.
Координационно - несольватированные ионные ассоциаты – соли крупных гидрофобных («отталкивающих» воду) катионов и анионов. Например анион тетрафенилборат [B(C6H5)4]-, в виде комплекса с которым экстрагируются катионы тяжелых щелочных металлов: цезий, рубидий. Экстракцию таких комплексов осуществляют высокополярными органическими растворителями.
Гетерополисоединения, экстрагируемые кислородсодержащими растворителями. Эти системы используют для экстракции мышьяка, вольфрама, ванадия, фосфора и кремния.
Использование процессов экстракции в фармацевтическом анализе..
На практике процессы комплексообразования часто сочетают с экстракцией.
Так, еще несколько столетий назад некоторые препараты, парфюмерные вещества, красители готовили по методикам, в которых применялась экстракция.
Классификация.
Аналитическая химия и химический анализ. Основные ные понятия аналитической химии: метод анализа вещества, методика анализа, качественный химический анализ, количественный химический анализ, элементный анализ, функциональный анализ, молекулярный анализ, фазовый анализ.
Аналитическая химия - это раздел химической науки, разрабатывающий на основе фундаментальных законов химии и физики принципиальные методы и приемы качественного и количественного анализа атомного, молекулярного и фазового состава вещества.
Химический анализ – это совокупность методов, с помощью которых определяют химический состав веществ.
Метод анализа вещества - это краткое определение принципов, положенных в основу анализа вещества.
Методика анализа - подробное описание всех условий и операций, которые обеспечивают регламентированные характеристики, в том числе - правильности и воспроизводимости, результатов анализа.
Качественный химический анализ - это определение (открытие) химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе.
Количественный химический анализ - это определение количественного состава вещества, т.е. установление количества химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе.
Функциональный анализ - это открытие и определение различных функциональных групп, например аминогруппы NH2, нитрогруппы NO2, карбонильной С=О, карбоксильной СООН, гидроксильной ОН, нитрильной CN групп и др.
Молекулярный анализ – открытие молекул и определение молекулярного состава анализируемого вещества, т.е. выяснение того, из каких молекул и в каких количественных соотношениях состоит данный анализируемый объект.
Фазовый анализ – открытие и определение различных фаз (твердых, жидких, газообразных), входящих в данную анализируемую систему.
Основные разделы современной аналитической химии. Применение методов аналитической химии в фармации. Фармацевтический анализ. Фармакопейные методы.
Современная аналитическая химия включает три раздела:
- качественный химический анализ - это определение (открытие) химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе.
- количественный химический анализ - это определение количественного состава вещества, т.е. установление количества химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе.
- инструментальные (физические и физико-химические) методы анализа - это методы, основанные на использовании зависимостей между измеряемыми физическими свойствами веществ и их качественным и количественным составом.
ЛС представляют собой сложные химические вещества как неорганической, так и органической природы, и для контроля их качества используют весь комплекс аналитических методов анализа.
Сборником обязательных общегосударственных стандартов и положений, нормирующих качество лекарственных средств, является Государственная Фармакопея (ГФ), включает не только классические химические методы определения подлинности препаратов, а так же представлены современные инструментальные методы анализа.
Аналитический контроль лекарственных средств или определенных ингредиентов в препарате необходим, чтобы гарантировать их безопасность и эффективность на протяжении всего срока годности, включая хранение, распределение и использование.
Фармацевтический анализ – это комплекс приемов и методов, позволяющих провести оценку качества ЛС. Это один из важнейших разделов фармхимии, а проведение его является основным содержанием работы провизора-аналитика.
Фармакопейный метод – это анализ ЛС и изготовленных из них лекарственных форм по фармакопейной статье (ФС, ФПС, ВФС). Итогом является вывод о возможности или невозможности использования в медицине исследуемого объекта.
Аналитические признаки веществ и аналитические реакции. Типы аналитических реакций и реагентов. Характеристика чувствительности аналитических реакций (предельное разбавление, предельная концентрация, минимальный объём предельно разбавленного раствора, предел обнаружения, показатель чувствительности).
При проведении качественного анализа используют аналитические признаки веществ и аналитические реакции.
Аналитические признаки – такие свойства анализируемого вещества или продуктов его превращения, которые позволяют судить о наличии в нем тех или иных компонентов. Характерные аналитические признаки – цвет, запах, радиоактивность и др.
Аналитическая реакция – химическое превращение анализируемого вещества при действии аналитического реагента с образованием продукта с заметными аналитическими признаками (образования окрашенных соединений, выделение или растворения осадков, газов, окрашивание пламени газовой горелки и др). На результаты проведения аналитических реакций влияют температура, концентрация растворов, рН среды, присутствие других веществ.
Аналитические реакции и аналитические реагенты часто подразделяют на специфические, селективные, групповые. Специфические реагенты и реакции позволяют обнаружить данное вещество или данный ион в присутствии других веществ или ионов. Селективные реагенты и реакции позволяют обнаружить несколько веществ или ионов. Группов












